- 2021-05-25 发布 |
- 37.5 KB |
- 32页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
山东省2021届高三等级考化学冲刺卷(五) Word版含答案
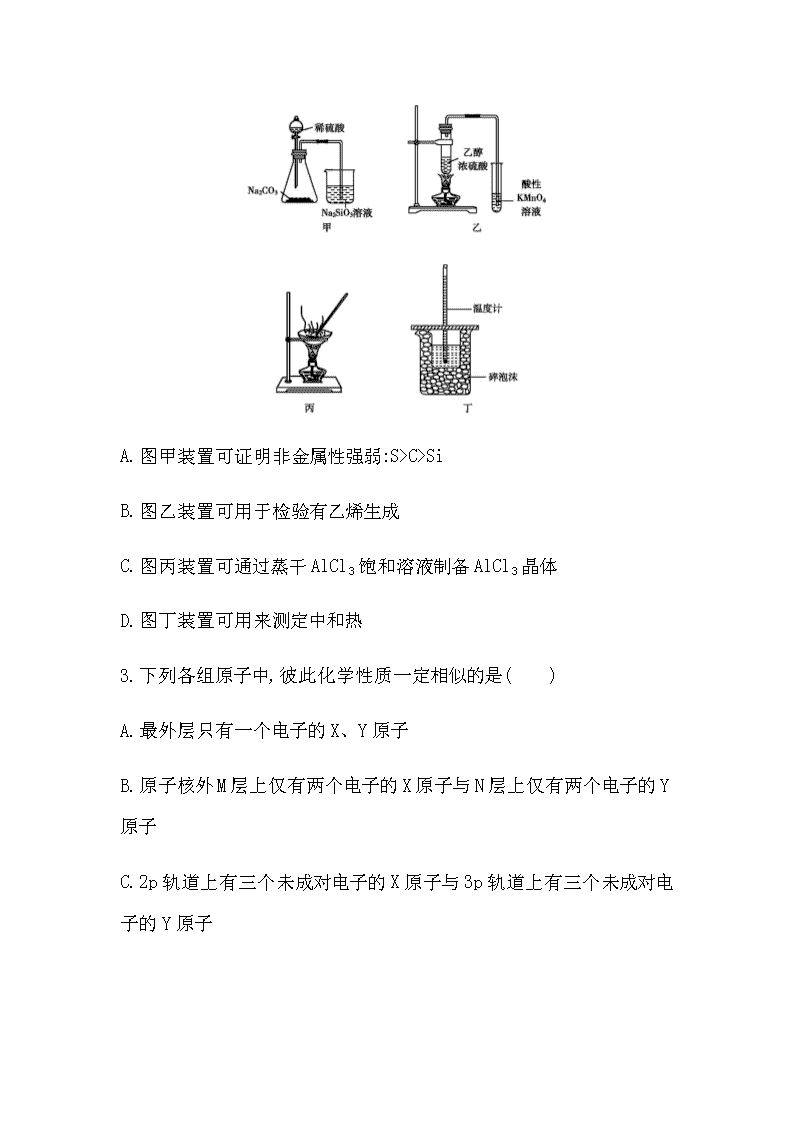
等级考仿真冲刺卷(五) (时间:90 分钟 满分:100 分) 可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Cl 35.5 Ca 40 Fe 56 Cu 64 一、选择题:本题共 10 小题,每小题 2 分,共 20 分。每小题只有一个 选项符合题目要求。 1.宋代张杲《医说》记载:每每外出,用雄黄桐子大,在火中烧烟薰脚 绷、草履、领袖间,以消毒灭菌,防止疫菌通过衣物的接触而传染。下 列说法错误的是( ) A.雄黄中硫的价态为-2价 B.古代烟熏的消毒原理与 H2O2、酒精相同 C.人们佩戴的药剂香囊具有驱虫抑疫、防病保健等功效 D.生活中也可使用火、盐水消毒器具 2.下列实验操作能达到实验目的的是( ) A.图甲装置可证明非金属性强弱:S>C>Si B.图乙装置可用于检验有乙烯生成 C.图丙装置可通过蒸干 AlCl3饱和溶液制备 AlCl3晶体 D.图丁装置可用来测定中和热 3.下列各组原子中,彼此化学性质一定相似的是( ) A.最外层只有一个电子的 X、Y 原子 B.原子核外 M层上仅有两个电子的 X原子与 N层上仅有两个电子的 Y 原子 C.2p轨道上有三个未成对电子的X原子与 3p轨道上有三个未成对电 子的 Y 原子 D.原子核外电子排布式为 1s 2 的 X 原子与原子核外电子排布式为 1s 2 2s 2 的 Y 原子 4.短周期元素 X、Y、Z、W 的原子序数依次增大。X 的原子半径比 Y 的小,且 X 与 Y的最外层电子数之和等于 Z的最外层电子数。X与 W 同主族,Z 是地壳中含量最高的元素。下列说法不正确的是( ) A.原子半径的大小顺序:r(W)>r(Y)>r(Z)>r(X) B.元素 Z、W 的简单离子的电子层结构相同 C.元素 Y 的简单气态氢化物的热稳定性比 Z 的强 D.X、Y两种元素可形成分别含有 10e - 和 18e - 的化合物 5.色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高 等植物中。纯净的色氨酸为白色或微黄色结晶,微溶于水、易溶于盐 酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是 ( ) A.色氨酸的分子式为 C11H12N2O2 B.色氨酸能发生取代、加成、酯化、中和反应 C.色氨酸微溶于水而易溶于酸或碱溶液是因为其与酸、碱都能反应生 成盐 D.将色氨酸与甘氨酸(NH2CH2COOH)混合,在一定条件下最多可形成三 种二肽 6.实验小组进行如下实验: 已知:Cr2(SO4)3稀溶液为蓝紫色;Cr(OH)3为灰绿色固体,难溶于水。下 列关于该实验的结论或叙述不正确的是( ) A.①中生成蓝紫色溶液说明 K2Cr2O7在反应中表现了氧化性 B.操作Ⅱ中仅发生反应:Cr 3+ +3OH - Cr(OH)3↓ C.将①与③溶液等体积混合会产生灰绿色浑浊,该现象与 Cr 3+ 的水解 平衡移动有关 D.若继续向③中加入稀硫酸,溶液有可能重新变成蓝紫色 7.设 NA为阿伏加德罗常数的数值,下列说法正确的是( ) A.23 g Na 与足量 H2O 反应完全后可生成 NA个 H2分子 B.1 mol Cu 和足量热浓硫酸反应可生成 NA个 SO3分子 C.标准状况下,22.4 L N2和 H2混合气中含 NA个原子 D.3 mol 单质 Fe 完全转变为 Fe3O4,失去 8NA个电子 8.某微生物电池在运行时可同时实现净化有机物污水、净化含 Cr2O7 2- 废水(pH 约为 6)和淡化食盐水,其装置示意图如图所示。图中,D和 E 为离子交换膜,Z为待淡化食盐水(已知Cr 3+ 完全沉淀所需的pH为5.6)。 下列说法不正确的是( ) A.E 为阴离子交换膜 B.X 为有机物污水,Y为含 Cr2O7 2-废水 C.理论上处理 1 molCr2O7 2-的同时可脱除 6 mol 的 NaCl D.C 室的电极反应式为 Cr2O7 2-+6e - +8H + 2Cr(OH)3↓+H2O 9.实验室制备硝基苯的反应装置如图所示。下列实验操作或叙述不正 确的是( ) A.试剂加入顺序:先加浓硝酸,再加浓硫酸,最后加入苯 B.实验时水浴温度需控制在 50~60 ℃ C.仪器 a 的作用:冷凝回流苯和硝酸,提高原料的利用率 D.反应完全后,可用仪器 a、b 蒸馏得到产品 10.研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关 (如图所示)。下列叙述错误的是( ) A.雾和霾的分散剂相同 B.雾霾中含有硝酸铵和硫酸铵 C.NH3是形成无机颗粒物的催化剂 D.雾霾的形成与过度施用氮肥有关 二、选择题:本题共 5 小题,每小题 4分,共 20 分。每小题有一个或两 个选项符合题目要求,全部选对得 4分,选对但不全的得 2 分,有选错 的得 0 分。 11.某科研人员提出 HCHO(甲醛)与 O2在羟基磷灰石(HAP)表面催化生 成 H2O 的历程,该历程示意图如下(图中只画出了 HAP 的部分结构): 下列说法不正确的是( ) A.HAP 能提高 HCHO 与 O2的反应速率 B.HCHO 在反应过程中,没有 C—H键发生断裂 C.根据图示信息,CO2分子中的氧原子全部来自 O2 D.该反应可表示为 HCHO+O2 CO2+H2O 12.微生物电池可用于有机废水的处理,如图是利用微生物处理含尿 素[CO(NH2)2]废水的装置。下列说法中正确的是( ) A.该装置外电路中箭头的方向代表电流的方向 B.M 电极反应式为 CO(NH2)2-6e - +H2O CO2↑+6H + +N2↑ C.当有 1 mol H + 通过质子交换膜时,N极消耗 5.6 L O2 D.该处理工艺会导致废水酸性增强,仍旧不能直接排放 13.利用废铁屑(主要成分为 Fe,还含有 C、S、P 等)制取高效净水剂 K2FeO4流程如图: 下列说法不正确的是( ) A.废铁屑在酸溶前可用热的纯碱溶液去油污 B.步骤②是将 Fe 2+ 转化为 Fe(OH)3 C.步骤③中发生反应的离子方程式为 2Fe(OH)3+3ClO - 2FeO4 2-+3Cl - +4H + +H2O D.步骤④中反应能发生的原因是在相同条件下,K2FeO4的溶解度小于 Na2FeO4 14.常温下,向 20 mL 浓度均为 0.1 mol·L -1 HX 和 CH3COOH 的混合溶液 中滴加 0.1 mol·L -1 的 NH3·H2O,测得混合溶液的电阻率(溶液的电阻 率越大,导电能力越弱)与加入氨水的体积 V 的关系如图所示(忽略混 合时体积变化),下列说法正确的是( ) A.常温下,0.1 mol·L -1 HX 的 pH 比同浓度 CH3COOH 的 pH 小 B.a→c过程中水的电离程度先减小后增大 C.c 点溶液中,c(CH3COO - )+c(X - )=c(NH4 +) D.d 点时,2c(NH3·H2O)+2c(NH4 +)=0.15 mol·L -1 15.乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g) C2H5OH(g)。乙 烯的平衡转化率随温度、压强的变化关系如图[起始 时,n(H2O)=n(C2H4)=1 mol,容器体积为 1 L]。下列分析不正确的是 ( ) A.乙烯气相直接水合反应的ΔH>0 B.图中压强的大小关系为 p1>p2>p3 C.图中 a 点对应的平衡常数 K= 5 16 D.达到平衡状态 a、b所需要的时间:a>b 三、非选择题:本题共 5 小题,共 60 分。 16.(12 分)叠氮化钠(NaN3)是一种白色剧毒晶体,是汽车安全气囊的 主要成分。NaN3易溶于水,微溶于乙醇,水溶液呈弱碱性,能与酸发生 反应产生具有爆炸性的有毒气体叠氮化氢。实验室可利用亚硝酸叔丁 酯(t BuNO2,以 t Bu 表示叔丁基)与 N2H4、氢氧化钠溶液混合反应制备 叠氮化钠。 (1)制备亚硝酸叔丁酯 取一定量NaNO2溶液与50%硫酸混合,发生反应:H2SO4+2NaNO2 2HNO2+ Na2SO4。可利用亚硝酸与叔丁醇(t BuOH)在 40 ℃左右制备亚硝酸叔丁 酯,试写出该反应的化学方程式: 。 (2)制备叠氮化钠(NaN3) 按如图所示组装仪器(加热装置略)进行反应,反应的化学方程式为 t BuNO2+NaOH+N2H4 NaN3+2H2O+t BuOH。 ①装置 a 的名称是 ; ②该反应需控制温度在 65 ℃,采用的实验措施是 ; ③反应后溶液在0 ℃下冷却至有大量晶体析出后过滤,所得晶体使用 无水乙醇洗涤。试解释低温下过滤和使用无水乙醇洗涤晶体的原因 是 。 (3)产率计算 ①称取 2.0 g 叠氮化钠试样,配成 100 mL 溶液,并量取 10.00 mL 溶液 于锥形瓶中。 ②用滴定管加入0.10 mol·L -1 六硝酸铈铵[(NH4)2Ce(NO3)6]溶液40.00 mL[发生的反应为 2(NH4)2Ce(NO3)6+2NaN3 4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](假设杂质 均不参与反应)。 ③充分反应后将溶液稀释并酸化,滴入 2 滴邻菲罗啉指示液,并用 0.10 mol·L -1 硫酸亚铁铵[(NH4)2Fe(SO4)2]为标准液,滴定过量的 Ce 4+ , 终点时消耗标准溶液 20.00 mL(滴定原理:Ce 4+ +Fe 2+ Ce3++Fe3+)。计 算可知叠氮化钠的质量分数为 (保留 2 位有效数字)。若其他 操作及读数均正确,滴定到终点后,下列操作会导致所测定样品中叠 氮化钠质量分数偏大的是 (填字母)。 A.锥形瓶用叠氮化钠溶液润洗 B.滴加六硝酸铈铵溶液时,滴加前仰视读数,滴加后俯视读数 C.滴加硫酸亚铁铵标准溶液时,开始时尖嘴处无气泡,结束时出现气 泡 D.滴定过程中,将挂在锥形瓶壁上的硫酸亚铁铵标准液滴用蒸馏水冲 进瓶内 (4)叠氮化钠有毒,可以使用次氯酸钠溶液对含有叠氮化钠的溶液进 行销毁,反应后溶液碱性明显增强,且产生无色、无味的无毒气体,试 写出反应的离子方程式: 。 17.(12 分)铁、铜及其化合物应用广泛。回答下列问题: (1)基态铁原子核外最后一个电子填充在 (填能级符号),含 有 个单电子,具有磁性。 (2)铁氰化钾 K3[Fe(CN)6]是检验 Fe 2+ 的重要试剂。 ①铁氰化钾中,所涉及的元素的第一电离能由大到小的顺序为 。 ②铁氰化钾中,不存在 (填字母)。 A.离子键 B.σ键 C.π键 D.氢键 E.金属键 (3)血蓝蛋白是某些节肢动物体内能与氧气可逆结合的一种铜蛋白, 其部分结构示意图如图。其中 Cu的化合价为 价,N的杂化类 型是 。 (4)CaCux合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列 而成。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层 的相对位置;(c)是由(a)和(b)两种原子层交替堆积成 CaCux合金的晶 体结构图。在这种结构中,同一层相邻的 Ca-Cu 距离为 294 pm。 ①CaCux合金中 x= 。 ②同一层中,Ca 原子之间的最短距离是 pm,设 NA为阿伏加德 罗常数的值,若要计算 CaCu x 晶体的密度,还需要知道的物理量是 (钙、铜元素的相对原子质量为已知量)。 18.(11 分)三草酸合铁酸钾[K3Fe(C2O4)3·3H2O]是制备负载型活性铁 催化剂的主要原料。某化学小组探究用废铁屑(含少量-2 价 S 元素) 为原料制备三草酸合铁(Ⅲ)酸钾晶体。具体流程如图: 已知:①(NH4)2Fe(SO4)2·6H2O 为蓝绿色晶体,FeC2O4·2H2O 为难溶于水 的黄色晶体,K3Fe(C2O4)3·3H2O 为可溶于水、难溶于乙醇的翠绿色晶体。 ②25 ℃ 时,[Fe(C2O4)3] 3- (aq)+SCN - (aq) [Fe(SCN)] 2+ (aq)+3C2O4 2-(aq) K=6.31×10 -17 。 ③[Fe(SCN)] 2+ (aq)为血红色。 回答下列问题: (1)三草酸合铁酸钾[K3Fe(C2O4)3·3H2O]中铁的化合价是 。 (2)废铁屑中加入 10%NaOH 并加热的目的是 。 (3)为防止污染空气,反应所产生的“废气”可选择 (填字母) 净化处理。 A.H2O B.NaOH 溶液 C.盐酸 D.CuSO4溶液 (4)写出浅绿色悬浊液中加入饱和 H2C2O4溶液生成黄色沉淀的化学方 程式: 。 (5)制备过程中加入 6%H2O2的目的是 ,温度保 持 70~80 ℃,采用的合适加热方式是 。 (6)获得翠绿色晶体的操作①是 。 (7)用乙醇洗涤晶体的原因是 。 (8)某同学欲检验所制晶体中的Fe(Ⅲ),取少量晶体放入试管中,加蒸 馏水使其充分溶解,再向试管中滴入几滴 0.1 mol·L -1 KSCN 溶液。请 判断上述实验方案是否可行并说明理由: 。 19.(13 分)苯乙烯是重要的基础有机化工原料。工业中以乙苯催化脱 氢来制取苯乙烯: +H2(g) ΔH=117.6 kJ·mol -1 已知:上述反应的速率方程为v 正=k 正p 乙苯,v 逆=k 逆p 苯乙烯p 氢气,其中 k 正、 k 逆分别为正、逆反应速率常数,p为各组分分压。 (1)同时增大乙苯的反应速率和平衡转化率所采取的措施是 。 (2)在 CO2气氛下,乙苯可催化脱氢制苯乙烯,其过程同时存在如图两 种途径: a= ;与掺水蒸气工艺相比,该工艺中还能够发生 反应:CO2+H2 CO+H2O,CO2+C 2CO。新工艺的特点有 (填 字母)。 a.CO2与 H2反应,使乙苯脱氢反应的化学平衡右移 b.不用高温水蒸气,可降低能量消耗 c.有利于减少生产过程中可能产生的积碳 d.CO2在反应体系中作催化剂 (3)在实际生产中,往反应釜中同时通入乙苯和水蒸气,加入水蒸气稀 释剂能提高乙苯转化率的原因是 。 测得容器总压(p 总)和乙苯转化率α随时间变化结果如图所示。平衡 时,p(H2O)= kPa,平衡常数 Kp= kPa(用平衡分压代替 平衡浓度计算);a 处的 � 正 � 逆 = 。 20.(12分)香草酸广泛用于食品调味剂,作香精、香料,合成线路如下: (1)C的结构简式是 ,B转化为C的反应类 型为 。 (2)A 中含有的官能团名称是 。 (3)B 的分子式是 。 (4)在 B中滴入 FeCl3溶液,其现象是 。 (5)与 F官能团相同的芳香族化合物的同分异构体还 种。 (6)写出 F 与乙醇进行酯化反应的方程式: 。 (7)写出由 合成 的合成线路图: 。 参考答案 1.B 根据雄黄的结构可知其化学式为As4S4,As的化合价为+2价,S的 化合价为-2价,故 A 正确;过氧化氢用于杀菌消毒与其具有强氧化性 有关,而雄黄用火烧烟生成二氧化硫和三氧化二砷,二氧化硫和三氧 化二砷不具有强氧化性,与过氧化氢原理不同,乙醇使蛋白质凝固,丧 失生物活性,与过氧化氢也不同,故 B 错误;佩戴药剂香囊是借中药气 味挥发,具有驱虫抑疫、防病保健等功效,故 C正确;生活中也可使用 火消毒器具,即高温使蛋白质变性,使用盐水可使细胞脱水而使病菌 死亡,达到杀菌的目的,故 D 正确。 2.A 稀硫酸和碳酸钠反应生成二氧化碳,二氧化碳通入硅酸钠溶液 中生成硅酸沉淀,证明酸性:H2SO4>H2CO3>H2SiO3,元素的最高价氧化物 对应水化物的酸性越强,元素的非金属性越强,故可证明非金属性强 弱:S>C>Si,A 项正确;乙醇易挥发,且也能使酸性高锰酸钾溶液褪色, 图乙装置不能确定有乙烯生成,B项错误;AlCl3饱和溶液中,氯化铝水 解生成氢氧化铝和盐酸,盐酸易挥发,直接蒸干氯化铝溶液生成氢氧 化铝而不能得到 AlCl3晶体,C项错误;图丁测定中和热的装置中缺少 环形玻璃搅拌棒,D项错误。 3.C 最外层只有一个电子的原子有 H、Na、Cu 等,化学性质不一定相 似,故 A错误;原子核外 M层上仅有两个电子的 X原子为 Mg,原子核外 N层上仅有两个电子的 Y原子有 Ca、Ti、Fe 等,化学性质不一定相似, 故 B错误;2p 轨道上有三个未成对电子的 X原子为 N,3p 轨道上有三 个未成对电子的 Y原子为 P,N、P 位于同一主族,化学性质相似,故 C 正确;原子核外电子排布式为 1s 2 的 X原子是 He,性质稳定,原子核外 电子排布式为1s 2 2s 2 的Y原子是Be,性质较活泼,两者化学性质一定不 相似,故 D 错误。 4.C 短周期元素 X、Y、Z、W 的原子序数依次增大,Z是地壳中含量 最高的元素,则 Z 为 O元素;X 的原子半径比 Y的小,则 X为 H元素,Y 为第二周期元素;X与Y的最外层电子数之和等于Z的最外层电子数,Y 的最外层电子数为 6-1=5,则 Y 为 N元素;X 与 W 同主族,则 W为 Na 元 素。电子层数越多,原子半径越大,同周期从左向右原子半径减小,则 原子半径的大小顺序:r(W)>r(Y)>r(Z)>r(X),故 A正确;Z 为 O 元素, 位于第二周期,W为 Na元素,位于第三周期,氧离子和钠离子都具有与 氖相同的电子层结构,故 B 正确;N 元素和 O元素都位于第二周期,同 周期元素,随核电荷数增大,原子半径减小,非金属性依次增强,氢化 物热稳定性依次增强,氨气的热稳定性小于水,故C不正确;N元素和H 元素可以形成含有 10e - 的 NH3和 18e - 的 N2H4,故 D正确。 5.D 根据色氨酸的结构简式可知,其分子式为 C11H12N2O2,A 正确;色氨 酸分子中含有羧基、氨基和碳碳双键,能发生取代、加成、酯化、中 和反应,B正确;氨基是碱性基团,羧基是酸性基团,则色氨酸微溶于水 而易溶于酸或碱溶液是因为其与酸、碱都能反应生成盐,C正确;同种 氨基酸之间也可形成二肽,能形成 2种二肽,色氨酸和甘氨酸反应时, 色氨酸可以氨基脱氢,或者羧基脱羟基,有 2 种,则将色氨酸与甘氨酸 (NH2CH2COOH)混合,在一定条件下最多可形成 4种二肽,D 不正确。 6.B ①中生成蓝紫色溶液,可知有 Cr2(SO4)3生成,反应中 Cr 元素的 化合价降低,发生还原反应,说明 K2Cr2O7在反应中作氧化剂,表现了氧 化性,A正确;溶液①为酸性溶液,滴加 NaOH 溶液会发生中和反应,即 除发生Cr 3+ +3OH - Cr(OH)3↓,还发生H + +OH - H2O,B不正确;将①与③ 溶液等体积混合会产生灰绿色浑浊,说明溶液中 Cr 3+ 和 CrO2 -发生相互 促进的水解反应生成 Cr(OH)3灰绿色沉淀,C正确;溶液③中含 CrO2 -, 滴加过量稀硫酸,先沉淀后溶解,最终生成 Cr 3+ ,溶液又变为蓝紫色,D 正确。 7.D 23 g 钠的物质的量为 1 mol,而 1 mol 钠与足量水反应生成 0.5 mol 氢气,即生成0.5NA个氢气分子,A错误;铜和浓硫酸反应生成的是 二氧化硫,而非三氧化硫,B错误;标准状况下,22.4 L混合气体的物质 的量为 1 mol,而氮气和氢气都为双原子分子,故 1 mol 混合气体中含 2 mol 原子即 2NA个,C错误;由于铁完全转变为四氧化三铁后,铁的价 态变为+ 8 3 ,故 3 mol 铁失去 8 mol 电子即 8NA个,D正确。 8.A 由题意分析知,B室中的阳离子(Na + )应向 C 室移动,E 为阳离子 交换膜,A不正确;因为 Cr2O7 2-转化为 Cr(OH)3时,需要得到电子,所以 含Cr2O7 2-废水应在C室,Y为含Cr2O7 2-废水,则X为有机物污水,B正确; 理论上处理 1 molCr2O7 2-的同时,需转移 6 mol 电子,则应有 6 mol 的 Na + 进入C室,同样有6 mol的Cl - 进入A室,所以可脱除6 mol的NaCl,C 正确;在 C室,Cr2O7 2-得电子产物与H + 反应生成Cr(OH)3沉淀等,电极反 应式为 Cr2O7 2-+6e - +8H + 2Cr(OH)3↓+H2O,D 正确。 9.D 混合时应先加浓硝酸,再加入浓硫酸,待冷却至室温后再加入苯, 故 A正确;制备硝基苯时温度应控制在 50~60 ℃,故 B 正确;仪器 a 的作用为使挥发的苯和硝酸冷凝回流,提高原料利用率,故 C正确;仪 器 a为球形冷凝管,蒸馏需要的是直形冷凝管,故 D 不正确。 10.C 雾的分散剂是空气,分散质是水,霾的分散剂是空气,分散质是 固体颗粒,因此雾和霾的分散剂相同,A正确;由于氮氧化物和二氧化 硫转化为铵盐形成无机颗粒物,因此雾霾中含有硝酸铵和硫酸铵,B正 确;NH3作为反应物参加反应转化为铵盐,因此氨气不是形成无机颗粒 物的催化剂,C错误;氮氧化物和二氧化硫在形成雾霾时与大气中的氨 有关,由于氮肥会释放出氨气,因此雾霾的形成与过度施用氮肥有 关,D正确。 11.BC 根据题图知,HAP 在第一步反应中作反应物,在第二步反应中 作生成物,所以是总反应的催化剂,催化剂能改变化学反应速率,因此 该反应中 HAP 作催化剂,可提高反应速率,A正确;HCHO 在反应中有 C —H键断裂和 C O键形成,所以甲醛被氧化生成二氧化碳和水,B不正 确;根据题图知,CO2分子中的氧原子一部分来自甲醛,C不正确;该反 应中反应物是甲醛和氧气,生成物是二氧化碳和水,HAP 为催化剂,反 应的化学方程式为 HCHO+O2 CO2+H2O,D 正确。 12.B 根据题给信息知,该装置是将化学能转化为电能的原电池,根 据图示可知:M电极反应式为 CO(NH2)2-6e - +H2O CO2↑+6H + +N2↑;N电 极反应式为 O2+4H + +4e - 2H2O,所以 M是负极,N是正极,电解质溶液为 酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应, 外电路中电子从负极流向正极,则装置外电路中箭头的方向代表电子 的方向,故A错误;M电极反应式为CO(NH2)2-6e - +H2O CO2↑+6H + +N2↑, 故B正确;未说明标准状况,无法确定氧气的物质的量,故C错误;电池 的总反应为尿素与氧气的反应:2CO(NH2)2+3O2 2CO2↑+4H2O+2N2↑, 该处理工艺的废水酸性很弱,能直接排放,故 D错误。 13.C 废铁屑(主要成分为 Fe,还含有 C、S、P等)中加入酸溶解得到 亚铁盐,过滤后向滤液中加入过量 NaOH 溶液和 H2O2溶液,NaOH 中和过 量的酸,Fe 2+ 被 H2O2氧化为 Fe 3+ ,在碱溶液中将溶液中的 Fe 2+ 转化为 Fe(OH)3,然后加入 NaClO 溶液,在碱溶液中发生氧化还原反应生成 Na2FeO4,加入 KCl 固体利用溶解度不同转化为 K2FeO4析出。纯碱是强 碱弱酸盐,CO3 2-水解导致纯碱溶液呈碱性,碱性条件下油污水解生成 高级脂肪酸盐和甘油,所以废铁屑在酸溶前可用热的纯碱溶液去油污, 故 A正确;由上述分析知,步骤②的目的是将溶液中 Fe 2+ 转化为 Fe(OH)3,故 B正确;步骤③中发生的反应是碱性条件下发生的反应,反 应的离子方程式为 2Fe(OH)3+4OH - +3ClO - 2FeO4 2-+3Cl - +5H2O,故 C 不 正确;步骤④中反应的化学方程式为 2KCl+Na2FeO4 K2FeO4+2NaCl,溶 解度大的物质能转化为溶解度小的物质,反应能发生的原因是 K2FeO4 的溶解度比 Na2FeO4小,故 D正确。 14.AD 若 HX和 CH3COOH 都是弱酸,则随着 NH3·H2O 的加入,酸碱反应 生成盐,溶液导电能力将增强、电阻率将减小,但图像上随着 NH3·H2O 的加入,溶液电阻率增大、导电能力减弱,说明原混合溶液中离子浓度 更大,即 HX 为强电解质,常温下,0.1 mol·L -1 HX 的 pH 比同浓度 CH3COOH 的 pH 小,故 A正确;酸或碱都抑制水的电离,滴加 NH3·H2O 溶 液的过程:a→c为 HX 和 CH3COOH 转化为 NH4X、CH3COONH4的过程,溶液 的酸性减弱,水的电离程度增大,故 B错误;根据题意分析,c点溶液中 溶质为 NH4X、CH3COONH4,且两者的物质的量相等,溶液显酸性,即 c(H + )>c(OH - ),溶液中存在电荷守 恒:c(NH4 +)+c(H + )=c(OH - )+c(X - )+c(CH3COO - ),则 c(NH4 +)查看更多