- 2021-05-25 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届浙江学考一轮复习考点精讲通用版考点63物质的检验、分离与提纯学案
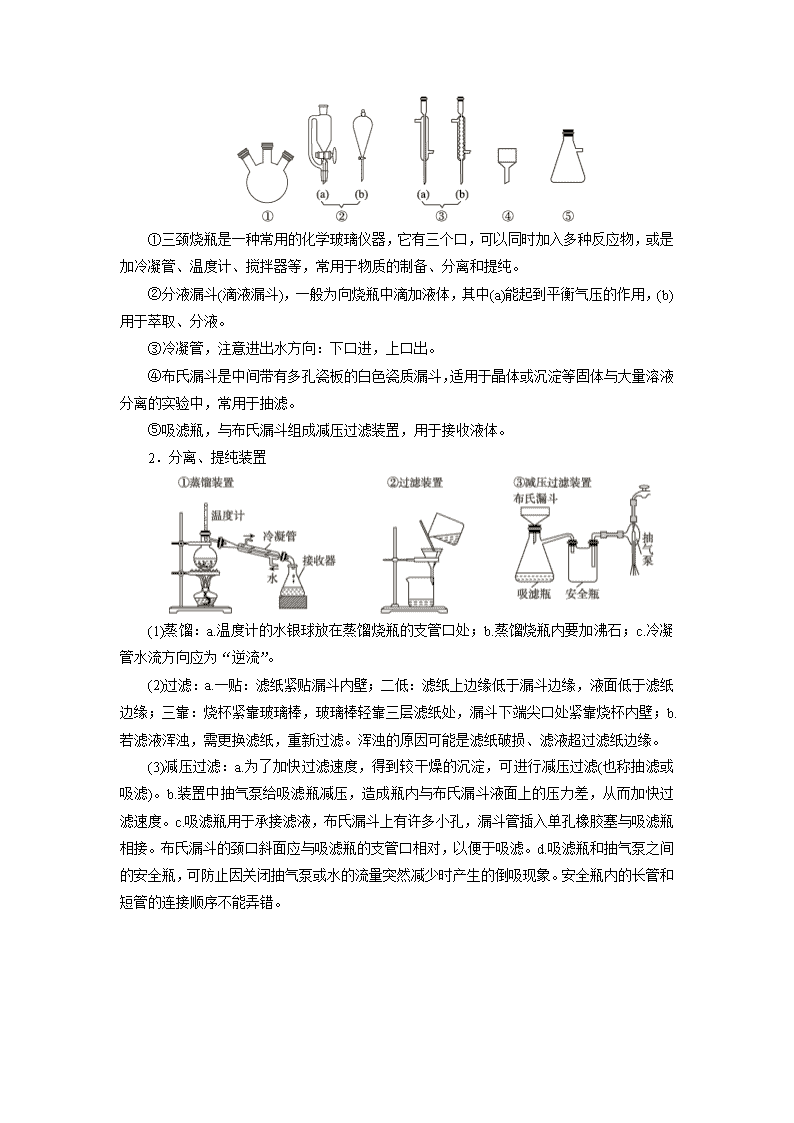
考点 63 物质的检验、分离与提纯 知识条目 必考要求 选考要求 1.物质的检验方法(试纸的使用、颜色反应) b c 2.从海带中分离和检验碘元素的原理及操作流程 b 3.萃取的原理及萃取方法的使用范围 b 4.溶解、过滤、萃取、分液等基本操作的要点 b b 5.物质分离、提纯的基本原则及应用 b c 6.层析法的基本原理 a 7.氨水使铁离子、铜离子显色的原理 a 8.纸层析法分离溶液中铁离子和铜离子的操作方法和步骤 b 9.结晶或重结晶的方法提纯固态物质的原理及操作 b 10.硝酸钠和氯化钾制取硝酸钾的原理及操作流程 b 11.减压过滤的实验方法、晶粒生长条件 a 12.牙膏的主要成分及功能 a 13.检验牙膏中含有的碳酸钙、甘油的化学原理和操作方法 b 14.火柴起火的原理 a 15.火柴头中硫元素、氯元素的检验原理和操作方法 b 16.物质检验的方案设计 c 17.硝酸钠的物理性质(外观)和重要的化学性质(如氧化性和还原 性) b 18.亚硝酸的酸性和不稳定性 a 19.亚硝酸钠和食盐的鉴别 c 20.常见物质的鉴别 b c 一、物质分离、提纯的仪器及装置 1.分离、提纯仪器 ①三颈烧瓶是一种常用的化学玻璃仪器,它有三个口,可以同时加入多种反应物,或是 加冷凝管、温度计、搅拌器等,常用于物质的制备、分离和提纯。 ②分液漏斗(滴液漏斗),一般为向烧瓶中滴加液体,其中(a)能起到平衡气压的作用,(b) 用于萃取、分液。 ③冷凝管,注意进出水方向:下口进,上口出。 ④布氏漏斗是中间带有多孔瓷板的白色瓷质漏斗,适用于晶体或沉淀等固体与大量溶液 分离的实验中,常用于抽滤。 ⑤吸滤瓶,与布氏漏斗组成减压过滤装置,用于接收液体。 2.分离、提纯装置 (1)蒸馏:a.温度计的水银球放在蒸馏烧瓶的支管口处;b.蒸馏烧瓶内要加沸石;c.冷凝 管水流方向应为“逆流”。 (2)过滤:a.一贴:滤纸紧贴漏斗内壁;二低:滤纸上边缘低于漏斗边缘,液面低于滤纸 边缘;三靠:烧杯紧靠玻璃棒,玻璃棒轻靠三层滤纸处,漏斗下端尖口处紧靠烧杯内壁;b. 若滤液浑浊,需更换滤纸,重新过滤。浑浊的原因可能是滤纸破损、滤液超过滤纸边缘。 (3)减压过滤:a.为了加快过滤速度,得到较干燥的沉淀,可进行减压过滤(也称抽滤或 吸滤)。b.装置中抽气泵给吸滤瓶减压,造成瓶内与布氏漏斗液面上的压力差,从而加快过 滤速度。c.吸滤瓶用于承接滤液,布氏漏斗上有许多小孔,漏斗管插入单孔橡胶塞与吸滤瓶 相接。布氏漏斗的颈口斜面应与吸滤瓶的支管口相对,以便于吸滤。d.吸滤瓶和抽气泵之间 的安全瓶,可防止因关闭抽气泵或水的流量突然减少时产生的倒吸现象。安全瓶内的长管和 短管的连接顺序不能弄错。 (4)蒸发结晶:蒸发结晶适用于溶解度随温度变化不大的物质;而对溶解度受温度变化 影响较大的固态溶质,采用降温结晶的方法。在蒸发结晶中应注意:a.玻璃棒的作用:搅拌, 防止液体局部过热而飞溅;b.当有大量晶体析出时,停止加热,利用余热蒸干而不能直接蒸 干。 (5)萃取分液:a.溶质在萃取剂中的溶解度大;b.两种液体互不相溶;c.溶质和萃取剂不 反应;d.分液时下层液体从下口流出,上层液体从上口倒出。 (6)纸层析:纸层析以滤纸为惰性支持物。滤纸纤维上的羟基具有亲水性,它所吸附的 水作为固定相,不与水混溶的有机溶剂作为流动相。样品中各组分在水或有机溶剂中的溶解 能力不同,各组分在两相中有不同的分配现象。亲脂性强的成分在流动相中分配得多,随流 动相移动的速度快;而亲水性强的成分在固定相中分配得多,随流动相移动的速度慢。 二、几种常见物质的检验、分离、提纯 1.海带中碘元素的分离及检验 海带或紫菜中的碘元素是以化合态形式存在的。从海带或紫菜中分离与检验碘元素的主 要操作步骤是: (1)充分灼烧样品:灼烧固体物质在坩埚中进行,用到的其他仪器有酒精灯、三脚架、 泥三角、坩埚钳、玻璃棒。灼烧完毕,应将坩埚置于石棉网上冷却。 (2)将所得灰分加水煮沸,浸取,过滤。 (3)将滤液酸化后加入氧化剂氧化:若选择氯水作氧化剂,则氯水不可过量,否则会使 生成的碘单质继续被氧化,化学反应方程式为 5Cl2+I2+6H2O===2HIO3+10HCl。选择双氧 水作氧化剂的优点是其还原产物是水,不会引入其他杂质。 (4)检验:取少许混合液,滴入淀粉溶液,溶液变为蓝色证明有 I2 生成。 (5)加萃取剂萃取分液。 2.用纸层析法分离铁离子和铜离子 (1)纸层析法分离 Fe3+、Cu2+的原理:Fe3+、Cu2+在滤纸上随丙酮等展开的速度不同, 展开后两种离子的富集位置不同,从而达到分离的目的。 (2)Fe3+、Cu2+的显色反应 吸附有 Fe3+、Cu2+的滤纸经氨熏后显色:Cu(OH)2 能溶于过量氨水中,生成 Cu(NH3)2+4 (呈深蓝色);Fe(OH) 3(呈红褐色)不溶于过量氨水中。Fe 3+、Cu2+的显色是利用 Fe(OH)3、 Cu(NH3)2+4 的特征颜色。 Fe3+遇氨水反应生成红褐色沉淀:Fe3++3NH3·H2O===Fe(OH)3↓+3NH+4 。 Cu2+遇氨水反应生成深蓝色溶液:Cu2++4NH3·H2O===Cu(NH3)2+4 +4H2O。 (3)操作步骤: ①装置制作——裁纸 ②点样——点层析试样 ③配制展开剂 ④层析操作 ⑤显色反应 3.硝酸钾晶体的制备 结晶的基本原理:结晶分为蒸发结晶和冷却结晶。通过蒸发溶液,减少一部分溶剂,使 溶液达到饱和而析出晶体的方法叫蒸发结晶。蒸发结晶多用于溶解度随温度变化不大的物质。 通过降低温度使溶液冷却达到饱和而析出晶体的方法称为冷却结晶。冷却结晶多用于溶解度 随温度降低而明显减小的物质。实际应用中常常是两种结晶方法结合使用。 假如第一次得到的晶体纯度不符合要求,可将所得到的晶体溶于少量溶剂中,然后进行 蒸发(或冷却)、结晶、分离,如此反复的操作称为重结晶。 (1)KNO3 晶体的制备原理 在稀溶液中,NaNO3 和 KCl 并不发生化学反应,但将一定浓度的 NaNO3 和 KCl 的混合 溶液加热至沸腾,使溶液浓缩,将有 NaCl 晶体析出,将滤液冷却至室温,将有 KNO3 晶体 析出。 根据 KNO3 的溶解度随温度的升高而显著增大,而 NaCl 的溶解度随温度升高增加很少。 根据“当溶于水中的离子可组成多种物质时,先达到饱和的物质先析出”的原理可以解释。 (2)实验注意问题 ①晶粒生长的条件:晶体的颗粒大小与结晶条件有关,溶质的溶解度越小、溶液的浓度 越高、溶剂的蒸发速度越快、溶液冷却的越快,析出的晶粒越细小;反之,可得到较大的晶 体颗粒。 ②当溶液发生过饱和现象时,振荡容器、用玻璃棒搅动或轻轻摩擦容器内壁或投入几粒 晶体(晶种),都可促使晶体析出。 ③将溶液蒸发浓缩使 NaCl 晶体析出后,要趁热过滤。如果不趁热过滤,在降温过程中 会有 KNO3 晶体析出,此时过滤得到的将是 NaCl 和 KNO3 的混合物,从而导致产率下降。 ④在蒸发后趁热过滤时,承接滤液的烧杯要预先加入少量蒸馏水。目的是防止滤液降温 时有少量的 NaCl 析出,使所得 KNO3 不纯。 4.牙膏中主要成分的检验 (1)牙膏的成分 牙膏是由多种无机物和有机物组成的,它包括摩擦剂、发泡剂、增稠剂、保湿剂、甜味 剂、增香剂和水分等。常用的摩擦剂有碳酸钙、氢氧化铝、二氧化硅,用量在 30%~55%。 (2)牙膏中碳酸钙、甘油的检验原理 ①CaCO3 的检验原理:CaCO3+2HCl===CaCl2+CO2↑+H2O。 ②甘油的检验:甘油中加入新制 Cu(OH)2,变为绛蓝色,反应方程式: (3)牙膏中某些主要成分的检验流程: 5.火柴头中硫元素、氯元素的检验 (1)火柴起火的原理 安全火柴的火柴盒侧面涂有红磷(发火剂)和 Sb2S3(易燃物)等,火柴头上的物质一般是 KClO3、MnO2 等氧化剂和易燃物,如硫等。当两者摩擦时,因摩擦产生的热使与氯酸钾等 接触的红磷燃烧,并引起火柴头上的易燃物燃烧,生成一定量的二氧化硫。 (2)检验硫元素、氯元素的原理及方法 ① ②火柴头→水浸取→加 NaNO2,稀硝酸酸化的 AgNO3 溶液→产生白色沉淀→有氯元素 反应离子方程式:ClO-3 +3NO-2 +Ag+===AgCl↓+3NO-3 。 6.NaNO2 和 NaCl 的鉴别 (1)亚硝酸的化学性质 亚硝酸分解的化学方程式:2HNO2===NO↑+NO2↑+H2O。 (2)NaNO2 的性质 ①NaNO2 在酸性条件下氧化 I-:2NO-2 +2I-+4H+===2NO↑+I2+2H2O。 ②NaNO2 在酸性条件下可氧化 Fe2+:NO-2 +Fe2++2H+===NO↑+Fe3++H2O。 ③NaNO2 能使酸性 KMnO4 溶液褪色,体现了还原性:5NO-2 +2MnO-4 +6H+===5NO-3 +2Mn2++3H2O。 ④NaNO2 溶液与 AgNO3 溶液的反应:Ag++NO-2 ===AgNO2↓(溶于稀硝酸)。 (3)实验鉴别 NaNO2 和 NaCl 实验方案 现象与结论 方案 1 用碘化钾淀粉溶液 变蓝色,证明该盐是 NaNO2 方案 2 用可溶性 Fe2+盐溶液 溶液颜色由浅绿色变成棕黄色,证明该盐是 NaNO2 方案 3 用酸性 KMnO4 溶液 溶液褪色,证明该盐是 NaNO2 方案 4 用硝酸酸化的 AgNO3 溶液 沉淀不溶解的是 NaCl 方案 5 用 pH 试纸测试 pH pH>7 的是 NaNO2 【例 1】 下列关于实验原理或操作的叙述中,正确的是( ) A.海带中碘的提取实验中,将海带灰溶于水,过滤后在滤液中加入 CCl4 即可萃取 B.减压过滤可以过滤胶状沉淀或颗粒太小的沉淀 C.用纸层析法分离 Cu2+和 Fe3+,滤纸上端呈棕黄色,说明 Fe3+在固定相中分配的更 多 D.纸层析实验中,不能将滤纸上的试样点浸入展开剂中 【解析】 A 项,海带中碘元素以碘离子存在,应该先将碘离子转化为碘单质,然后萃 取得到碘,错误;B 项,此法可加速过滤,并使沉淀抽吸得较干燥,但不宜过滤胶状沉淀和 颗粒太小的沉淀,因为胶状沉淀易穿透滤纸,颗粒太小的沉淀易在滤纸上形成一层密实的沉 淀,溶液不易透过,错误;C 项,用纸层析法分离 Cu2+和 Fe3+,滤纸上端呈棕黄色,说明 Fe3+在流动相中分配的更多,随流动相移动的速度快一些,错误;D 项,纸层析法中要求流 动相溶剂对分离物质应有适当的溶解度,由于样品中各物质分配系数不同,因而扩散速度不 同,所以纸层析法是利用试样中各种离子随展开剂在滤纸上展开的速率不同而形成不同位置 的色斑,如果试样接触展开剂,样点里要分离的离子或者色素就会进入展开剂,导致实验失 败,故 D 正确。 【答案】 D 【提炼】 1.注意减压过滤的适用条件,不宜过滤胶状沉淀和颗粒太小的沉淀,因为胶 状沉淀易穿透滤纸,颗粒太小的沉淀易在滤纸上形成一层密实的沉淀,溶液不易透过。 2.掌握纸层析的原理,在理解纸层析法原理时,注意区分“固定相”、“流动相”、“分 配”等概念。纸层析分离铁离子、铜离子的实验中,“固定相”是滤纸纤维上所吸附的水, “流动相”是作为展开剂的有机溶剂。 【例 2】 下列实验装置不适用于物质分离的是( ) 【解析】 A 为萃取分液装置,用于分离互不相溶的液体混合物;B 装置可用于分离易 升华的物质(如 I2);C 为过滤装置,用于分离液体与不溶性固体混合物;D 装置中温度计测 量的是反应混合液的温度,不是蒸馏装置,故 D 不适用于物质分离。 【答案】 D 【提炼】 物质分离、提纯的思维方向(1)固体混合物的分离、提纯①溶解过滤法(如分 离 MnO2 和 KCl 的混合物)。②溶解结晶法(如分离 KNO3 和 NaCl 的固体混合物)。③升华法 (如分离 I2、NaCl 或 NH4Cl、NaCl 的混合物)。④加热灼烧法(如除去 Na2CO3 中的 NaHCO3)。 (2)气体的分离、提纯①混合法:如用水洗法除去 NO 中的 NO2、H2 中的 HCl 等。②加 热法:如用灼热铜网除去 N2 中的 O2。③吸收法:如用碱石灰除去气体中的水蒸气,用 Na2O2 除去 O2 中的 CO2 等。 (3)液体的分离、提纯①萃取法;②分液法;③沉淀法;④生成气体法(如 NaCl 溶液中 的 Na2CO3 杂质用盐酸除去);⑤氧化法或还原法(如 FeCl3 中的 FeCl2 用 Cl2 除去,FeCl2 中的 FeCl3 用铁粉除去);⑥转化法(如 NaHCO3 溶液中的 Na2CO3 用通 CO2 的方法除去);⑦电解 法(如稀硫酸中的盐酸可用电解法除去)等。 【例 3】 物质的提纯是化学实验中的一项重要操作,也是化工生产及物质制备中的主 要环节。下列有关叙述中,不正确的是( ) A.乙酸乙酯中混有乙酸,可选用饱和 Na2CO3 溶液洗涤,然后将两层液体分开 B.在提纯鸡蛋中的蛋白质时,可向鸡蛋清溶液中加入浓(NH4)2SO4 溶液,然后将所得 沉淀滤出,即得较纯的蛋白质 C.油脂的提纯中,可将油脂加入浓 NaOH 溶液中加热,然后过滤,滤出的溶液即为较 纯的油脂 D.甘蔗是制备蔗糖的主要原料,榨出的甘蔗汁因含色素而呈棕黄色,在制取蔗糖前应 先加入适量的活性炭,搅拌、过滤,蒸发结晶,即得较纯的蔗糖 【解析】 A 项,乙酸可以和碳酸钠反应生成乙酸钠的水溶液,但是乙酸乙酯在饱和碳 酸钠中的溶解度极小,也不溶于水,这样乙酸乙酯和醋酸钠溶液分层,可以采用分液法来分 离,正确;B 项,饱和(NH4)2SO4 溶液能使蛋白质发生盐析,且为可逆过程,能用于蛋白质 的分离提纯,正确;C 项,油脂是高级脂肪酸甘油酯,在碱性条件下能发生水解生成高级脂 肪酸盐和甘油,C 错误;D 项,甘蔗中含蔗糖,能溶于水,加入活性炭利用其吸附性除去杂 质,则制取蔗糖前应先加入适量的活性炭,搅拌、过滤、蒸发结晶,即得较纯的蔗糖,正确。 【答案】 C 【提炼】 物质的分离、提纯应根据各物质的性质进行。 【例 4】 某兴趣小组用铝箔制备 Al2O3、AlCl3·6H2O 及明矾大晶体,具体流程如下: 已知:AlCl3·6H2O 易溶于水、乙醇及乙醚;明矾在水中的溶解度如下表。 温度/℃ 0 10 20 30 40 60 80 90 溶解度/g 3.00 3.99 5.90 8.39 11.7 24.8 71.0 109 请回答: (1)步骤Ⅰ中的化学方程式_______________________________________; 步骤Ⅱ中生成 Al(OH)3 的离子方程式___________________________________________。 (2)步骤Ⅲ,下列操作合理的是________。 A.坩埚洗净后,无需擦干,即可加入 Al(OH)3 灼烧 B.为了得到纯 Al2O3,需灼烧至恒重 C.若用坩埚钳移动灼热的坩埚,需预热坩埚钳 D.坩埚取下后放在石棉网上冷却待用 E.为确保称量准确,灼烧后应趁热称重 (3)步骤Ⅳ,选出在培养规则明矾大晶体过程中合理的操作并排序________。 ①迅速降至室温 ②用玻璃棒摩擦器壁 ③配制 90 ℃的明矾饱和溶液 ④自然冷却至 室温 ⑤选规则明矾小晶体并悬挂在溶液中央 ⑥配制高于室温 10~20 ℃的明矾饱和溶液 (4)由溶液 A 制备 AlCl3·6H2O 的装置如右图: ①通入 HCl 的作用是抑制 AlCl3 水解和_____________________________。 ②步骤Ⅴ,抽滤时,用玻璃纤维替代滤纸的理由是____________________________; 洗涤时,合适的洗涤剂是________。 ③步骤Ⅵ,为得到纯净的 AlCl3·6H2O,宜采用的干燥方式是________。 【解析】 (2)坩埚在洗净后需烘干后才能灼烧,故 A 错误;B.灼烧至固体恒重,说明 氢氧化铝分解完全,即得到的氧化铝较纯,正确;C.坩埚钳在移动灼热的坩埚时需要预热到 一定的温度,才可以夹取灼热的坩埚,否则容易引起坩埚的破裂,C 正确;为确保称量准确, 灼烧后需要在干燥器中冷却后再称量,E 错误。故正确的答案为 B、C、D (3)根据晶体的大小和结晶条件的关系,若溶质的溶解度越小,或溶液的浓度越高,或 溶剂的蒸发速度越快,或溶液冷却的越快,析出的晶粒就越细小,所以为了获得明矾大晶体, 需要选择自然冷却至室温,低浓度溶液以及利用晶核使晶粒变大,故按操作顺序选⑥⑤④。 (4)①通入 HCl,增大溶液中氢离子和氯离子的浓度,增大氢离子的浓度能抑制氯化铝 的水解,增大氯离子的浓度,有利于 AlCl3·6H2O 结晶;②溶液 A 中通入 HCl 后,所得溶液 为强酸性,具有腐蚀性,所以需要玻璃纤维代替滤纸;为减少氯化铝的溶解,洗涤时用浓盐 酸,且浓盐酸易挥发;③为防止氯化铝晶体失去结晶水,只能利用低温条件下的干燥,故可 以选用低温干燥或减压干燥。 【 答 案 】 (1)2Al + 2NaOH + 2H2O===2NaAlO2 + 3H2↑ AlO-2 + CO2 + 2H2O===Al(OH)3↓+HCO-3 (2)BCD (3)⑥⑤④ (4)①增加 c(Cl -),有利于 AlCl3·6H2O 结晶 ②溶液具有强酸性 浓盐酸 ③减压干燥或低温干燥 【提炼】 高考试题的落脚点是教科书:本题涉及的明矾大晶体的培养,原理出自苏教 版《实验化学》P14 影响晶粒生成的条件,操作过程出自《实验化学》P22 培养明矾晶体; 由溶液 A 获得氯化铝晶体过程的操作,来自苏教版必修 1 镁的冶炼;抽滤时玻璃纤维代替 滤纸,出自《实验化学》P14 减压过滤的操作向导。查看更多