- 2021-05-24 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届高考化学一轮复习课时作业19化学反应速率及其影响因素含解析鲁科版
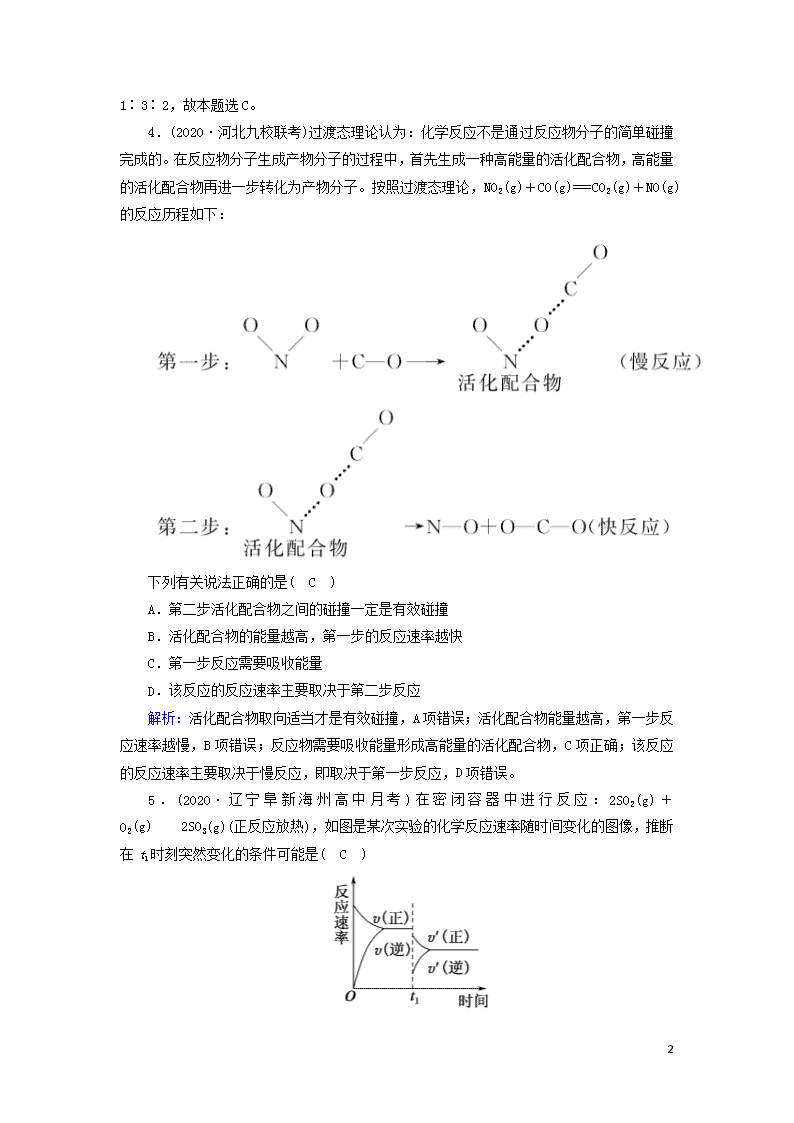
课时作业19 化学反应速率及其影响因素 时间:45分钟 一、选择题 1.(2020·安徽安庆一中期中)“活化分子”是衡量化学反应速率快慢的重要依据,下列说法中不正确的是( A ) A.活化分子之间的碰撞一定是有效碰撞 B.增大反应物的浓度,可使单位体积内的活化分子增多,反应速率加快 C.对于有气体参加的反应,通过压缩容器增大压强,可使单位体积内的活化分子增多,反应速率加快 D.催化剂能降低反应的活化能,使活化分子百分数增加 解析:本题考查活化能、活化分子对反应速率的影响。活化分子之间的碰撞必须有合适的取向才能引发化学反应,才是有效碰撞,A错误;增大反应物的浓度,活化分子的浓度增大,使单位体积内的活化分子增多,反应速率加快,B正确;对于有气体参加的反应,通过压缩容器增大压强,气体的浓度增大,单位体积内的活化分子增多,反应速率加快,C正确;加入催化剂,反应的活化能降低,活化分子增多,活化分子百分数增加,反应速率加快,D正确。 2.(2020·四川成都实验中学模拟)下列有关反应速率的说法正确的是( A ) A.氢气与氮气能够缓慢反应生成氨,使用合适催化剂可提高反应速率 B.等质量的锌粉和锌片与相同体积、相同浓度的盐酸反应,反应速率相等 C.用铁片与硫酸制备氢气时,使用浓硫酸可以加快产生氢气的速率 D.二氧化硫催化氧化反应的ΔH<0,所以升高温度,反应速率减小 解析:催化剂能加快化学反应速率,A项正确;质量相同时,锌粉与盐酸的接触面积大,反应速率快,B项错误;常温下铁遇浓硫酸钝化,C项错误;升高温度,活化分子的百分数增大,分子间的碰撞频率提高,分子间有效碰撞的几率提高,反应速率增大,D项错误。 3.(2020·河北廊坊省级示范高中联考)在一定条件下,将X和Y气体通入1L的恒容密闭容器中进行反应:aX(g)+bY(g)mZ(g),0~5 s内反应速率如下:v(X)=0.1 mol·L-1·s-1、v(Y)=0.3 mol·L-1·s-1、v(Z)=0.2 mol·L-1·s-1,则a、b、m的值分别为( C ) A.1、2、3 B.3、2、1 C.1、3、2 D.3、1、2 解析:根据反应速率之比等于化学计量数之比,可得a∶b∶m 8 =0.1∶0.3∶0.2=1∶3∶2,故本题选C。 4.(2020·河北九校联考)过渡态理论认为:化学反应不是通过反应物分子的简单碰撞完成的。在反应物分子生成产物分子的过程中,首先生成一种高能量的活化配合物,高能量的活化配合物再进一步转化为产物分子。按照过渡态理论,NO2(g)+CO(g)===CO2(g)+NO(g)的反应历程如下: 下列有关说法正确的是( C ) A.第二步活化配合物之间的碰撞一定是有效碰撞 B.活化配合物的能量越高,第一步的反应速率越快 C.第一步反应需要吸收能量 D.该反应的反应速率主要取决于第二步反应 解析:活化配合物取向适当才是有效碰撞,A项错误;活化配合物能量越高,第一步反应速率越慢,B项错误;反应物需要吸收能量形成高能量的活化配合物,C项正确;该反应的反应速率主要取决于慢反应,即取决于第一步反应,D项错误。 5.(2020·辽宁阜新海州高中月考)在密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图像,推断在t1时刻突然变化的条件可能是( C ) 8 A.催化剂失效 B.减小生成物的浓度 C.降低体系温度 D.增大容器的体积 解析:催化剂只能同等程度地增大或减小正、逆反应速率,A项错误;减小生成物的浓度,正反应速率瞬时不变,逆反应速率瞬时减小,B项错误;正反应放热,降低温度,正、逆反应速率都减小,平衡正向移动,C项正确;增大容器的体积,正、逆反应速率都减小,但平衡逆向移动,D项错误。 6.(2020·浙江台州质检)在四氯化碳溶液中,N2O5按下式分解:2N2O5===4NO2+O2。取2 L该溶液测得在67 ℃时c(N2O5)随时间的变化如下表: t/min 0 1 2 3 4 c(N2O5)/(mol·L-1) 1.00 0.71 0.50 0.35 0.25 根据表中数据,下列说法不正确的是( B ) A.其他条件不变时,化学反应速率随浓度的减小而减小 B.前2 min,以NO2表示的平均反应速率是0.25 mol·L-1·min-1 C.前4 min,生成O2的物质的量为0.75 mol D.若升高温度,1 min时测得c(N2O5)<0.71 mol·L-1 解析:本题考查化学反应速率的计算及温度、浓度对反应速率的影响。由表中数据可知,随着反应的进行,每分钟内c(N2O5)的变化量逐渐减小,则其他条件不变时,化学反应速率随浓度的减小而减小,A正确;前2 min内,c(N2O5)减小0.50 mol·L-1,则c(NO2)增加1.00 mol·L-1,故有v(NO2)==0.50 mol·L-1·min-1,B错误;前4 min内,c(N2O5)减小0.75 mol·L-1,则反应中消耗N2O5为0.75 mol·L-1×2 L=1.50 mol,故前4 min生成的O2为0.75 mol,C正确;升高温度,反应速率加快,1 min内消耗的N2O5增加,故1 min时测得c(N2O5)<0.71 mol·L-1,D正确。 7.(2020·吉林长春五中调研)一定量的锌粒与足量稀硫酸反应,向反应混合液中加入某些物质,下列判断正确的是( C ) A.加入少量水,生成H2的速率减小,H2的体积减小 B.加入NH4HSO4固体,生成H2的速率不变,H2的体积不变 C.加入CH3COONa固体,生成H2的速率减小,H2的体积不变 D.滴加少量CuSO4溶液,生成H2的速率增大,H2的体积不变 解析:本题考查化学反应速率的影响因素。锌粒与稀硫酸反应的原理是Zn+2H+===Zn2++H2 ↑。加入少量水,c(H+)减小,生成H2的速率减小,由于锌粒和H+的物质的量不变,则生成H2的体积不变,A错误;加入NH4HSO4固体,c(H+)增大,生成H2的速率增大,但Zn少量,则生成H2的体积不变,B错误;加入CH3COONa固体,CH3COO-与H+反应生成CH3COOH,c(H+)减小,生成H2的速率减小,随着反应进行,CH3COOH会继续电离产生H+ 8 ,直到锌粒反应完全,则生成H2的体积不变,C正确;滴加少量CuSO4溶液,Zn与CuSO4发生置换反应生成Cu,形成原电池,生成H2的速率增大,由于消耗了锌,生成H2的体积减小,D错误。 8.(2020·河南洛阳联考)已知化学反应:NO2+CONO+CO2,①当t<250 ℃时,v=k·c2(NO2),②当t>250 ℃时,v=k·c(NO2)·c(CO)。以上两式中v为反应速率,k为速率常数(一定温度下为定值)。下列叙述正确的是( D ) A.当NO2和CO的浓度相等时,升高或降低温度,反应速率不变 B.因反应前后气体分子数目不变,故改变压强反应速率不变 C.t>250 ℃时,增大NO2的浓度为原来的2倍,反应速率一定变为原来的4倍 D.当温度低于250 ℃时,改变CO的浓度,反应速率基本不变 解析:升高温度,反应速率加快,降低温度,反应速率减慢,A项错误;该反应前后气体分子数目不变,改变压强,平衡不移动,但反应速率对应改变,B项错误;增大NO2的浓度为原来的2倍,若t>250 ℃,根据v=k·c(NO2)·c(CO)可知,反应速率变为原来的2倍,C项错误;当温度低于250 ℃时,根据v=k·c2(NO2)可知,一定温度下,反应速率只与c(NO2)有关,改变CO的浓度,反应速率不变,D项正确。 9.(2020·河北唐山一中冲刺)恒容条件下,1 mol SiHCl3发生如下反应:2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)。已知:v正=v消耗(SiHCl3)=k正x2(SiHCl3),v逆=2v消耗(SiH2Cl2)=k逆x(SiH2Cl2)·x(SiCl4),k正、k逆分别为正、逆反应速率常数(仅与温度有关),x为物质的量分数。如图是不同温度下x(SiHCl3)随时间的变化。下列说法正确的是( C ) A.该反应为放热反应,v正a查看更多