- 2021-05-24 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高一化学必修一第一章知识点汇编
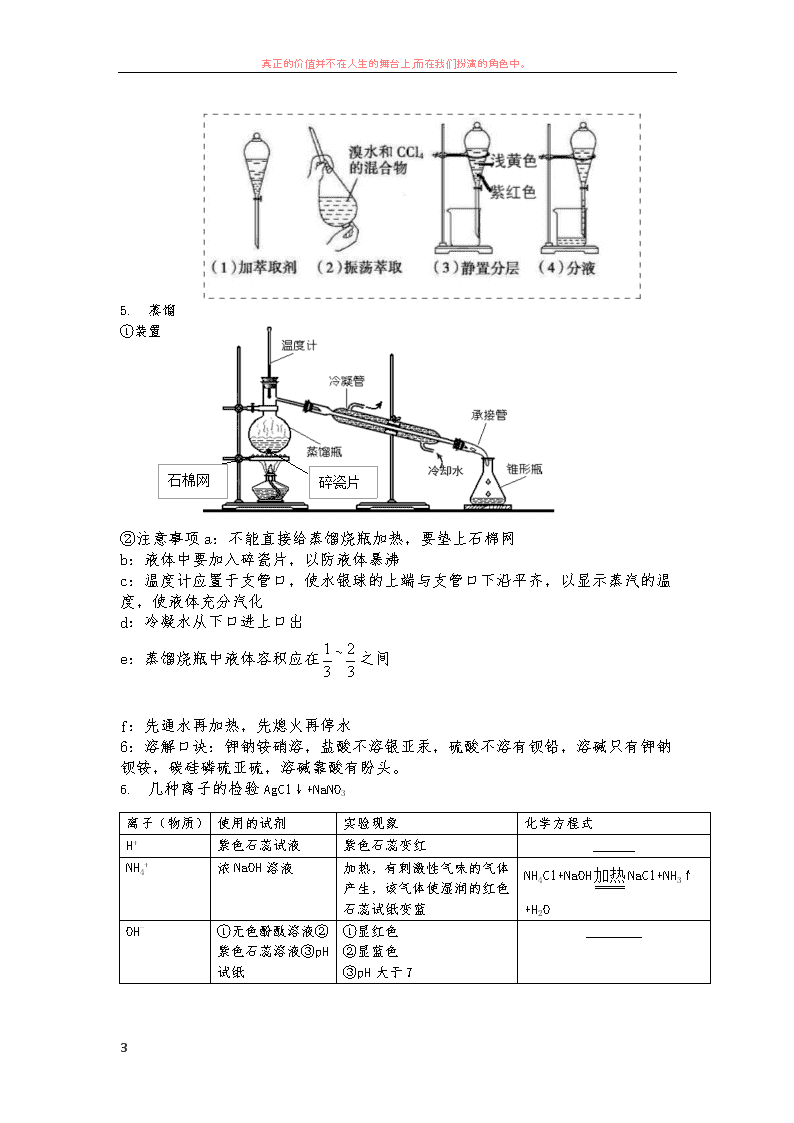
真正的价值并不在人生的舞台上,而在我们扮演的角色中。 1 第一章:从实验学化学知识点汇编 1.1 化学实验基本方法 一.化学实验安全 1. 使用药品“三不” ①不用手接触药品②不将鼻孔凑到容器瓶口闻药品气味(用扇闻)③不尝药品味道 2. 用剩药品“三不” ①不放回原瓶(Na、K、CaCO3 除外)②不随意丢弃③不拿出实验室 3. 实验室一般事故的预防和处理方法 4. 实验室安全操作“六防” 内容 可能引起事故的操作 采取的措施 防爆 炸 点燃可燃性气体(如 H2、 CO2、CH4 等) 点燃前先要检验气体的纯度 用 CO、H2 还原 Fe2O3、CuO 等 先通入 CO 或 H2,在装置尾部收集气体检验纯度,若尾部气体 纯净,表示空气已排净,在对装置加热 防暴 沸 加热液体混合物 在混合液中加入碎瓷片 浓硫酸与水、乙醇等混合 稀释浓硫酸时,应将浓硫酸沿烧杯内壁缓缓注入水中,并不 断搅拌。浓硫酸与密度比它小的液体混合时,都应将浓硫酸 缓缓注入该液体中 防失 火 可燃性物质遇到明火 可燃性物质一定要远离火源,加热易燃物质应小火、缓慢、 均匀加热 防中 毒 制取有毒气体,误食重金 属盐等 制取有毒气体应在通风橱中进行,误食重金属盐应喝豆浆、 牛奶或鸡蛋清解毒 防倒 吸 加热法制取并用排水法收 集气体 先将导管从水中取出,在熄灭酒精灯(如有多个加热装置的 复杂装置,要注意熄灭酒精灯的顺序) 防污 染 对环境有污染的物质的制 取,废弃物的处理 有毒气体应进行尾气处理,固体、液体废弃物要回收或合理 处理后排放 5、药品取用 (1)块状或金属颗粒:一横,二放,三慢立 (2)固体粉末:一斜,二送,三直立 内容 方法 K、Na 起火 用沙子盖灭,不能用水、CO2 酒精灯碰到着火 用沙子或湿抹布盖灭,不能用火泼灭 浓碱沾到皮肤上 大量水冲,再涂上硼酸 浓 H2SO4 沾到皮肤上 用大量水冲,然后涂上 3%~5%的 NaHCO3 苯酚沾到皮肤上 用乙醇擦洗 大量酸洒到桌子上 加适量 NaHCO3 中和,用水冲洗并擦净 大量碱洒到桌子上 加适量醋酸中和,用水擦洗并冲净 酸溅入眼中 应立即用水冲洗,边冲边眨眼睛 重金属盐中毒 饮服大量牛奶、豆浆或蛋清 水银洒出 为防止汞蒸气中毒,应用硫粉覆盖 Hg2++S2-=HgS↓ 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 2 (3)液体:拿下瓶塞,倒放桌面上,倾倒时瓶上标签向着手心防止瓶口残留药液留下来腐 蚀标签,同时瓶口紧挨试管口缓慢倾倒 取用块状或颗粒状药品用镊子,粉末状药品用药匙 或纸槽,少量液体用胶头滴管(胶头滴管应在试管口上部悬空,不能插入试管内) 6、物质加热 可直接加热的仪器:试管,坩埚,蒸发皿,燃烧匙 隔石棉网加热的仪器:烧杯,烧瓶,锥形瓶 酒精灯使用:添加酒精不超过容积三分之二,禁止向燃着酒精灯加酒精,禁止用一个酒精灯 点燃另一个酒精灯,用灯帽盖灭,不许用嘴 试管加热前要预热,防止局部受热使试管炸裂。加热试管液体时,液体体积不超过试管容积 三分之一,45°倾斜,管口不对人。 7、药品存放 (1)受热或见光易分解的物质存放在棕色瓶中(浓硝酸,硝酸银) (2)金属钠保存在煤油中,易和氧气,水反应,白磷着火点低(40 摄氏度)在空气中自燃, 保存在冷水中。 二. 混合物的分离与提纯 1. 过滤(液体与固体间) ★过滤三要素①滤纸紧贴漏斗内壁②二低:滤纸边缘要低于漏斗边缘,液面要低于漏斗边缘 ③三靠:玻璃棒紧靠三层滤纸处,玻璃棒紧靠烧杯口,漏斗下端管口紧靠烧杯内壁 2. 沉淀的洗涤:向沉淀中加入蒸馏水至稍浸没沉淀,让水自然滤出(带出可溶性离子)重 复 2~3 次即可 3. 蒸发 ①适用:溶剂蒸发、溶质析出 ②注意事项 a:液体的量不得超过蒸发皿容量的 3 2 b:加热过程中,用玻璃棒不断搅拌液体,以免液体局部过热而使液滴飞溅 c:出现较多固体时,停止加热,利用余热蒸干溶剂 4. 萃取和分液⑴萃取①含义:利用混合物中的一种溶质在互不相溶的溶剂中的溶解度不同, 用一种溶剂(萃取剂)把该溶质从它与另一种溶剂所组成的溶液中提取出来,这种方法叫萃 取 ②萃取剂的要求:萃取时,两种溶剂必须互不相溶、不发生化学反应,且要具有一定的密度 差,溶质在萃取剂中的溶解度一定要远大于在原溶剂中的溶解度。 ③萃取的仪器:分液漏斗(注意要检查是否漏水,上层溶液从上口出,下层溶液从下口出) ⑵分液 含义:把两种互不相溶的液体(密度不同)分开的操作叫做分液。分液使用的仪器是分液漏 斗。 ⑶示例 Br2、I2 在水中的溶解度较小,而在 CCl4、苯等有机溶剂中的溶解度较大。实验室中 常见的萃取示例适用 CCl4、苯等溶剂萃取水溶液中的溴、碘等单质。用 CCl4 从碘水中萃取 单质碘的操作如图所示 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 3 5. 蒸馏 ①装置 ②注意事项 a:不能直接给蒸馏烧瓶加热,要垫上石棉网 b:液体中要加入碎瓷片,以防液体暴沸 c:温度计应置于支管口,使水银球的上端与支管口下沿平齐,以显示蒸汽的温 度,使液体充分汽化 d:冷凝水从下口进上口出 e:蒸馏烧瓶中液体容积应在 3 1 ~ 3 2 之间 f:先通水再加热,先熄火再停水 6:溶解口诀:钾钠铵硝溶,盐酸不溶银亚汞,硫酸不溶有钡铅,溶碱只有钾钠 钡铵,碳硅磷硫亚硫,溶碱靠酸有盼头。 6. 几种离子的检验 AgCl↓+NaNO3 离子(物质) 使用的试剂 实验现象 化学方程式 H+ 紫色石蕊试液 紫色石蕊变红 ______ NH4 + 浓 NaOH 溶液 加热,有刺激性气味的气体 产生,该气体使湿润的红色 石蕊试纸变蓝 NH4Cl+NaOH加热 NaCl+NH3↑ +H2O OH- ①无色酚酞溶液② 紫色石蕊溶液③pH 试纸 ①显红色 ②显蓝色 ③pH 大于 7 ________ 碎瓷片石棉网 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 4 答题模板:检验 SO4 2-:取一定体积的溶液于试管中,先加入一定量的稀盐酸(无明显现象), 再加入 BaCl2。如有白色沉淀产生则原溶液中含有 SO4 2- 1.2 化学计量在实验中的应用 一. 物质的量及其单位 1. 物质的量 ①定义:表示含有一定一定数目粒子的集合体。这是一个物理量,只适用于微观粒子,如分 子、原子、质子、中子等 ②符号:她是 7 个物理量之一(另外 6 个为:长度、质量、时间、电流、热力学温度、发光 强度),用 n 来表示。 ③单位:摩尔,简称摩,用 mol 表示,摩尔只是单位 ④规定 1mol 粒子所含的数目为 6.02×1023 2. 阿伏伽德罗常数(测定单分子油膜法) ①定义:科学上规定以 0.012kg12C 中所含的碳原子数称为阿伏伽德罗常数 ②单位 mol- ③符号:NA ④公式 n= AN N 变形:NA= n N ,N=NA×n 例:3.01×1022 个 CO2 的物质的量为 n(CO2)= AN N =3.01×1022÷(6.02×1023mol-)=0.05mol 3. 摩尔质量 ①定义:科学上规定,单位物质的量的物质所具有的质量叫做该物质的摩尔质量 ②符号:M ③单位:g/mol 或 kg/mol ④取值规律:1mol 粒子的质量=相对分子(或原子)质量与 g 的组合→粒子的摩尔质量=相 对分子(或原子)质量与 g 的组合 ⑤公式:n= M m 变形:M= n m ,m=M×n 二. 气体摩尔体积 1. 气体摩尔体积的概念 ①在温度及压强相同时,1mol 的固体或液体的体积不相同,1mol 任何气体所占体积在数值 上近似相等 ②定义:在一定温度和压强下,单位物质的量的气体所占的体积叫做气体摩尔体积,符号为 Vm,单位为 L/mol 或 m3/mol ③标准状况(0oC,101KP)下,Vm=22.4L/mol(近似值,描述时前面加“约”) 2. 影响物质体积的因素 决定物质体积的大小的因素有:粒子数目、粒子大小、粒子间的距离 ①固体及液体的体积取决于粒子数目及大小 Cl- AgNO3 溶液、稀 HNO3 生成不溶于 HNO3 的白色沉 淀 NaCl+AgNO3—AgCl↓+NaNO3 SO4 2- 先加盐酸酸化,再 加 BaCl2 溶液 加盐酸无现象,加 BaCl2 溶 液后有白色沉淀生成 (NH4)2SO4+BaCl2—BaSO4↓ +2NH4Cl CO3 2-或 HCO3 - 盐酸、澄清石灰水 产生能使澄清石灰水变浑 浊的无色无味的气体 NaCO3+2HCl—2HCl+CO2↑+H2O CO2+Ca(OH)2=CaCO3↓+H2O 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 5 ②气体的体积取决于粒子数目及粒子间的距离 3. 气体摩尔体积的数目不是固定不变的 4. 阿伏伽德罗定律:在相同的温度和压强下,相同体积的任何气体均含有相同数目的分子 5. 公式:Vm= n V 6. 有关气体的相对密度和平均摩尔质量的计算:十字交叉法 三. 阿伏伽德罗定律的推论 PV=nRT(R 为常数),P= M ρ RT,PV= M m RT 1. 同温同压下,气体分子数(物质的量)与其体积成正比 2. 同问同体积的气体,压强与其分子数成正比 3. 分子数相等,压强相同的气体,体积与其温度成反比 4. 分子数相等,温度相同的气体,压强与其体积成反比 5. 同温同压下,气体的密度与其相对分子质量成正比 四. 物质的量在化学实验中的应用 1. 物质的量浓度 ①定义:表示单位体积溶液里所含溶质 B(B 表示各种溶质)的物质的量的物理量 ②符号:c(B) ③单位:mol/L ④公式:CB = 液V nB w= 剂 质 m m ×100% S(饱和) = 剂 质 m m ×100g 注意点:①溶液物质的量浓度与其溶液的体积没有任何关系 ⑤溶液稀释:C(浓溶液)•V(浓溶液)=C(稀溶液)•V(稀溶液) 或 m(浓)•w(浓)=c(稀)•m(稀) 2.一定物质的量浓度的配制 (1)基本原理:根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的 方法,求出所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制 得溶液. (2)主要操作 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 6 1、检验是否漏水. 2、配制溶液 ○1 计算溶质质量,溶解时玻璃棒要悬空—防止异物进入 ○2 称量(或量取):天平只能量到 0.1g ○3 溶解及回温:将称量的固体(液体)放入烧杯中,加入水溶解 ○4 转移.(引流及洗涤):要用玻璃棒引流,且玻璃棒要悬空,下端要在容量瓶刻度线以 下 ○5 洗涤.用蒸馏水洗涤烧杯内壁及玻璃棒 2~3 次,并将其转入容量瓶中 ○6 定容.(引流及滴加):向容量瓶中加入水(用玻璃棒引流),至接近刻度线 1cm~2cm 处,再改用胶头滴管加水。(注:滴管不能伸入瓶颈内,一定不能使液面超过刻度线) ○7 摇匀.盖好瓶塞,上下颠倒,摇匀后静置,即使液面降低也不可再加水 ○8 装瓶. 将配好的溶液转移到细口瓶中,贴好标签保存 所需仪器:托盘天平、烧杯、玻璃棒、胶头滴管、(X L)容量瓶 注意事项:A 选用与欲配制溶液体积相同的容量瓶. B 使用前必须检查是否漏水. C 不能在容量瓶内直接溶解. D 溶解完的溶液等冷却至室温时再转移. E 定容:继续往容量瓶中小心地加水,直到液面接近刻度 2-3mm 处,改用胶头滴管加水, 使溶液凹面恰好与刻度相切。 (3)误差分析:(以配制 NaOH 为例)根据公式:C=n/V=m/(M·V) (4)溶液加水稀释的几个规律: 密度大于 1 的溶液:加等体积水后,溶液溶质质量分数大于原溶液溶质质量分数的一半。 加 等质量水后,溶液物质的量浓度小于原溶液物质的量浓度的一半。 密度小于 1 的溶液::加等体积水后,溶液溶质质量分数小于原溶液溶质质量分数的一半。加 等质量水后,溶液物质的量浓度大于原溶液物质的量浓度的一半。 2. 关于物质的量浓度计算的相关规律 ①c 与 w 的换算 c= M w1000 (其中 的单位为 g/cm3,c 的单位为 mol/L) 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 7 证明:设溶液体积为 1L,则 m=1000 wV( 的单位为 g/cm3)∴n= M m = M Vw1000 ∴c= V n = M w1000 ②c 与 S(饱和溶液)的换算:c= )100 1000 SM S ( 证明:∵S= (溶剂) (溶质) m m ×100g,且 w= S S 100 ×100%∴S= w1 w100 又∵c= M w1000 ∴c= )100 1000 SM S ( ③w= S S 100 ×100%;S= w-1 w ×100 ④c= MV V 22400 1000 ,w= MV MV 22400 关系图: 第二章:化学物质及其变化 2.1 物质的分类 一. 简单分类法及其应用 1. 交叉分类法:对物质以不同的标准进行分类。如 Na2CO3 既属于钠盐又属于碳酸盐 2. 树状分类法:对同类事物进行再分类的方法。 二. 分散系及其分类 1.定义:把一种或多种物质分散在另一种(或多种)物质中得到的体系叫做分散系。前者属 于被分散的物质,称作分散质;后者起容纳分散质的作用,称作分散剂。 ★实例 气+气 液+气 固+气 气+液 液+液 固+液 固+固 空气 雾(小液粒) 烟(小颗粒) 盐酸 硫酸溶液 食盐溶液 有色玻璃 物质的量浓度 CB 质 量 m 微 粒 N 气体的体积(标况下) 物质的量 n ×VB ÷VB ×NA ÷NA ÷Vm×Vm ÷M ×M 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 8 3. 分类及区别 ①分类:根据分散质粒子大小来分 分散系(分散剂为液态):溶液,胶体(指液溶胶),浊液(悬浊液,乳浊液) ②区别 外观 稳定性 分散质大小 能否通过滤纸 分散质粒子种类 溶液 均一、透明 稳定(介稳性) ﹤1nm 能 分子、离子 胶体 均一、透明 稳定(介稳性) 1~100nm 能 较多分子的集合体或大分子 浊液 不均一、不透明 不稳定 ﹥100nm 否 大量分子的集合体(固体小颗粒或小液滴)查看更多