- 2021-05-24 发布 |
- 37.5 KB |
- 19页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
备战2021 高考化学 考点04 物质的分离和提纯(解析版)
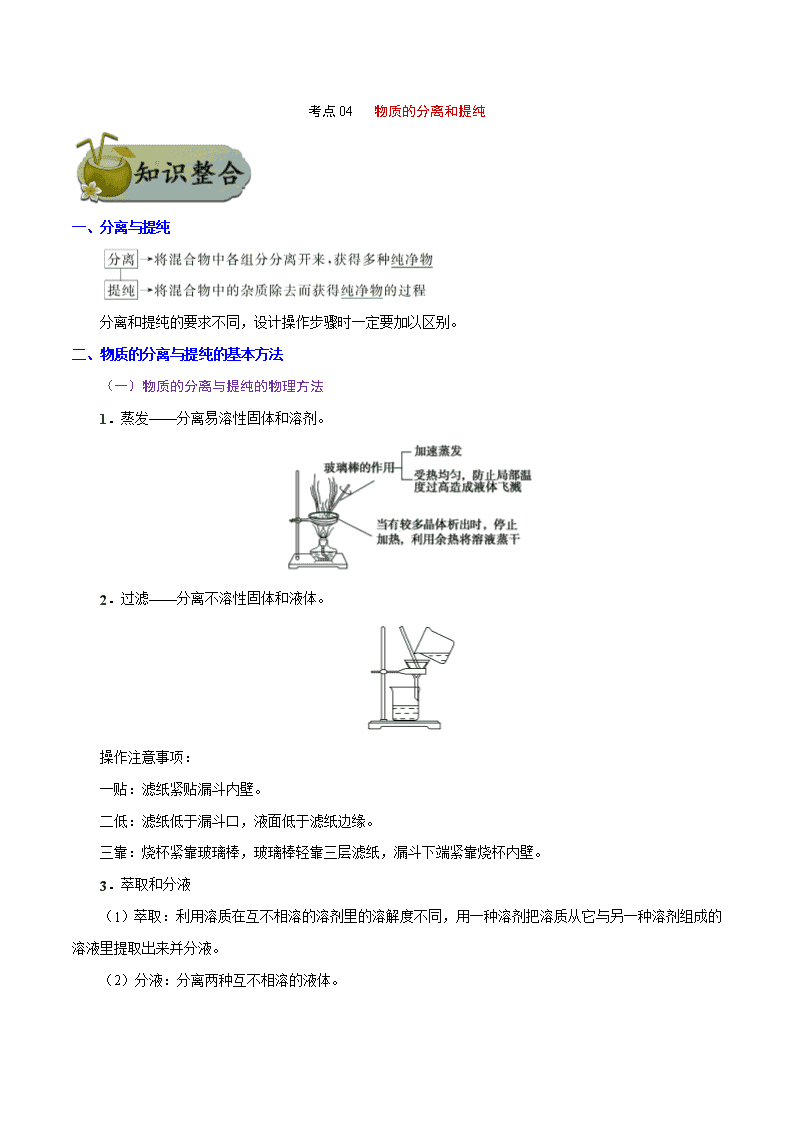
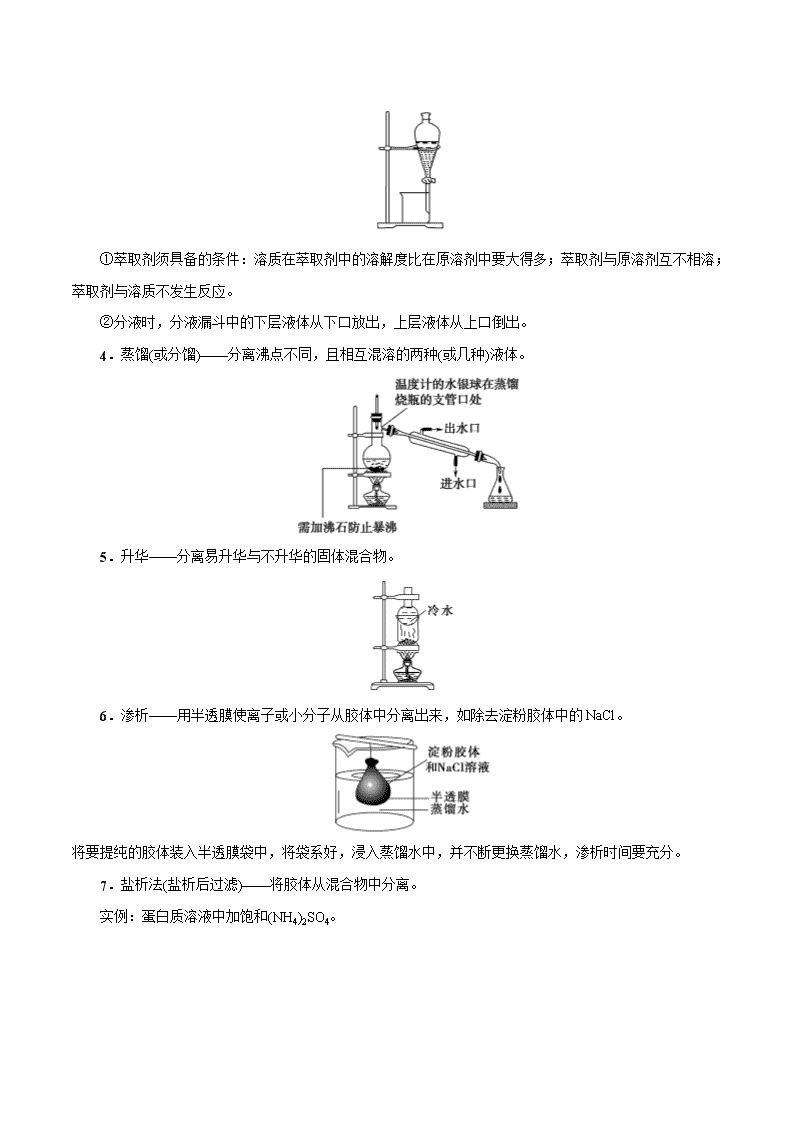
考点 04 物质的分离和提纯 一、分离与提纯 分离和提纯的要求不同,设计操作步骤时一定要加以区别。 二、物质的分离与提纯的基本方法 (一)物质的分离与提纯的物理方法 1.蒸发——分离易溶性固体和溶剂。 2.过滤——分离不溶性固体和液体。 操作注意事项: 一贴:滤纸紧贴漏斗内壁。 二低:滤纸低于漏斗口,液面低于滤纸边缘。 三靠:烧杯紧靠玻璃棒,玻璃棒轻靠三层滤纸,漏斗下端紧靠烧杯内壁。 3.萃取和分液 (1)萃取:利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂组成的 溶液里提取出来并分液。 (2)分液:分离两种互不相溶的液体。 ①萃取剂须具备的条件:溶质在萃取剂中的溶解度比在原溶剂中要大得多;萃取剂与原溶剂互不相溶; 萃取剂与溶质不发生反应。 ②分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出。 4.蒸馏(或分馏)——分离沸点不同,且相互混溶的两种(或几种)液体。 5.升华——分离易升华与不升华的固体混合物。 6.渗析——用半透膜使离子或小分子从胶体中分离出来,如除去淀粉胶体中的 NaCl。 将要提纯的胶体装入半透膜袋中,将袋系好,浸入蒸馏水中,并不断更换蒸馏水,渗析时间要充分。 7.盐析法(盐析后过滤)——将胶体从混合物中分离。 实例:蛋白质溶液中加饱和(NH4)2SO4。 (二)物质的分离与提纯的化学方法 方法 适用条件 举例 加热法 混合物中混有热稳定性差的物质时,可直接 加热,使热稳定性差的物质分解而分离出去 纯碱中混有小苏打 洗气法 将气体混合物通过洗气装置而除去杂质气体 让混合气体通过盛有饱和食盐水的洗气瓶除去 Cl2 中的少量 HCl 沉淀法 在混合物中加入某试剂,使杂质离子以沉淀 形式分离出去的方法 加适量 AgNO3 溶液除去 KNO3 溶液中的 KCl 转化法 不能通过一次反应达到分离的目的时,要经 过转化为其他物质才能分离,然后将转化物 质恢复为原物质 分离 Fe3+和 Al3+时,可加入过量的 NaOH 溶液, 生成 Fe(OH)3沉淀和 Na[Al(OH)4]溶液,过滤后, 向 Fe(OH)3 中 加 入 盐 酸 重 新 生 成 Fe3+ , 向 Na[Al(OH)4]中通入过量 CO2,生成 Al(OH)3 沉 淀,过滤后向 Al(OH)3 中加入盐酸重新生成 Al3+ 酸碱法 被提纯物质不与酸碱反应,而杂质可与酸碱 发生反应 用盐酸除去 SiO2 中的石灰石;用 NaOH 溶液除 去铁粉中的铝粉 氧 化 还 原法 ①对混合物中混有的还原性杂质,可加入适 当的氧化剂使其被氧化为被提纯物质 ②对混合物中混有的氧化性杂质,可加入适 当的还原剂将其还原为被提纯物质 将过量铁粉加入混有 FeCl3 的 FeCl2 溶液中,振 荡、过滤,可除去 FeCl3 杂质 调 节 pH 法 通过加入试剂来调节溶液的 pH,使溶液中某 种成分沉淀分离的方法 CaCl2 溶液中含有 FeCl3 杂质,由于 FeCl3 水解, 溶液呈酸性,可采用调节溶液 pH 的方法将 Fe3+ 沉淀,为此可加 CaO 或 Ca(OH)2 或 CaCO3 等 电解法 利用电解原理来分离、提纯物质 电解精炼铜 离 子 交 换法 利用离子交换剂提纯物质 软化硬水 二、高考常考物质的除杂方法 原物质 所含杂质 除杂质试剂 主要操作方法 N2 O2 灼热的铜网 吸收法 CO CO2 NaOH 溶液 洗气 CO2 CO 灼热 CuO 转化法 CO2 H2S CuSO4 溶液 洗气 CO2 HCl 饱和 NaHCO3 溶液 洗气 SO2 HCl 饱和 NaHSO3 溶液 洗气 Cl2 HCl 饱和食盐水 洗气 H2S HCl 饱和 NaHS 溶液 洗气 炭粉 MnO2 浓盐酸(加热) 过滤 Fe2O3 Al2O3 过量 NaOH 溶液 过滤 Al2O3 SiO2 ①盐酸;②氨水 过滤、灼烧 NaHCO3 溶液 Na2CO3 CO2 转化法 FeCl3 溶液 FeCl2 Cl2 转化法 FeCl3 溶液 CuCl2 Fe、Cl2 过滤 FeCl2 溶液 FeCl3 Fe 过滤 乙烷 乙烯 溴水 洗气 乙醇 水 新制 CaO 蒸馏 乙烯 SO2 NaOH 溶液 洗气 溴苯 溴 NaOH 溶液 分液 乙酸乙酯 乙酸 饱和 Na2CO3 溶液 分液 考向一 分离、提纯的原理与方法 典例 1 下表中除去物质中杂质选用的试剂或操作方法正确的一组是 序号 物质 杂质 除去杂质选用的试剂或操作方法 ① KNO3 溶液 KOH 加入适量 FeCl3 溶液,并过滤 ② FeSO4 溶液 CuSO4 加入过量铁粉,并过滤 ③ H2 CO2 通过盛有足量 NaOH 溶液的洗气瓶,再通过 盛有浓硫酸的洗气瓶 ④ NaNO3 CaCO3 溶解、过滤、蒸发 A.①②③ B.①③④ C.②③④ D.①②④ 【解析】加入氯化铁会引入杂质 Cl-,故①不正确;加入铁粉置换出铜,通过过滤除去铜及过量的铁粉, 故②正确;利用氢氧化钠溶液吸收二氧化碳气体,再用浓硫酸干燥氢气,故③正确;碳酸钙不溶于水,溶 解后过滤,再蒸发即可得到纯净的 NaNO3,故④正确。 【答案】C 1.下列实验中,所采取的分离方法与对应原理都正确的是 【答案】B 【解析】除去 KCl 中的 MnO2 应采用过滤的方法,A 错误;碘易升华,加热可分离,B 正确;利用重结 晶方法分离 KNO3 和 NaCl 是利用 KNO3 的溶解度受温度的影响大于 NaCl,C 错误;食用油和汽油互溶, 因沸点不同而用蒸馏的方法分离,D 错误。 混合物分离、提纯的物理方法归纳 选项 目的 分离方法 原理 A 除去 KCl 中的 MnO2 蒸发结晶 溶解度不同 B 除去碘中的 NaCl 加热、升华 NaCl 的熔点高,碘易升华 C 分离 KNO3 和 NaCl 重结晶 KNO3 的溶解度大于 NaCl D 分离食用油和汽油 分液 食用油和汽油的密度不同 考向二 分离仪器或装置的识别和选择 典例 1 下列实验的试剂、装置选用不合理的是 选项 实验目的 选用试剂 选用装置 A 除去 Cl2 中少量的 HCl、H2O 试剂 a 为饱和氯化钠溶液 甲 B 除去 NH3 中少量的 H2O 试剂 b 为无水氯化钙 乙 C 除去 H2 中少量的 HCl、H2O 试剂 b 为碱石灰 乙 D 除去 N2 中少量的 O2 足量铜网 丙 【解析】A 选项合理,甲装置中饱和氯化钠溶液可除去 HCl,浓硫酸可除去 H2O;B 选项不合理,干燥 管中的无水氯化钙在除去水的同时也吸收 NH3;C 选项合理,干燥管中的碱石灰的主要成分为生石灰与氢氧 化钠,可除去 HCl 和 H2O;D 选项合理,在加热条件下,O2 可与丙装置中的铜网反应而被除去。 【答案】B 2.下列实验中,所选装置不合理的是 A.分离 Na2CO3 溶液和 CH3COOC2H5,选④ B.用 CCl4 提取碘水中的碘,选③ C.用 FeCl2 溶液吸收 Cl2 选⑤ D.粗盐提纯,选①和② 【答案】A 【解析】Na2CO3 溶液和 CH3COOC2H5 不互溶且分层应选装置③进行分液,A 不合理;用 CCl4 提取碘水 中的碘应采用萃取和分液的方法,选装置③,B 合理;用 FeCl2 溶液吸收 Cl2,应用洗气瓶且“长进短出”, 选⑤,C 合理;粗盐提纯需要过滤和蒸发,D 合理。 分离、提纯的创新装置 1.过滤装置的创新——抽滤 由于水流的作用,使图 1 装置 a、b 中气体的压强减小,故使过滤速率加快。 2.蒸馏装置的创新 图 2,由于冷凝管竖立,使液体混合物能冷凝回流,若以此容器作反应容器,可使反应物能循环利用, 提高了反应物的转化率。 3.洗气装置的创新——双耳球吸收法 由于双耳球上端球形容器的容积较大,能有效地防止倒吸。故该装置既能除去气体中的气态杂质,又能 防止倒吸。 考向三 物质分离、提纯的实验方案及流程分析 典例 1 某化学兴趣小组从含有 KI、KNO3 等成分的工业废水中回收 I2 和 KNO3,其流程如下: 下列说法正确的是 A.步骤 1 中有机相应从分液漏斗下端放出,无机相从上口倒出 B.步骤 2 使用的玻璃仪器有蒸馏烧瓶、酒精灯、牛角管、球形冷凝管、锥形瓶 C.步骤 3 可在如图装置中完成 D.步骤 4 中,将溶液蒸发至只剩少量水时,用余热将晶体蒸干 【解析】步骤 1 为萃取分液操作,苯的密度比水小,故有机相应从分液漏斗上口倒出,A 项错误;步 骤 2 为蒸馏,应选用直形冷凝管,球形冷凝管一般用于冷凝回流,B 项错误;步骤 3 为升华,用图中装置能 较好地控制温度,C 项正确;步骤 4 为蒸发结晶,由于 KNO3 的溶解度随温度变化比较大,应采用蒸发浓缩、 冷却结晶的方法,因此加热至有少量晶体出现就可停止加热,D 项错误。 【答案】C 3.如图所示为从固体混合物中分离 X 的两种方案,请根据方案 1 和方案 2 指出下列说法中合理的是 A.可以选用方案 1 分离碳酸氢钠中含有的氯化铵 B.方案 1 中的残留物应该具有的性质是受热易挥发 C.方案 2 中加入的试剂一定能够与除 X 外的物质发生化学反应 D.方案 2 中加入 NaOH 溶液可以分离出 SiO2 和 Fe2O3 混合物中的 Fe2O3 【答案】D 【解析】①加热法分离提纯固体混合物应满足的条件:一种物质受热易挥发或分解,另一物质受热不挥 发或难分解。②加试剂法分离(过滤)提纯固体混合物应满足的条件:所加试剂能达到让一种物质形成溶 液,而另一物质形成难溶物的状态。A 项中碳酸氢钠、氯化铵受热均易分解,故用方案 1 不能将两物质 分离开,错误;B 项方案 1 中的残留物应该具有受热时不挥发或难分解的性质,错误;C 项方案 2 中加 入的试剂可能不与除 X 外的物质发生化学反应 ,如加水进行溶解分离,错误;D 项中 SiO2 与 NaOH 溶 液反应生成 Na2SiO3 溶解而分离,正确。 过滤操作中“三个”答题模板 (1)检验沉淀完全:静置取上层液→加沉淀剂→有无沉淀→结论。 (2)沉淀洗涤:向漏斗内加蒸馏水至浸没沉淀,静置使水自然流出,重复操作 2~3 次。 (3)沉淀洗净:取少量最后一次洗涤液于试管中,加入×××,若无×××现象,则证明×××离子已经洗净 (或证明已经洗涤干净)。 1.除去下列物质中混有的少量杂质,所选用的试剂及操作方法正确的是 选项 物质 杂质(少量) 试剂及操作方法 A 甲烷 乙烯 通过装有酸性 KMnO4 溶液的洗气装置 B Cl2 HCl 通过装有饱和食盐水的洗气装置 C 乙酸乙酯 乙酸 加入 NaOH 溶液后振荡静置,分液 D Cu 粉 Fe 粉 加入足量稀硝酸充分反应后过滤 【答案】B 【解析】 A.乙烯与高锰酸钾反应生成二氧化碳,引入新的杂质气体,A 错误; B.饱和食盐水能过吸收 HCl 气体,而降低氯气在水中的溶解度,B 正确; C.NaOH 能与乙酸反应生成乙酸钠,同时也与乙酸乙酯反应生成乙酸钠和乙醇,C 错误; D.稀硝酸与铁、铜均能反应,D 错误; 答案为 B。 2.青蒿素是高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,甲醇、乙醇、乙醚、石油醚中 可溶解,在水中几乎不溶,熔点为 156-157℃,热稳定性差。已知:乙醚沸点为 35℃。提取青蒿素的主要工 艺如图所示,下列有关此工艺操作不正确...的是 A.操作Ⅲ的主要过程是:加水溶解、蒸发浓缩、冷却结晶、过滤 B.破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素浸取率 C.操作Ⅱ是蒸馏,利用了乙醚沸点低回收利用。 D.操作 I 需要用到的玻璃仪器有漏斗、玻璃棒、烧杯 【答案】A 【解析】 A.由题意可知,青蒿素在水中几乎不溶,故操作Ⅲ的主要过程不是加水溶解,而是加入 95%的乙醇溶解, 再进行蒸发浓缩、冷却结晶、过滤,A 错误; B.将青蒿素干燥粉碎增大了与乙醚的接触面积,调高青蒿素浸取液,B 正确; C.操作Ⅱ是蒸馏,利用了乙醚与青蒿素的沸点相差较大,乙醚沸点低可回收利用,C 正确; D.操作 I 为过滤,需要用到的玻璃仪器有漏斗、玻璃棒、烧杯,D 正确; 答案选 A。 3.古代中国常用如图所示装置来炼丹、熬烧酒、制花露水等》,南宋张世南《游宦纪闻》中记载了民间制取 花露水的方法:“锡为小甑,实花一重,香骨一重,常使花多于香,转甑之傍,以泄汗液,以器贮之。”该装 置利用的实验操作方法是( ) A.升华 B.过滤 C.萃取 D.蒸馏 【答案】D 【解析】 从图中可以看出,以花为原料,通过加热产生蒸气,然后冷凝成液体,便制成花露水,所以此操作为蒸馏, 故选 D。 4.在实验室中,下列除去杂质的方法不正确...的是 A.溴苯中混有溴,加稀 NaOH 溶液反复洗涤、分液 B.硝基苯中混有浓硝酸和浓硫酸,分别用水、NaOH 溶液和水洗涤、分液 C.乙烷中混有乙烯,与氢气在一定条件下反应,使乙烯转化为乙烷 D.乙烯中混有 SO2 和 CO2,将其通过 NaOH 溶液洗气 【答案】C 【解析】A.溴与 NaOH 反应即 Br2+2NaOH=NaBr+NaBrO+H2O 后,与溴苯分层,分液可分离,故 A 正确; B.酸与 NaOH 反应即 NaOH+HNO3=NaNO3+H2O,2NaOH+H2SO4=Na2SO4+2H2O 后,与硝基苯分层,分液 可分离,故 B 正确;C.乙烯与氢气发生加成反应,反应条件复杂,且乙烷中易引入新杂质氢气,不能除杂, 应选溴水,洗气,故 C 错误;D.SO2 和 CO2 均与 NaOH 反应即 2NaOH+SO2=Na2SO3+H2O, 2NaOH+CO2=Na2CO3+H2O,而乙烯不反应,则通入 NaOH 溶液洗气可除杂,故 D 正确;答案为 C。 5.过滤后的食盐水仍含有可溶性的 CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净 的食盐水:①加入稍过量的 Na2CO3 溶液;②加入稍过量的 NaOH 溶液;③加入稍过量的 BaCl2 溶液;④滴 入稀盐酸至无气泡产生;⑤过滤,正确的操作顺序( ) A.①②③⑤④ B.③②①⑤④ C.②③①④⑤ D.③⑤②①④ 【答案】B 【解析】过滤后的食盐水仍含有可溶性的 CaCl2、MgCl2、Na2SO4 等杂质,沉淀 Ca2+常用 Na2CO3 溶液,沉 淀 Mg2+常用 NaOH 溶液,沉淀 SO42−常用 BaCl2 溶液,由于除杂过程中都需要加入过量的物质来除杂,为了 不引入新的杂质,后面加入的物质尽可能的除掉前面多加的物质,因此先沉淀 SO42−加入过量 BaCl2 溶液后, 再用 Na2CO3 溶液除掉 Ca2+,过量 BaCl2 用 Na2CO3 溶液除掉,再用 NaOH 溶液除掉 Mg2+,再过滤,多余的 Na2CO3 溶液、NaOH 溶液用加入适量盐酸除掉,注意 NaOH 溶液加入顺序在过滤以前加入都可以,因此正 确的操作顺序为③②①⑤④,故 B 符合题意。 综上所述,答案为 B。 6.实验室利用海带提碘过程中,可能使用到下列装置且装置无误的是 A.过滤 B.灼烧 C.分液 D.蒸馏 【答案】A 【解析】A. 该装置是过滤装置,能达到实验目的,A 正确;B. 灼烧应该在坩埚中进行,不能在蒸发皿中完 成,B 错误;C. 分液时分液漏斗下端要仅靠烧杯内壁,C 错误;D. 蒸馏时冷却水应该是下口进上口出,D 错误;答案选 A。 7.下列物质的分离方法中,利用粒子大小差异的是 A.过滤豆浆 B.酿酒蒸馏 C.精油萃取 D.海水晒盐 【答案】A 【解析】A、过滤利用的是微粒的大小不同来分离的,留在滤纸上的物质颗粒大,不能透过滤纸,滤液中的 物质颗粒小,可以透过滤纸,A 正确;B、蒸馏利用的是物质的沸点不同,B 错误;C、萃取利用的是物质 在不同溶剂中的溶解度不同,C 错误;D、氯化钠在水中溶解度随温度变化不大,让水蒸发掉,从而获得盐, D 错误;答案选 A。 8.下表中,对有关除杂的方法错误的是 选项 物质 杂质 方法 A 苯 苯酚 加浓溴水后过滤 B 乙烯 CO2 和 SO2 通入装有 NaOH 溶液的洗气瓶洗气 C 溴苯 Br2 加 NaOH 溶液后分液 D 乙酸乙酯 乙酸 加饱和碳酸钠溶液后分液 【答案】A 【解析】A.三溴苯酚不溶于水,但溶于有机溶剂苯,则用浓溴水除去苯中混有的苯酚,会引入新杂质三溴 苯酚,应该选用氢氧化钠溶液洗涤分液除去苯中混有的苯酚,故 A 错误;B.乙烯不与氢氧化钠溶液反应, 二氧化碳和二氧化硫为酸性氧化物,能与氢氧化钠溶液反应,则将混合气体通过装有氢氧化钠溶液的洗气 瓶洗气,能够除去乙烯中混有的二氧化碳和二氧化硫杂质,故 B 正确;C.常温下,溴苯不与氢氧化钠溶液 反应,溴单质能与氢氧化钠溶液反应生成溴化钠、次溴酸能和水,则加入氢氧化钠溶液后分液,能够除去 溴苯中混有的溴单质杂质,故 C 正确;D.饱和碳酸钠溶液能与乙酸反应生成溶于水的乙酸钠,降低乙酸乙 酯的溶解度,便于分层,则饱和碳酸钠溶液后分液,能够除去乙酸乙酯中混有的乙酸杂质,故 D 正确; 故选 A。 9.海水资源开发利用的部分过程如图所示。下列说法错误的是 A.向苦卤中通入 Cl2 是为了提取溴 B.粗盐可采用溶解、除杂和蒸发结晶等过程提纯 C.工业生产中常选用 NaOH 作为沉淀剂 D.制取淡水也是海水资源综合利用的一个重要方面 【答案】C 【解析】 A.氯气具有强氧化性,能把溴离子氧化为单质溴,因此向苦卤中通入 Cl2 是为了提取溴,A 正确; B.粗盐中的钙离子、镁离子等可采用沉淀法除去,所得氯化钠溶液可采用重结晶等过程提纯,B 正确; C.工业生产常选用来源更广泛、价格更便宜的石灰乳作为沉淀剂,用氢氧化钠不经济,C 错误; D.海水综合利用主要包括海水淡化、海水直接利用和海水化学元素利用三个方面,制取淡水也是海水资源 综合利用的一个重要方面,故 D 正确; 答案选 C。 10.下列表中所采取的分离方法与对应原理都正确的是 选项 目的 分离方法 原理 A 分离溶于水中的碘 乙醇萃取 碘在乙醇中的溶解度较大 B 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大 C 除去 KNO3 中混杂的 NaCl 重结晶 NaCl 在水中的溶解度很大 D 分离苯和溴苯 分液 二者不互溶 【答案】B 【解析】 A.乙醇易溶于水,不能用于萃取剂,应用苯或四氯化碳,故 A 错误; B.丁醇与乙醚沸点不同,可蒸馏分离,故 B 正确; C.硝酸钾与氯化钠的溶解度随温度变化不同,硝酸钾溶解度随温度变化较大,故 C 错误; D.苯和溴苯混溶,应用蒸馏的方法分离,故 D 错误。 答案选 B。 1.[2020·新课标Ⅰ]下列气体去除杂质的方法中,不能实现目的的是 气体(杂质) 方法 A SO2(H2S) 通过酸性高锰酸钾溶液 B Cl2(HCl) 通过饱和的食盐水 C N2(O2) 通过灼热的铜丝网 D NO(NO2) 通过氢氧化钠溶液 【答案】A 【解析】SO2 和 H2S 都具有较强的还原性,都可以被酸性高锰酸钾溶液氧化;因此在用酸性高锰酸钾溶液除 杂质 H2S 时,SO2 也会被吸收,故 A 项不能实现除杂目的;氯气中混有少量的氯化氢气体,可以用饱和食 盐水除去;饱和食盐水在吸收氯化氢气体的同时,也会抑制氯气在水中的溶解,故 B 项能实现除杂目的; 氮气中混有少量氧气,在通过灼热的铜丝网时,氧气可以与之发生反应: ,而铜与氮 气无法反应,因此可以采取这种方式除去杂质氧气,故 C 项能实现除杂目的;NO2 可以与 NaOH 发生反应: ,NO 与 NaOH 溶液不能发生反应;尽管 NO 可以与 NO2 一同 跟 NaOH 发生反应: ,但由于杂质的含量一般较少,所以也不会对 NO 的量产生较大的影响,故 D 项能实现除杂的目的;答案选 A。 2.(2020·浙江卷)固液分离操作中,需要用到的仪器是( ) A. B. C. D. 【答案】C 【解析】该仪器是干燥管,不能用于固液分离,A 不符合题意;该仪器为蒸馏烧瓶,不能用于固液分离,B 不符合题意;该仪器为普通漏斗,常用于过滤以分离固液混合物,C 符合题意;该仪器为牛角管,又叫接液 管,连接在冷凝管的末端以收集蒸馏产生的蒸气所冷凝成的液体,不能用于固液分离,D 不符合题意。综 上所述,本题答案为 C。 3.[2018 海南卷]下列分离方法正确的是 A.回收水溶液中的 I2:加入乙酸,分液,蒸发 B.回收含有 KCl 的 MnO2:加水溶解,过滤,干燥 C.除去氨气中的水蒸气:通过盛有 P2O5 的干燥管 D.除去乙醇中的水,加入无水氯化钙,蒸馏。 【答案】B 【解析】A.乙酸能溶于水,不能用分液方法分开,不符合题意; B.氯化钾能溶于水,而二氧化锰不溶于水,故可通过过滤除去,符合题意; C. P2O5 为酸性氧化物,能跟碱性物质发生反应,故不能用来吸收氨气,不符合题意; D. 无水氯化钙能与乙醇形成络合物,除去乙醇中的水,不能用无水氯化钙,应加氧化钙,蒸馏,不符 合题意;故答案选 B。 【点睛】本题为分离、除杂题,解题时要明确除杂、提纯要求:能除去杂质,不能与期望所得产物发生 反应,不能引入新的杂质。 4.[2018 浙江 4 月选考]下列操作或试剂的选择不合理的是 A.可用蒸发结晶的方法从碘水中提取砷单质 B.可用灼烧法除去氧化制中混有的铜粉 C.可用硫酸鉴别碳酸钠、硅酸钠和硫酸钠 D.可用含氢氧化钠的氢氧化铜悬浊液鉴别乙醇、乙醛和乙酸 【答案】A 【解析】A 项,碘单质不易溶于水,易溶于有机溶液,一般使用萃取来提纯,故 A 项错误; B 项,Cu 与氧气反应生成氧化铜,则灼烧可除去杂质,故 B 项正确; C 项,硫酸与碳酸钠反应生成气体,与硅酸钠反应会有沉淀生成,易于分辨,故 C 项正确; D 项,乙醇、乙醛和乙酸分别与氢氧化钠的氢氧化铜悬浊液混合加热的现象为:无现象、砖红色沉淀、 蓝色溶液,现象不同可鉴别,故 D 项正确。 综上所述,本题正确答案为 A。 5.[2018 新课标Ⅰ]磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧 硫酸亚铁锂电池正极片中的金属,其流程如下: 下列叙述错误的是 A. 合理处理废旧电池有利于保护环境和资源再利用 B. 从“正极片”中可回收的金属元素有 Al、Fe、Li C. “沉淀”反应的金属离子为 Fe3+ D. 上述流程中可用硫酸钠代替碳酸钠 【答案】D 【解析】分析:正极片碱溶时铝转化为偏铝酸钠,滤渣中含有磷酸亚铁锂,加入硫酸和硝酸酸溶,过滤 后滤渣是炭黑,得到含 Li、P、Fe 的滤液,加入碱液生成氢氧化铁沉淀,滤液中加入碳酸钠生成含锂的 沉淀,据此解答。 A、废旧电池中含有重金属,随意排放容易污染环境,因此合理处理废旧电池有利于保护环境和资源再 利用,A 正确; B、根据流程的转化可知从正极片中可回收的金属元素有 Al、Fe、Li,B 正确; C、得到含 Li、P、Fe 的滤液,加入碱液生成氢氧化铁沉淀,因此“沉淀”反应的金属离子是 Fe3+,C 正 确; D、硫酸锂能溶于水,因此上述流程中不能用硫酸钠代替碳酸钠,D 错误。答案选 D。 6.[2017 天津]以下实验设计能达到实验目的的是 实验目的 实验设计 A 除去 NaHCO3 固体中的 Na2CO3 将固体加热至恒重 B 制备无水 AlCl3 蒸发 Al 与稀盐酸反应后的溶液 C 重结晶提纯苯甲酸 将粗品水溶、过滤、蒸发、结晶 D 鉴别 NaBr 和 KI 溶液 分别加新制氯水后,用 CCl4 萃取 【答案】D 【解析】加热至恒重得到的是 Na2CO3,A 项错误;制备无水 AlCl3 时,应将 AlCl3 溶液在 HCl 氛围中加 热蒸发,B 项错误;重结晶提纯苯甲酸时,应将粗品制成其热饱和溶液,趁热过滤,再冷却结晶,洗涤 晶体,C 项错误;鉴别 NaBr 和 KI 溶液,分别加入新制氯水后,用 CCl4 萃取,Br2 的 CCl4 溶液呈橙红色, I2 的 CCl4 溶液呈紫红色,D 项正确。 7.[2016 北京]下列中草药煎制步骤中,属于过滤操作的是 A.冷水浸泡 B.加热煎制 C.箅渣取液 D.灌装保存 【答案】C 【解析】A、冷水浸泡属于物质的溶解,A 错误;B、加热煎制属于加热,B 错误;C、箅渣取液属于过 滤操作,C 正确;D、灌装保存是液体转移,D 错误。答案选 C。 8.[2016 北京]在一定条件下,甲苯可生成二甲苯混合物和苯。有关物质的沸点、熔点如下: 对二甲苯 邻二甲苯 间二甲苯 苯 沸点/℃ 138 144 139 80 熔点/℃ 13 −25 −47 6 下列说法不正确的是 A.该反应属于取代反应 B.甲苯的沸点高于 144 ℃ C.用蒸馏的方法可将苯从反应所得产物中首先分离出来 D.从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来 【答案】B 【解析】A、甲苯变二甲苯是甲苯苯环上的氢原子被甲基代替,属于取代反应,A 正确;B、甲苯的相对 分子质量比二甲苯小,故沸点比二甲苯低,B 错误;C、苯的沸点与二甲苯的沸点相差较大,可以用蒸 馏的方法分离,C 正确;D、因为对二甲苯的熔点较高,冷却后容易形成固体,所以能用冷却结晶的方 法分离出来,D 正确。答案选 B。 9.[2016 上海]实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示。下列分析正确的是 A.操作Ⅰ是过滤,将固体分离除去 B.操作Ⅱ是加热浓缩,趁热过滤,除去杂质氯化钠 C.操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来 D.操作Ⅰ~Ⅲ总共需两次过滤 【答案】C 【解析】KNO3 中混有 NaCl 应提纯 KNO3,将它们都溶于水,并降温结晶。因为 KNO3 的溶解度随温度 的升高而升高,NaCl 的溶解度随温度的升高而基本无明显变化。则有,操作Ⅰ是在烧杯中加水溶解,操 作Ⅱ是蒸发浓缩,得到较高温度下的 KNO3 饱和溶液,操作Ⅲ为冷却结晶,利用溶解度差异使 KNO3 结 晶析出,过滤,洗涤,干燥得到 KNO3 晶体。故选 C。查看更多