- 2021-05-22 发布 |
- 37.5 KB |
- 4页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习人教版物质的分类与转化物质的分散系教案
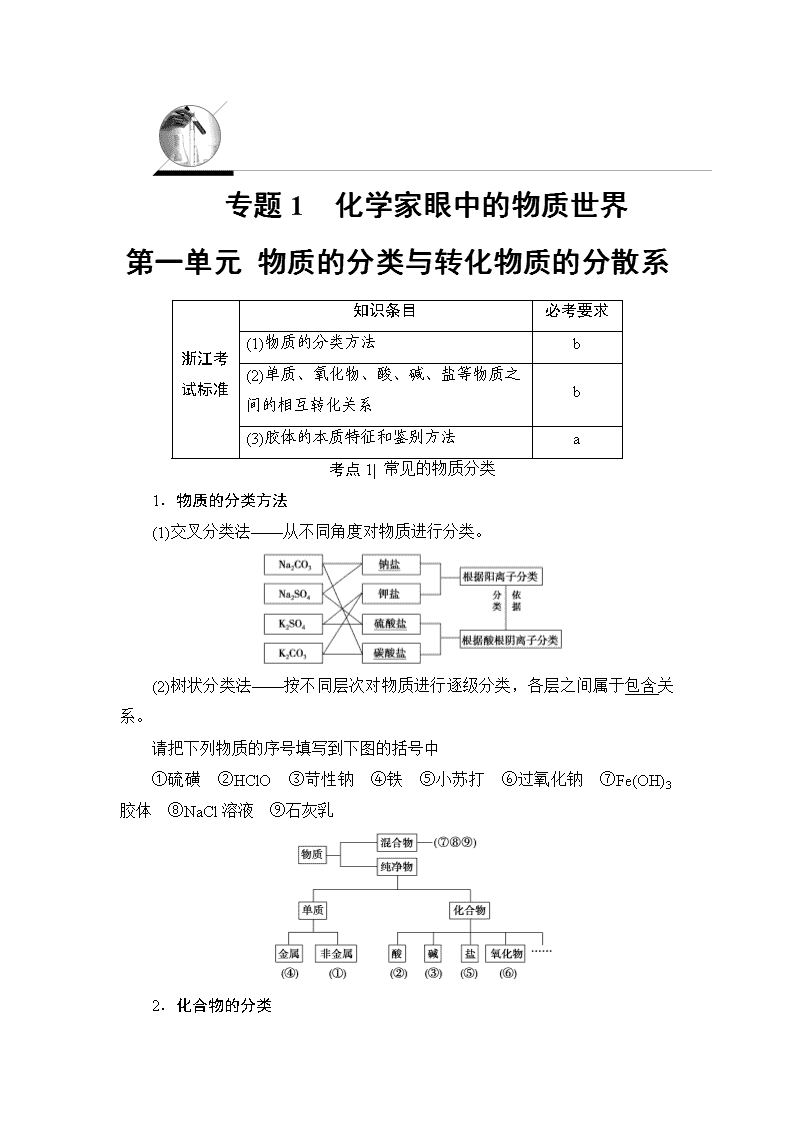
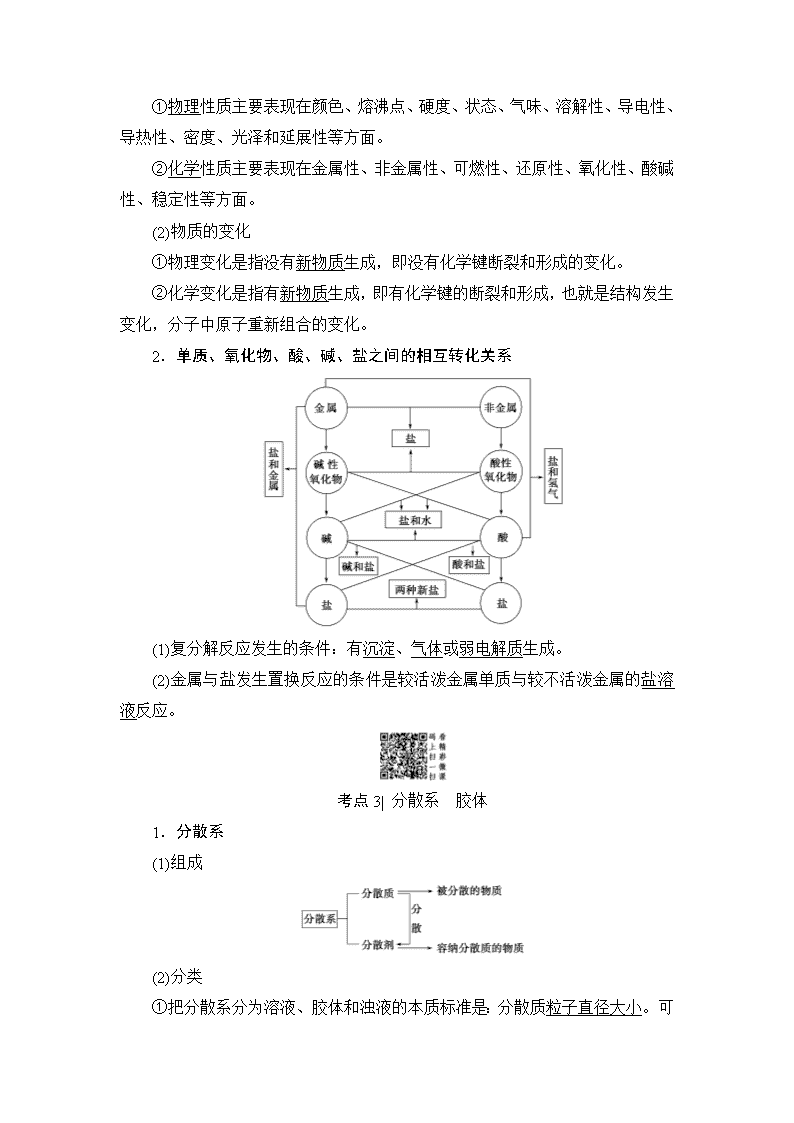
专题1 化学家眼中的物质世界 第一单元 物质的分类与转化物质的分散系 浙江考试标准 知识条目 必考要求 (1)物质的分类方法 b (2)单质、氧化物、酸、碱、盐等物质之间的相互转化关系 b (3)胶体的本质特征和鉴别方法 a 考点1| 常见的物质分类 1.物质的分类方法 (1)交叉分类法——从不同角度对物质进行分类。 (2)树状分类法——按不同层次对物质进行逐级分类,各层之间属于包含关系。 请把下列物质的序号填写到下图的括号中 ①硫磺 ②HClO ③苛性钠 ④铁 ⑤小苏打 ⑥过氧化钠 ⑦Fe(OH)3胶体 ⑧NaCl溶液 ⑨石灰乳 2.化合物的分类 3.氧化物的简单分类 (1)碱性氧化物 ①概念:能与酸反应生成盐和水的氧化物。 ②反应实例:CuO+H2SO4===CuSO4+H2O。 ③举例:CaO、Na2O、CuO、Fe2O3等。 (2)酸性氧化物 ①概念:能与碱反应生成盐和水的氧化物。 ②反应实例:CO2+2NaOH===Na2CO3+H2O。 ③举例:CO2、SO2、SO3等。 4.化学反应的分类 虽然物质间转化时所发生的反应千变万化,但绝大多数无机物之间所发生的化学反应,基本上属于以下几种类型。 (1)四种基本化学反应类型 根据参加反应的物质种类不同,可以将化学反应分为化合反应、分解反应、置换反应和复分解反应四种基本类型。 (2)氧化还原反应 根据化学反应过程中元素的化合价是否发生变化,可以将化学反应分为氧化还原反应和非氧化还原反应。 氧化还原反应:元素化合价发生变化的反应。氧化还原反应的本质是反应过程中发生了电子转移(电子得失或电子偏移)。 (3)四种反应类型与氧化还原反应的关系 在四种基本反应类型中,置换反应一定属于氧化还原反应,复分解反应一定不属于氧化还原反应。 考点2| 物质的性质与变化 1.物质的性质和变化 (1)物质的性质 ①物理性质主要表现在颜色、熔沸点、硬度、状态、气味、溶解性、导电性、导热性、密度、光泽和延展性等方面。 ②化学性质主要表现在金属性、非金属性、可燃性、还原性、氧化性、酸碱性、稳定性等方面。 (2)物质的变化 ①物理变化是指没有新物质生成,即没有化学键断裂和形成的变化。 ②化学变化是指有新物质生成,即有化学键的断裂和形成,也就是结构发生变化,分子中原子重新组合的变化。 2.单质、氧化物、酸、碱、盐之间的相互转化关系 (1)复分解反应发生的条件:有沉淀、气体或弱电解质生成。 (2)金属与盐发生置换反应的条件是较活泼金属单质与较不活泼金属的盐溶液反应。 考点3| 分散系 胶体 1.分散系 (1)组成 (2)分类 ①把分散系分为溶液、胶体和浊液的本质标准是:分散质粒子直径大小 。可用如下方式直观地表示: ②若按分散质或分散剂的状态分类,可分为9种分散系,如图: 如烟属于固气分散系;雾属于液气分散系; 悬浊液属于固液分散系;合金属于固固分散系。 2.胶体 (1)本质特征:分散质粒子的直径为10-9~10-7_m。 (2)胶体的性质 ①丁达尔效应 当光束通过胶体时,在垂直于光线的方向可以看到一条光亮的通路的现象。可用于鉴别胶体和溶液。 ②胶体的吸附性 利用胶体所具有的极强的吸附性,Al(OH)3胶体和Fe(OH)3胶体可用于净水。 (3)胶体的主要应用 ①作净水剂。 ②可以改进材料的机械性能和光学性质。 ③医学上利用高度分散的胶体来检验或治疗疾病。 ④国防工业中有些火药、炸药须制成胶体。 (4)Fe(OH)3胶体的实验室制备 ①方法:将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至液体呈红褐色,即制得Fe(OH)3胶体。 ②化学方程式为FeCl3+3H2OFe(OH)3(胶体)+3HCl。 (4)几种常见胶体 ①烟或雾 ②鸡蛋白的溶液 ③血液 ④淀粉溶液 ⑤豆浆 ⑥牛奶 ⑦墨水 ⑧Fe(OH)3胶体 ⑨硅酸胶体查看更多