- 2021-05-22 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届(鲁科版)高考化学一轮复习化学平衡学案
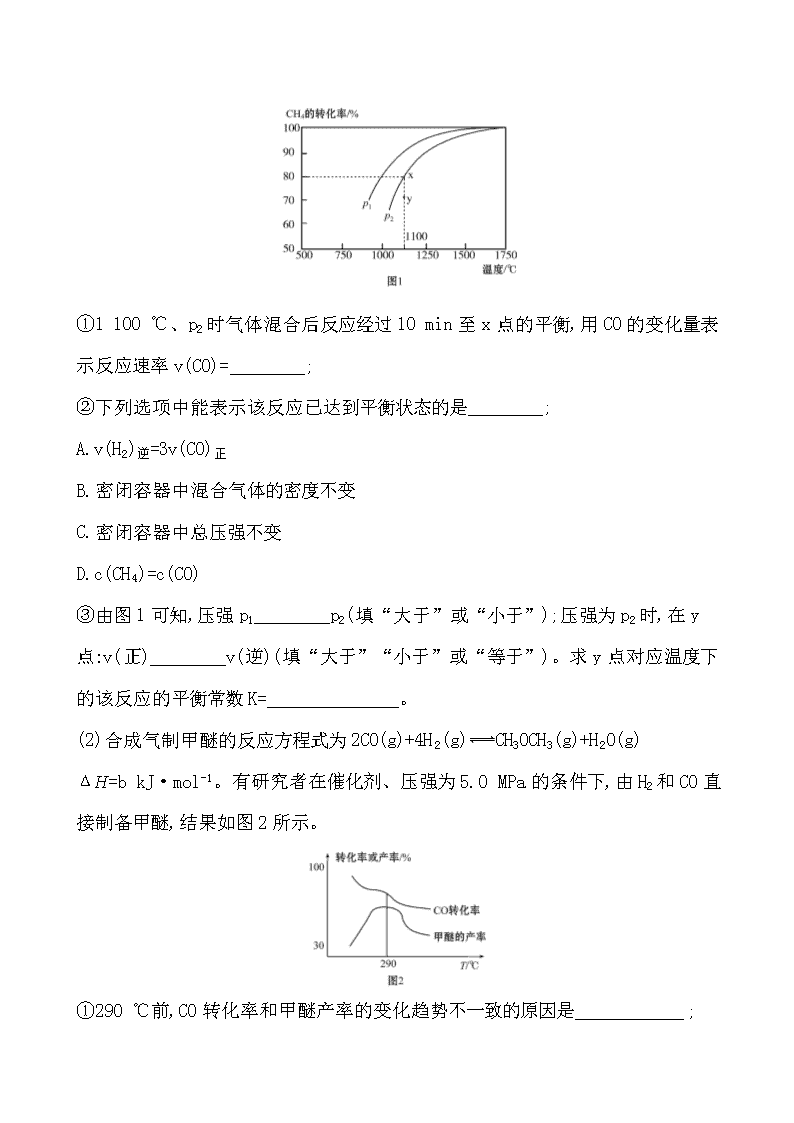
化学平衡 温室效应,又称“花房效应”,是大气保温效应的俗称。大气能使太阳短波辐射到达地面,但地表受热后向外放出的大量长波热辐射线却被大气吸收,这样就使地表与低层大气温作用类似于栽培农作物的温室,故名温室效应。自工业革命以来,人类向大气中排入的二氧化碳等吸热性强的温室气体逐年增加,大气的温室效应也随之增强,已引起全球气候变暖等一系列极其严重的问题,引起了全世界各国的关注。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展,其反应为Ⅰ.3H2(g)+CO2(g)CH3OH(g)+H2O(g) ΔH1=-48.9 kJ·mol-1。 问题1:为提高CH3OH的产率,理论上应采用什么样的条件?(素养角度——变化观念与平衡思想) 提示:根据热化学方程式可知,生成CH3OH的方向是放热反应方向,也是气体体积减小的方向,因此提高CH3OH的产率,需要降低温度升高压强。 问题2:250 ℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),如图为不同投料比[n(H2)/n(CO2)]时某反应物X平衡转化率变化曲线。判断反应物X是CO2还是H2。(素养角度——证据推理与模型认知) 提示:观察图中的横坐标,其物理量为,若假设n(CO2)为定值,则X的转化率随n(H2)的增大而增大,则X为CO2。 问题3:在催化剂CZZA(普通铜基催化剂)作用下合成甲醇时会发生如下副反应Ⅱ.CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=41.2 kJ·mol-1。现将1 mol CO2与3 mol H2通入恒容密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的CO2中生成甲醇的物质的量分数)随温度的变化趋势如图所示: 请分析随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低的原因。(素养角度——变化观念与平衡思想) 提示:升高温度,反应Ⅰ为放热反应,平衡逆向移动,反应Ⅱ为吸热反应,平衡正向移动且程度较大,所以CO2平衡转化率增加但甲醇的选择率降低,故答案为随温度升高,反应Ⅰ放热,平衡逆移,反应Ⅱ吸热,平衡正移且程度较大,所以CO2平衡转化率增加但甲醇的选择率降低。 CO和H2的混合气体又称“合成气”,在合成有机物中应用广泛。工业上常采用天然气与水蒸气或二氧化碳反应等方法来制取合成气。请回答下列问题: (1)天然气与CO2反应也可制备合成气,在10 L密闭容器中通入1 mol CH4与1 mol CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图1所示。 ①1 100 ℃、p2时气体混合后反应经过10 min至x点的平衡,用CO的变化量表示反应速率v(CO)=________; ②下列选项中能表示该反应已达到平衡状态的是________; A.v(H2)逆=3v(CO)正 B.密闭容器中混合气体的密度不变 C.密闭容器中总压强不变 D.c(CH4)=c(CO) ③由图1可知,压强p1________p2(填“大于”或“小于”);压强为p2时,在y点:v(正)________v(逆)(填“大于”“小于”或“等于”)。求y点对应温度下的该反应的平衡常数K=______________。 (2)合成气制甲醚的反应方程式为2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) ΔH=b kJ·mol-1。有研究者在催化剂、压强为5.0 MPa的条件下,由H2和CO直接制备甲醚,结果如图2所示。 ①290 ℃前,CO转化率和甲醚产率的变化趋势不一致的原因是 __________; ②b________0(填“ >”“<”或“=”) ,理由是__ ___________________。 【解析】(1)CH4和CO2反应制备合成气的反应为CH4(g)+CO2(g)2CO(g)+2H2(g)。 ①由图象知1 100 ℃、p2时CH4的转化率为80%,则转化CH4的物质的量为1 mol ×80%=0.8 mol,根据方程式知生成CO物质的量为1.6 mol,v(CO)=1.6 mol÷ 10 L÷10 min=0.016 mol·L-1·min-1。 ②A,v(H2)逆=3v(CO)正表明逆反应速率大于正反应速率,反应没有达到平衡状态;B,该反应中所有物质都是气态,根据质量守恒定律,混合气体的质量始终不变,容器的容积不变,混合气体的密度始终不变,密闭容器中混合气体的密度不变不能说明反应达到平衡状态;C,该反应的正反应是气体分子数增大的反应,建立平衡过程中气体分子物质的量增大,密闭容器中总压强增大,平衡时气体分子物质的量不变,密闭容器中总压强不变,密闭容器中总压强不变能说明反应达到平衡状态;D,达到平衡时各物质的浓度保持不变,不一定相等,c(CH4)=c(CO)不能说明反应达到平衡状态;能说明反应达到平衡状态的是C项,答案选C。 ③该反应的正反应为气体分子数增大的反应,增大压强平衡向逆反应方向移动,CH4的转化率减小,由图知在相同温度下p1时CH4的转化率大于p2,则p1小于p2。由图知,y点CH4转化率小于平衡时CH4的转化率,反应正向进行,v(正)大于v(逆)。y点的温度与x点的温度相同,y点平衡常数与x点相等,用三段式 K== =1.638 4 (mol·L-1)2。 (2)①290 ℃前,CO转化率和甲醚产率的变化趋势不一致,说明在290 ℃前有副反应发生。 ②由图可见升高温度,CO转化率减小,甲醚产率减小,升高温度平衡向逆反应方向移动,逆反应为吸热反应,正反应为放热反应,ΔH<0,即b<0。 答案:(1)①0.016 mol·L-1·min-1 ②C ③小于 大于 1.638 4 mol2·L-2 (2)①有副反应发生 ②< 平衡后,升高温度,甲醚的产率降低 【加固训练】 1.汽车尾气系统中的催化转化器,可有效降低尾气中的CO、NO和NO2等向大气的排放。在催化转化器的前半部分发生的反应为2CO(g)+2NO(g)2CO2(g) +N2(g)。一定条件下,下列说法能充分说明该反应已经达到化学平衡状态的是 ( ) A.正、逆反应速率都等于零 B.CO、NO、CO2、N2的浓度相等 C.CO、NO、CO2、N2在容器中共存 D.CO、NO、CO2、N2的浓度均不再变化 【解析】选D。在一定条件下,当一个可逆反应的正反应速率与逆反应速率相等时且不等于零,或反应物的浓度与生成物的浓度不再改变即为平衡状态,故A错误;CO、NO、CO2、N2的浓度相等,并不能说明各物质的浓度不变,不能说明反应达到了平衡状态,故B错误;可逆反应中的反应物和生成物都会同时存在于一个容器中,CO、NO、CO2、N2在容器中共存不能说明为平衡状态,故C错误;CO、NO、CO2、N2的浓度均不再变化能够说明反应达到平衡状态,故D正确。 2.氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是 ( ) A.容器内气体压强保持不变 B.吸收y mol H2只需1 mol MHx C.若降温,该反应的平衡常数减小 D.若向容器内通入少量氢气,则v(放氢)>v(吸氢) 【解析】选A。MHx(s)+yH2(g)MHx+2y(s) ΔH<0,该反应属于气体的物质的量发生改变的反应。平衡时气体的物质的量不变,压强不变,A正确;该反应为可逆反应,吸收y mol H2需要大于1 mol的MHx,B错误;降低温度,平衡向正反应方向移动,平衡常数增大,C错误;向容器内通入少量氢气,相当于增大压强,平衡正向移动,v(放氢)查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档