- 2021-05-21 发布 |
- 37.5 KB |
- 21页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届高考化学一轮复习化学反应与能量作业(1)
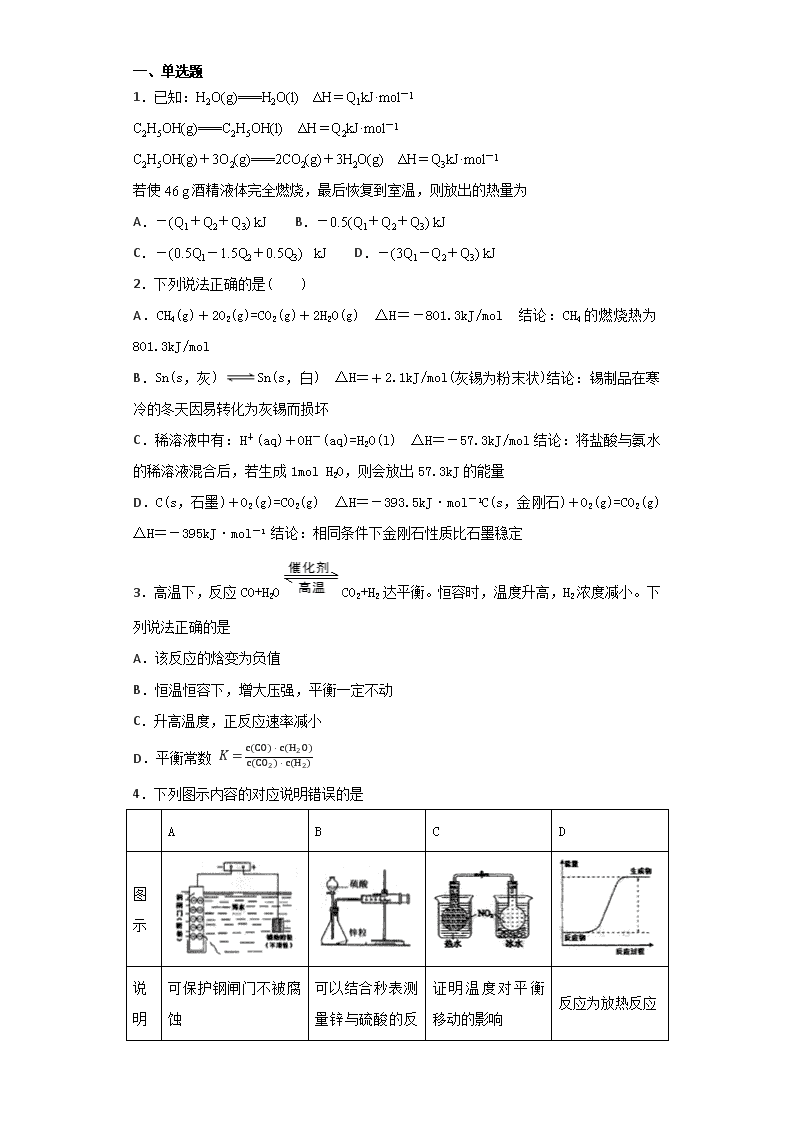
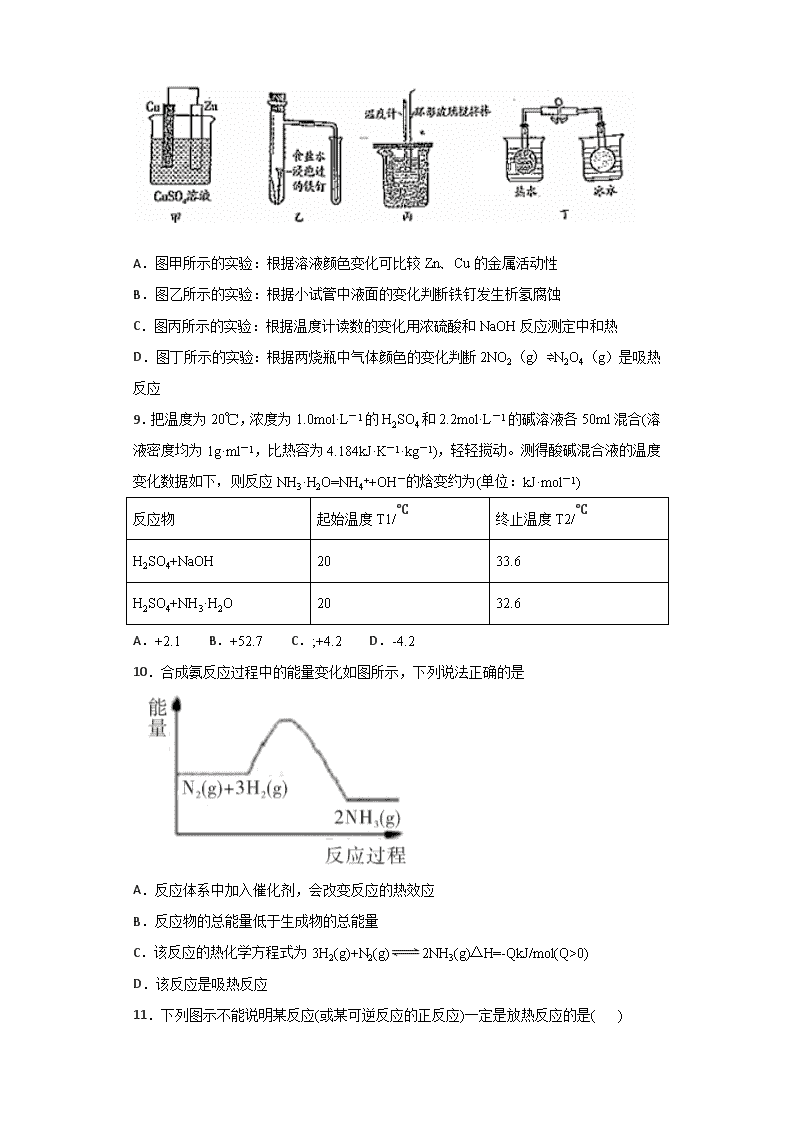
一、单选题 1.已知:H2O(g)===H2O(l) ΔH=Q1kJ·mol-1 C2H5OH(g)===C2H5OH(l) ΔH=Q2kJ·mol-1 C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=Q3kJ·mol-1 若使46 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为 A.-(Q1+Q2+Q3) kJ B.-0.5(Q1+Q2+Q3) kJ C.-(0.5Q1-1.5Q2+0.5Q3) kJ D.-(3Q1-Q2+Q3) kJ 2.下列说法正确的是( ) A.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-801.3kJ/mol 结论:CH4的燃烧热为801.3kJ/mol B.Sn(s,灰) Sn(s,白) ΔH=+2.1kJ/mol(灰锡为粉末状)结论:锡制品在寒冷的冬天因易转化为灰锡而损坏 C.稀溶液中有:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol结论:将盐酸与氨水的稀溶液混合后,若生成1mol H2O,则会放出57.3kJ的能量 D.C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1C(s,金刚石)+O2(g)=CO2(g) ΔH=-395kJ·mol-1 结论:相同条件下金刚石性质比石墨稳定 3.高温下,反应CO+H2OCO2+H2 达平衡。恒容时,温度升高,H2浓度减小。下列说法正确的是 A.该反应的焓变为负值 B.恒温恒容下,增大压强,平衡一定不动 C.升高温度,正反应速率减小 D.平衡常数 K=c(CO)⋅c(H2O)c(CO2)⋅c(H2) 4.下列图示内容的对应说明错误的是 A B C D 图示 说明 可保护钢闸门不被腐蚀 可以结合秒表测量锌与硫酸的反 证明温度对平衡移动的影响 反应为放热反应 应速率 A.A B.B C.C D.D 5.下列有关热化学方程式书写及对应表述均正确的是( ) A.密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6g时,放出19.12kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6kJ.mol-1 B.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol C.已知1mol氢气完全燃烧生成液态水所放出的热量为285.5kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5kJ.mol-1 D.已知2C(s)+O2(g)═2CO(g)△H=-22.1kJ.mol-1则可知C的燃烧热△H=-110.5kJ.mol-1 6.某科研团队研制出“TM﹣LiH(TM表示过渡金属)”双催化剂体系,显著提高了在温和条件下氮气和氢气合成NH3的效率,原理示意如下: 下列分析不合理的是( ) A.状态Ⅰ,吸收能量并有N≡N键发生断裂 B.合成NH3总反应的原子利用率是100% C.“TM﹣LiH”能降低合成氨反应的△H D.生成NH3:2LiNH+3H2═2LiH+2NH3 7.下列说法正确的是( ) A.需要加热才能发生的反应一定是吸热反应 B.化学反应中的能量变化都表现为热量变化 C.反应物和生成物所具有的总能量决定了反应是放热还是吸热 D.向醋酸钠溶液中滴入酚酞试液,加热后溶液红色加深,说明盐类水解是放热的 8.对下列实验的描述正确的是 A.图甲所示的实验:根据溶液颜色变化可比较Zn、Cu的金属活动性 B.图乙所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀 C.图丙所示的实验:根据温度计读数的变化用浓硫酸和NaOH反应测定中和热 D.图丁所示的实验:根据两烧瓶中气体颜色的变化判断2NO2(g)⇌N2O4(g)是吸热反应 9.把温度为20℃,浓度为1.0mol·L-1的H2SO4和2.2mol·L-1的碱溶液各50ml混合(溶液密度均为1g·ml-1,比热容为4.184kJ·K-1·kg-1),轻轻搅动。测得酸碱混合液的温度变化数据如下,则反应NH3·H2O=NH4++OH-的焓变约为(单位:kJ·mol-1) 反应物 起始温度T1/℃ 终止温度T2/℃ H2SO4+NaOH 20 33.6 H2SO4+NH3·H2O 20 32.6 A.+2.1 B.+52.7 C.;+4.2 D.-4.2 10.合成氨反应过程中的能量变化如图所示,下列说法正确的是 A.反应体系中加入催化剂,会改变反应的热效应 B.反应物的总能量低于生成物的总能量 C.该反应的热化学方程式为3H2(g)+N2(g)2NH3(g)△H=-QkJ/mol(Q>0) D.该反应是吸热反应 11.下列图示不能说明某反应(或某可逆反应的正反应)一定是放热反应的是( ) A.A B.B C.C D.D 12.中和热是( ) A.酸和碱反应生成1mol水时所放出的热; B.1mol酸和1mol碱反应生成盐和水时所放出的热; C.强酸稀溶液和强碱稀溶液反应生成1mol液态水时所放出的热; D.稀Ba(OH)2和稀H2SO4完全反应生成1mol水时所放出的热。 二、综合题 13.按要求填空: (1)下列物质中,属于电解质的是_________,属于非电解质的是_________,属于强电解质的是________,属于弱电解质的是__________。(填序号) ①氯化钠溶液 ②氯化氢气体 ③一水合氨 ④酒精 ⑤二氧化碳 ⑥ 铁粉 (2)下表列出了几种化学键的键能: 化学键 H—H Cl—Cl H—Cl 键能 / kJ·mol-1 436 243 431 请根据以上信息写出氢气在氯气中燃烧生成氯化氢气体的热化学方程式为____________ (3)已知下列热化学方程式: Zn(s) + 1/2O2(g) = ZnO(s) △H1 = -351.1 kJ/mol Hg(l) + 1/2O2(g) = HgO(s) △H2 = -90.1 kJ/mol 由此可知反应:Zn(s) + HgO(s) = ZnO(s) + Hg(l) 的焓变△H = ____________________。 14.硫及其化合物在生产生活中应用广泛。回答下列问题: (1)铁铵矾是一种化学物质,分子式是 NH4Fe(SO4)2·12H2O,其溶于水后,溶液中的离子浓度大小关系为__________________。 (2)已知某溶液中含有 CO32-、SO42-等离子,取一定量的该溶液,向其中滴加BaCl2溶液,当 CO32-开始沉 淀时,溶液中c(CO32-)/c(SO42-)为_______________。(已知 Ksp(BaSO4 )=1.0×10-10 ,Ksp(BaCO3)=2.5×10-9 ) (3)已知:S2Cl2(l)+Cl2(g)=2SCl2(l) ΔH=-50.2kJ·mol-1 。断裂 1molCl-Cl键、1molS-S键分别需要吸收 243kJ、268kJ 的能量,则断裂 1mol S-Cl键需要吸收的能量为____kJ。 (4)用 NaOH 溶液吸收烟气中的 SO2,将所得的 Na2SO3 溶液进行电解,可以制备H2SO4,其原理如下图所示(电极材料为石墨)。 阳极的电极反应式为______________________;其中可循环使用的物质是________。 15.二氧化碳是导致温室效应的主要气体,其对应的水溶液碳酸是可乐饮料的主要成分之一。回答下列问题: (1)下列事实中,能证明碳酸是弱酸的是________. A.碳酸不稳定,易分解为二氧化碳和水 B.用氢氧化钠溶液中和等浓度的碳酸溶液,需要氢氧化钠溶液的体积是碳酸体积的2倍 C.相同条件下,碳酸的导电能力低于相同浓度的硫酸溶液 D.常温下,5.0×10-6mol/L的碳酸溶液pH值为6 (2)煤的燃烧也是导致温室效应的原因之一,其燃烧有下列两种途径: 途径I:C(s)+O2(g)=CO2(g) ΔH=Q1kJ/mol 途径II:先制水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH=Q2kJ/mol;再燃烧水煤气:CO(g)+1/2O2(g)=CO2(g) ΔH=Q3kJ/mol;H2(g)+1/2O2(g)=H2O(g) ΔH=Q4kJ/mol则Q1、Q2、Q3、Q4的数学关系式是___________________________________; (3)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol/L。 ①向饱和碳酸溶液中分别加入下列物质,能使碳酸的第一步电离平衡向右移动的是_________ A.HCl气体 B.NaOH固体 C.Na单质 D.苯酚钠溶液 ②若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO3-+H+的平衡常数K1=_______。(已知:10-5.6=2.5×10-6,保留一位小数); 16.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题: (1)下图是1 mol NO2和1 mol CO反应生成CO2 和NO过程中的能量变化示意图,请写出NO2 和CO反应的热化学方程式 _______________________________________。 (2)在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表: T/℃ 200 300 400 K K1 K2 0.5 请回答下列问题: ①试比较K1、K2的大小,K1_________K2(填”>”“=“或”<”)。 ②下列各项能作为判断该反应达到化学平衡状态的依据是_________(填序号字母)。 a.容器内N2、H2、NH3的浓度之比为1:3:2 b.3v正(N2)= v逆(H2) c.容器内压强保持不变 d.混合气体的密度保持不变 ③400℃时,反应2NH3(g) N2(g)+3H2(g)的平衡常数K为______。当测得NH3、N2、H2的浓度分别为3 mol • L−1、2 mol • L−1、1 mol • L−1时,则该反应的v正(N2)____v逆(N2)(填”>”“=“或”<”)。 (3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol−1),在其他条件不变时,温度T1、T2对反应的影响图像如图。 ①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=______mol·L−1·min−1。 ②图示的温度T1______T2(填写“>”、“<”或“=”)。 (4)以甲烷为燃料的新型电池的成本大大低于以氢气为燃料的传统燃料电池,下图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。 ①B电极的反应式为_____________________________________。 ②若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol·L−1的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗甲烷的体积为_________(标准状况)。 17.氮氧化物能形成酸雨和光化学烟雾,严重污染环境。燃煤和机动车尾气是氮氧化物的主要来源。现在对其中的一些气体进行了一定的研究: (1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。 已知:①CH4(g)+4NO2(g)4NO(g)+CO2(g)+2H2O(g) △H= −574 kJ·mol−l ②CH4(g)+4NO(g)2N2(g)+CO2(g)+2H2O(g) △H= −1160 kJ·mol−l 写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式______________________________________________________。 (2)在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体。T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,在一定条件下发生反应,反应过程中NO的物质的量随时间变化如图所示。 ①写出该反应的化学方程式______________________________________。 ②10 min内该反应的速率v(CO)=__________________;T℃时,该化学反应的平衡常数 K=_______。 ③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____________。(填序号) ④一定温度下,在恒容密闭容器中充入一定量NO和CO进行该反应,下列选项能判断反应已达到化学平衡状态的是____________。 A.容器中压强不再变化 B.混合气体的平均相对分子质量不再变化 C.2v正(NO)=v逆(N2) D.气体的密度不再变化 18.氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。 已知:CH4(g)+H2O(g)= CO(g)+3H2(g) ΔH =+206.2 kJ·mol-1 CH4(g)+CO2(g)= 2CO(g)+2H2(g) ΔH =+247.4 kJ·mol-1 2H2S(g)= 2H2(g)+2S (g) ΔH =+169.8 kJ·mol-1 (1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为______。 (2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是__________。燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:____________。 (3)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极),碳元素的电解产物最终被碱液吸收生成碳酸根。电解时,阴、阳极的电极反应式分别为____________, _______________。 19.(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下: ①第一步反应是______________(填“放热”或“吸热”)反应,判断依据是___________。 ②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是___________________。 (2)已知红磷比白磷稳定,则反应P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;ΔH1和ΔH2的关系是ΔH1________ΔH2(填“>”、“<”或“=”)。 (3)在298 K、101 kPa时,已知:①2H2O(g)=O2(g)+2H2(g) ΔH1;②Cl2(g)+H2(g)=2HCl(g) ΔH2;③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3,则ΔH3与ΔH1和ΔH2之间的关系正确的是________。 A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2 C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2 (4)已知: ①2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1②Na2O2(s)+CO2(g)=Na2CO3(s)+12O2(g) ΔH=-226 kJ·mol-1,则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数目为_____________。 (5)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表: 则表中a=________。 20.已知下列热化学方程式: ①2H2(g)+O2(g)=2H2O(l)ΔH=﹣570 kJ•mol-1 ②2H2O(g)=2H2(g)+O2(g)ΔH=+483.6kJ•mol-1 ③2C(s)+O2(g)=2CO(g)ΔH=﹣220.8 kJ•mol-1 ④C(s)+O2(g)=CO2(g)ΔH=﹣393.5 kJ•mol-1 回答下列问题: (1)上述反应中属于吸热反应的是_______(填写序号)。 (2)H2的燃烧热为________。 (3)燃烧10 g H2生成液态水,放出的热量为________。 (4)CO的燃烧热的热化学方程式为______________________。 (5)H2O(l)=H2O(g)ΔH=__________。 参考答案 1.D 【解析】 根据盖斯定律可知,乙醇燃烧热的热化学方程式为:C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=3Q1-Q2+Q3 kJ·mol-1,46 g酒精液体(即为1mol乙醇)完全燃烧最后恢复到室温,则放出的热量为-(3Q1-Q2+Q3) kJ。 2.B 【解析】 A.在25℃、101 kPa时,1mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热,产物水的状态不是液态,A错误; B.由于该反应正反应为吸热反应,温度越低越有利于反应逆向进行,所以锡制品在寒冷的冬天因易转化为灰锡而损坏,B正确; C.该热化学方程式表示“在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态水时放出57.3kJ的热量”,氨水为弱碱溶液,电离需要吸热,所以将盐酸与氨水的稀溶液混合后,若生成1mol H2O,则放出能量小于57.3kJ,C错误; D.根据盖斯定律: C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1 ① C(s,金刚石)+O2(g)=CO2(g) ΔH=-395kJ·mol-1 ② ①-②得C(s,石墨)=C(s,金刚石) ΔH=+1.5 kJ·mol-1,根据能量越低越稳定原理,石墨比金刚石稳定,D错误; 正确答案:B。 3.A 【解析】 A.恒容时,温度升高,H2浓度减小,平衡向逆反应移动,升高温度平衡向吸热反应方向移动,故正反应为放热反应,所以该反应的ΔH<0,故A正确; B.恒温恒容下,若充入稀有气体使压强增大,则平衡不移动;若采取通入氢气增大压强,则H2浓度增大,平衡向逆反应方向移动,故B错误; C.升高温度,正、逆反应速率都增大,故C错误; D.化学平衡常数为平衡时生成物浓度的系数次幂的乘积与反应物浓度的系数次幂的乘积的 比值,由反应方程式CO+H2OCO2+H2可知,该反应的平衡常数K=c(CO2)c(H2)/c(CO)c(H2O),故D错误。 故选A。 4.D 【解析】 A.钢闸门连接电源的负极,可被保护而不被腐蚀,故A正确; B.气体的体积可由注射器量出,结合时间可求出反应速率,故B正确; C.已知2NO2N2O4 △H<0,根据颜色的变化可知平衡移动的方向,以此可确定温度对平衡移动的影响,故C正确; D.图像中反应物的总能量小于生成物的总能量,表示该反应为吸热反应,故D错误。 故选D。 5.A 【解析】 A、密闭容器中,9.6g硫粉物质的量=9.6g32g/mol=0.3mol,与11.2g铁粉物质的量=11.2g56g/mol=0.2mol,混合加热生成硫化亚铁17.6g时,硫过量,放出19.12kJ 热量,所以1mol铁反应放热=19.12kJ ×10.2=95.6kJ,热化学方程式为Fe(s)+S(s)═FeS(s)△H=-95.6kJ.mol-1,所以A选项是正确的; B、中和热是指生成1mol水的可溶性的稀的强酸强碱混合所放出的热量,中和热是以生成1 mol 液态H2O为基准的,故B错误; C、已知1mol氢气完全燃烧生成液态水所放出的热量为285.5kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+571kJ.mol-1,故C错误; D、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,碳燃烧生成的一氧化碳不是稳定氧化物,故D错误。 所以A选项是正确的。 6.C 【解析】 A.状态Ⅰ为氮气生成LiNH的过程,吸收能量并存在N≡N键发生断裂,故A正确; B.由流程可知氮气和氢气反应,生成物只有氨气,原子利用率为100%,故B正确; C.催化剂可降低反应的活化能,但不能降低反应物和生成物的总能量,不能改变反应热,故C错误; D.由状态Ⅲ可知生成NH3:2LiNH+3H2═2LiH+2NH3,故D正确。 故选:C。 7.C 【解析】 A.有的放热反应需要高温条件发生,如铝热反应是放热反应,但需要加热,故A错误; B、化学反应中能量变化的形式有热能、光能、电能等等,不只是热能,故B错误; C、焓变决定于反应物和生成物能量高低,反应物和生成物所具有的总能量决定了反应是放热还是吸热,故C正确; D、醋酸钠水解显碱性,加热时碱性增强,说明水解吸热,故D错误; 故选C。 8.A 【解析】 A.Cu、Zn原电池中,活泼金属为负极,若溶液的蓝色逐渐变浅,说明锌作负极、锌溶解变为锌离子进入溶液,溶液中的铜离子在正极上得电子析出铜,故溶液中的铜离子浓度逐渐减小,故根据溶液的颜色变化可以比较Cu和Zn的金属活动性,A正确; B.析氢腐蚀生成氢气,而吸氧腐蚀中要消耗氧气。由于导管内液面上升,说明有氧气消耗,故发生了吸氧腐蚀,B错误; C.中和滴定应选稀的强酸,不能利用浓硫酸测定中和热,故C错误; D.热水中颜色深,则逆反应为吸热反应,所以正反应为放热反应,故D错误。 故选A。 9.C 【解析】 根据反应的焓变公式△H=-cm△T/n, H2SO4与NaOH反应:①2H+(aq)+2OH-(aq)=2H2O(l)的焓变为-4.184×100×(33.6−20)/0.05×0.001kJ/mol=-113.8kJ/mol, H2SO4与NH3•H2O反应②2H++2NH3•H2O(aq)=2NH4+(aq)+2H2O(l)的焓变为-4.184×100×(32.6−20)/0.05×0.001kJ/mol=-105.4kJ/mol, ②-①得到反应:NH3•H2O(aq)NH4+(aq)+OH-(aq)的焓变 =(-105.4kJ/mol+113.8kJ/mol)×1/2=+4.2kJ/mol,故C选项正确。 故选C。 10.C 【解析】 A.反应体系中加入催化剂,不改变反应的始态和终态,则不会改变反应的热效应,故A错误; B.为放热反应,反应物的总能量大于生成物的总能量,故B错误; C.图象分析反应是放热反应,且注明物质的状态,则反应的热化学方程式为 3H2(g)+N2(g)⇌2NH3(g)△H=-Q kJ/mol,故C正确; D.由图可知,反应物总能量大于生成物能量,为放热反应,故D错误。 故选C。 11.C 【解析】 A.由图可知,反应物的总能量高于生成物的总能量,说明该反应为放热反应,可以说明该反应一定是放热反应; B. 由图可知,反应物的总能量高于生成物的总能量,说明该反应为放热反应,可以说明该反应一定是放热反应; C. 由图可知,反应速率先增大后减小,但不知道反应速率增大的原因,故不能说明反应一定是放热反应; D. 由图可知,根据“先拐先平,数值大”,可判断温度T1>T2,升温后,反应物的体积分数减小,说明升温使平衡向逆向移动,即逆反应为吸热反应,则正反应为放热反应,可以说明该反应一定是放热反应。 故答案选C。 12.C 【解析】 中和热是指强酸、强碱的稀溶液完全反应生成1mol液态水时放出的热量;据此进行分析可知,A错误,B错误,C正确;稀Ba(OH)2和稀H2SO4完全反应生成1mol水,但是同时生成了沉淀,也有热量放出,因此反应放出的热量数值比中和热数值要大,不是中和热,故D错误; 综上所述,本题选C。 13.②③ ④⑤ ② ③ H2(g) +Cl2(g)=2HCl(g) ΔH=-183 kJ·mol-1 -261kJ·mol-1 【解析】 (1)①氯化钠溶液是混合物,既不是电解质,也不是非电解质; ②氯化氢气体在水溶液中是能够完全电离的化合物,属于强电解质; ③一水合氨水溶液中能够部分电离的化合物,属于弱电解质; ④酒精在水溶液中和熔融状态下不能导电的化合物,是非电解质; ⑤二氧化碳在水溶液中导电是因为生成了碳酸,自己在水溶液中和熔融状态下不能导电,是非电解质; ⑥铁是单质,既不是电解质,也不是非电解质; 所以属于电解质的是②③,属于非电解质的是④⑤,属于强电解质的是②,属于弱电解质的是③; 正确答案:②③;④⑤;②;③ 。 (2) ΔH=反应物的总键能之和-生成物的总键能之和=436+243-431×2=-183KJ/mol 氢气在氯气中燃烧生成氯化氢气体的热化学方程式为H2(g) +Cl2(g)=2HCl(g) ΔH=-183 kJ·mol-1; 正确答案:H2(g) +Cl2(g)=2HCl(g) ΔH=-183 kJ·mol-1。 (3)Zn(s) + 1/2O2(g) = ZnO(s) △H1 = -351.1 kJ/mol ① Hg(l) + 1/2O2(g) = HgO(s) △H2 = -90.1 kJ/mol ② 由①- ②得:Zn(s) + HgO(s) = ZnO(s) + Hg(l) △H =-261kJ·mol-1; 正确答案:-261kJ·mol-1。 14.c(SO42-)>c(NH4+)>c(Fe3+)>c(H+)>c(OH-) 25 280.6 SO32--2e-+H2O=SO42-+2H+ NaOH 【解析】 (1)硫酸铁铵NH4Fe(SO4)2·12H2O溶于水形成的溶液中,Fe3+和NH4+水解溶液显酸性,Fe3+的水解程度大于NH4+,水解程度越大,离子浓度越小,所以c(NH4+)>c(Fe3+),硫酸根离子不水解,浓度最大,所以溶液中离子浓度关系c(SO42-)>c(NH4+)>c(Fe3+)>c(H+)>c(OH-)。 因此,本题正确答案是:c(SO42-)>c(NH4+)>c(Fe3+)>c(H+)>c(OH-); (2)根据c(CO32-)/c(SO42-)= Ksp(BaCO3)/ Ksp(BaSO4 )可知,c(CO32-)/c(SO42-)=2.5×10-91.0×10-10=25。 因此,本题正确答案是:25; (3)反应的焓变等于反应物的键能减去生成物的键能,设断裂1mol S-Cl键需要吸收的能量为x,则2x+268 kJ+243 kJ-4x=-50.2 kJ,解得x=280.6 kJ。 因此,本题正确答案是:280.6; (4)图中阴离子向b极移动,则b为阳极,所以b极上SO32-在阳极失电子生成SO42-,其电极方程式为:SO32--2e-+H2O=SO42-+2H+;a为阴极,阴极区放电离子为氢离子生成氢气,B口流出的物质是浓度较大的氢氧化钠溶液,可用来吸收二氧化硫,故可循环使用的物质是NaOH, 因此,本题正确答案是:SO32--2e-+H2O=SO42-+2H+ ;NaOH。 15.CD Q1=Q2+Q3+Q4 BCD 4.2×10-7 mol·L-1 【解析】 (1) A.碳酸易分解为二氧化碳和水, 说明碳酸不稳定;故A错误;B.用氢氧化钠溶液中和等浓度的碳酸溶液,需要氢氧化钠溶液的体积是碳酸体积的2倍,说明碳酸是二元酸,不能证明是弱酸,故B错误;C.导电能力取决于溶液中自由离子浓度的大小,相同条件下,碳酸的导电能力低于相同浓度的硫酸溶液,说明碳酸没有完全电离,即存在电离平衡,说明碳酸是弱酸,故C正确;D.常温下,5.0×10-6mo/L的碳酸溶液,若完全电离,则c(H+)=1.0×10-5mol/L,即pH值为5,但实际上溶液pH值为6,说明碳酸没有完全电离,因此碳酸是弱酸。答案为CD。 (2)由 ①C(s)+H2O(g)=CO(g)+H2(g)ΔH=Q2kJ/mol;②CO(g)+1/2O2(g)=CO2(g)ΔH=Q3kJ/mol;③H2(g)+1/2O2(g)=H2O(g)ΔH=Q4kJ/mol知 ①+②+③得: C(s)+O2(g)=CO2(g)所以Q1、Q2、Q3、Q4的关系式是Q1=Q2+Q3+Q4;答案:Q1=Q2+Q3+Q4。 (3) ①H2CO3=HCO3-+H+ HCO3-=H+ + CO32-,A.向饱和碳酸溶液加入HCl气体平衡向左移动: B.向饱和碳酸溶液加入NaOH固体平衡向右移动;C.向饱和碳酸溶液加入Na单质平衡向右移动: 因为苯酚的酸性比碳酸弱,所以向饱和碳酸溶液加入苯酚钠溶液平衡向右移动。答案:BCD。 ②pH=5.6,c(H+)=, c(H2CO3)=1.5×10-5 mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=c(H+)∙c(HCO3-)/c(H2CO3)=( 1×10-5.6)2/ 1.5×10-5 =4.2×10-7 mol·L-1。 16.NO2(g)+CO(g)= NO(g)+CO2(g) ΔH=−234 kJ • mol−1 > bc 2 > nA /2tA < CH4+4O2−-8e− =CO2+2H2O 1.12 L 【解析】 (1)由图可知:NO 2和CO反应的热化学方程式为:NO 2(g)+CO (g) CO 2(g)+NO (g) △H=-234kJ/mol 。 因此,本题正确答案是:NO2(g)+CO(g)= NO(g)+CO2(g) ΔH=−234 kJ • mol−1; (2)①升高温度化学平衡向吸热反应方向移动。由于该反应的正反应是放热反应。所以升高温度化学平衡向逆反应方向移动。平衡越向逆反应方向移动,反应的平衡常数就越小。所以K1 >K2。 因此,本题正确答案是:>; ②a平衡时各物质的浓度与起始加入的物质的多少有关。只要平衡时各种物质的浓度不变,反应就达到了平衡。错误。 b.在任何时刻都有3 v正(N2)= v正(H2),而3v正(N2)= v逆(H2),代入第一个式子可得v正(H2)= v逆(H2)。反应达到平衡。正确。 c.由于容器的容积不变,若反应达到平衡,各种物质的物质的量不变,容器内压强也保持不变 。正确。 d.反应无论进行到什么程度,质量都不会发生变化,那么任何时刻混合气体的密度都保持不变。所以不能根据容器的容积不变来判断反应达到平衡。错误。 因此,本题正确答案是:bc; ③400℃时,2NH 3(g) N 2(g)+3H 2(g)的化学平衡常数和反应N 2(g)+3H 2(g) 2NH 3(g)的化学平衡常数互为倒数。即为2。 由于浓度商Qc=c(N2)c3(H3)c2(NH3)=2×1332=29<0.5,所以反应向正反应方向移动。即v正(N2)>v逆(N2)。 因此,本题正确答案是:2 ;> ; (3)①根据图像,温度为T1时,从反应到平衡反应生成CH3OH的物质的量为nAmol,生成甲醇的平均速率v(CH3OH)=nA2mol/LtAmin= nA /2tA mol·L−1·min−1; 因此,本题正确答案是:nA /2tA; ②用“先拐先平”法分析,图像中T2先出现拐点,T2反应速率快,根据温度对反应速率的影响知:T1< T2; 因此,本题正确答案是:<; (4)①由阴离子移动方向可以知道B为负极,负极发生氧化反应,甲烷被氧化生成二氧化碳和水,电极的反应式为CH4+4O2−-8e− =CO2+2H2O ,A极是正极,该电极上是氧气得电子的还原反应; 因此,本题正确答案是:CH4+4O2−-8e− =CO2+2H2O; ②硫酸铜的物质的量=0.1L×1mol/L=0.1mol,开始阶段发生反应:2Cu2++2H2O2Cu+O2↑+4H+,铜离子完全放电后,发生反应2H2O2H2↑+ O2↑,当两极收集到的气体体积相等时,即氢气与氧气的体积相等,令氢气为xmol, 根据电子转移守恒,则:0.1mol×2+2x=4x,解得x=0.1, 根据电子转移守恒,可以知道消耗甲烷的物质的量=0.1mol×48=0.05mol, 故消耗甲烷的体积=0.05mol×22.4L/mol=1.12L, 因此,本题正确答案是:1.12L。 17.CH4(g)+2NO2(g)N2(g)+ CO2(g)+2H2O(g) △H=−867 kJ·mol−l 2NO+2CON2+2CO2 0.010 mol·L−l·min−l K=5 bc AB 【解析】 (1)①CH4(g)+4NO2(g)4NO(g)+CO2(g)+2H2O(g) △H= −574 kJ·mol-1;②CH4(g)+4NO(g)2N2(g)+CO2(g)+2H2O(g) △H= −1160 kJ·mol-1;根据盖斯定律可知:1/2×[①+②]可得:CH4(g)+2NO2(g)N2(g)+ CO2(g)+2H2O(g) △H=1/2×(−574-1160)=−867 kJ·mol-1; 综上所述,本题答案是:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) △H=−867 kJ·mol-1。 (2)①将NO和CO转化成无污染气体参与大气循环,则气体为N2和CO2,根据图像分析,NO并未完全反应,该反应为可逆反应,化学方程式为:2NO+2CON2+2CO2; 综上所述。本题答案是:2NO+2CON2+2CO2 。 ②10min时,NO的物质的量变化为△n(NO)=0.4mol-0.2mol=0.2mol,容器体积为V=2L,根据化学反应平均速率的公式v(NO)=∆n(NO)/V∆t=0.2/10×2=0.01mol/(L·min),T℃时,反应达到平衡时,容器中各组分的浓度为c(NO)=0.2/2=0.1mol/L,c(CO)=0.2/2=0.1mol/L,c(N2)=0.1/2=0.05mol/L,c(CO2)=0.2/2=0.1mol/L,则该化学反应的平衡常数K=c2(CO2) c(N2)/c2(CO)c2(NO)=0.12×0.05/0.12×0.12=5L/mol; 综上所述,本题答案是:0.010 mol·L−l·min−l ,K=5。 ③2NO+2CON2+2CO2 △H<0。 a.随着温度升高,反应为放热反应,则化学平衡向逆反应方向移动,平衡常数随温度的升高而减小,故a错误; b.增加N2物质的量,化学平衡向逆反应方向移动,NO的转化率降低,故b正确; c.平衡常数只随温度的改变而改变,改变NO的量不改变化学平衡常数,故c正确; d.随着温度升高,反应为放热反应,则化学平衡向逆反应方向移动,CO的转化率降低,故d错误; 综上所述,本题选bc; ④A.反应为气体分子数发生变化的反应,即随着反应进行,压强发生变化,当容器中压强不再变化时,可以判断化学反应达到平衡状态,故A可选; B.CO2为生成物,当CO2的浓度不再改变时,可判断化学反应达到平衡状态,故B可选; C. v正(NO)=2v逆(N2),可判断化学反应达到平衡状态,而2v正(NO)=v逆(N2)违背化学反应速率之比和系数成正比的规律,故C不选; D.气体密度ρ=m/V,反应前后气体质量m不变,体积为恒容容器,V不变,则化学反应达到平衡前后,气体密度始终不变,不可以判断化学反应是否达到平衡,故D不选; 综上所述,本题选AB。 18.CH4(g)+2H2O(g)===CO2(g)+4H2(g) ΔH=+165.0 kJ·mol-1 为H2S热分解反应提供热量 2H2S+SO2===2H2O+3S 2H2O + 2e- = H2↑+2OH- CO(NH2)2+8OH――6e-===CO32-+N2↑+6H2O 【解析】 (1)①CH4(g)+H2O(g)= CO(g)+3H2(g) ΔH =+206.2 kJ·mol-1 ②CH4(g)+CO2(g)= 2CO(g)+2H2(g) ΔH =+247.4 kJ·mol-1; 根据盖斯定律①×2-②得CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式:CH4(g)+2H2O(g)===CO2(g)+4H2(g) ΔH=+165.0 kJ·mol-1;(2) H2S燃烧放热,可以为H2S热分解反应提供热量;SO2与H2S反应生成水和硫单质,反应方程式是2H2S+SO2===2H2O+3S;(3)阴极是水得电子发生还原反应生成氢气和氢氧根离子,电极反应式是2H2O + 2e- = H2↑+2OH-;阳极CO(NH2)2失电子发生氧化反应,生成碳酸根离子和氮气,电极反应式是CO(NH2)2+8OH――6e-===CO+N2↑+6H2O。 19.放热 ΔH<0(或反应物的总能量大于生成物的总能量) NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1 < A 2NA(或1.204×1024) 369 【解析】 (1) ①由图可知,焓变小于0,即反应物的总能量大于生成物的总能量,所以反应为放热反应; 正确答案:放热;ΔH<0(或反应物的总能量大于生成物的总能量); ②第一步的热化学方程式为NH4+(aq)+3/2O2(g)═NO2-(aq)+2H+(aq)+H2O(l) △H=-273kJ/mol,第二步的热化学方程式为:NO2-(aq)+1/2O2(g)═NO3-(aq) △H=-73kJ/mol,根据盖斯定律则NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq) △H=-346kJ/mol; 正确答案:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1。 (2)①P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1 ②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2 ②-①得到反应:4P(红磷,s)=P4(白磷,s) △H=△H2-△H1,红磷比白磷稳定,说明红磷的能量低于白磷,该反应是吸热反应,即△H2-△H1>0,即△H2>△H1; 正确答案:<。 (3) ①2H2O(g)=O2(g)+2H2(g) ΔH1; ②Cl2(g)+H2(g)=2HCl(g) ΔH2; ③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3,则反应③=①+2×②,△H3=△H1+2△H2; 正确答案:A。 (4)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol ②Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g) ΔH=-226 kJ·mol-1 根据盖斯定律,②×2+①可得:2CO(g)+2Na2O2(s)=2Na2CO3(s) △H=-1018kJ/mol,CO(g)与Na2O2(s)反应放出509kJ热量时,参加反应CO为2mol×5091018=1mol,反应的电子转移数为2mol,即电子转移数为2NA(或1.204×1024) 正确答案:2NA(或1.204×1024) (5)H2(g)+Br2(l)=2HBr(g)△H=-72kJ/mol,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,则H2(g)+Br2(g)=2HBr(g)△H=-102kJ/mol,△H=反应物总键能-生成物总键能,则有-102kJ/mol=436kJ/mol+200kJ/mol-2akJ/mol,解得a=369;. 正确答案:369。 20.② 285 kJ•mol-1 1 425 kJ CO(g)+12O2(g)=CO2(g)ΔH=﹣283.1 kJ•mol-1 +43.2 kJ•mol-1 【解析】 (1)上述反应中只有②的焓变大于零,属于吸热反应; 正确答案:②。 (2)2H2(g)+O2(g)=2H2O(l)ΔH=﹣570 kJ·mol-1,根据燃烧热的定义,燃烧热为570 kJ·mol-1/2=285kJ·mol-1; 正确答案:285kJ·mol-1。 (3)n(H2)=10g2g/mol=5mol,根据热化学方程式: 2H2(g)+O2(g)=2H2O(l)ΔH=﹣570 kJ• 2mol 570kJ 5mol Q Q=570kJ×5mol2mol=1425 kJ ,燃烧10 g H2生成液态水,放出的热量为1425 kJ; 正确答案:1425 kJ。 (4)2C(s)+O2(g)=2CO(g)ΔH=﹣220.8kJ·mol-1 ③ C(s)+O2(g)=CO2(g)ΔH=﹣393.5kJ·mol-1 ④ 根据盖斯定律④-③×1/2得CO(g)+12O2(g)=CO2(g)ΔH=﹣283.1 kJ•mol-1; 正确答案:CO(g)+12O2(g)=CO2(g)ΔH=﹣283.1 kJ•mol-1。 (5)2H2(g)+O2(g)=2H2O(l)ΔH=﹣570 kJ·mol-1 ① 2H2O(g)=2H2(g)+O2(g)ΔH=+483.6 kJ·mol-1 ② 根据盖斯定律(①+ ②)/2得,H2O(g)=H2O(l)ΔH=-43.2 kJ•mol-1,则H2O(l)=H2O(g)ΔH=+43.2 kJ•mol-1; 正确答案:+43.2 kJ•mol-1。查看更多