- 2021-05-22 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学真题分类汇编考点14碱和碱的化学性质含答案
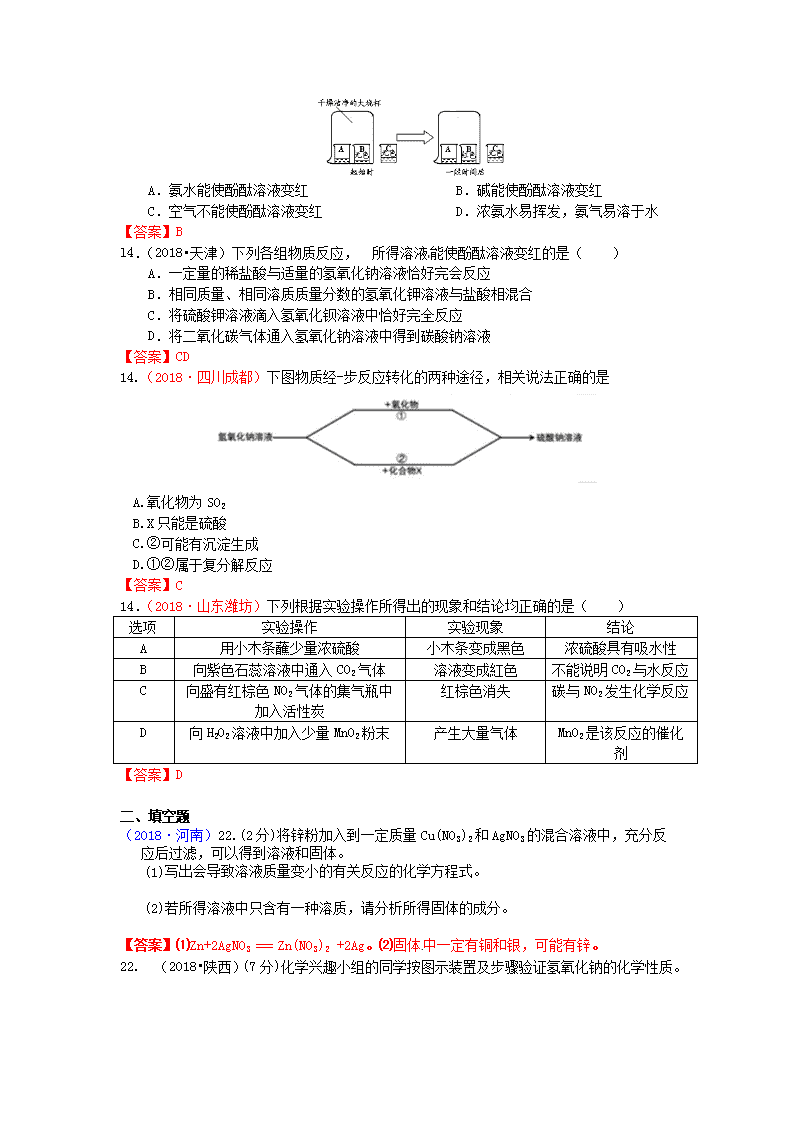
考点14 碱和碱的化学性质 一、选择题 14.(2018·广西北部湾)下列有关氢氧化钠的说法,错误的是( ) A.氢氧化钠俗称烧碱 B.氢氧化钠有强烈的腐蚀性 C.氢氧化钠固体可用于干燥二氧化碳气体 D.氢氧化钠可用于制肥皂、洗涤剂、造纸、纺织工业等 【答案】C (2018·江苏无锡)5.性质决定用途,以下物质的用途与其化学性质有关的是( ) A.生石灰作食品干燥剂 B.石墨用于制铅笔芯 C.钨用于制白炽灯灯丝 D.干冰用于人工降雨 【答案】A 2.(2018·内蒙古包头)分类法是学习和研究物质的一种重要方法,下列分类正确的是 A.生铁、黄金、金刚石——合金 B.纯碱、烧碱、熟石灰——碱 C.氮气、红磷、铝—— 单质 D.水、干冰、氯酸钾——氧化物 【答案】C 8. (2018·山东菏泽)类比推理在化学学习和科学研究中有重要意义,下列说法正确的是 A.化合物中含不同种元素,所以含不同种元素的物质都是化合物 B.CO2和SO2都能与碱溶液反应,所以非金属氧化物一定能与碱溶液反应 C.碱的溶液显碱性,显碱性的溶液一定是碱溶液 D.同种元素的原子所含质子数相同,含有相同质子数的微粒不一定属于同种元素 【答案】D 15.(2018·山东烟台)某露置于空气中的CaO固体,测得其中Ca元素质量分数为50%,取10g该CaO固体样品,向其中加入足量稀盐酸使其完全溶解。正确的说法是( ) A.加入稀盐酸后一定没有气泡产生 B.该CaO样品的成分可能是CaO和Ca(OH)2 C.生成CaCl2的质量为11.1g D.该CaO样品的成分可能是Ca(OH)2和CaCO3 【答案】D (2018·内蒙古呼和浩特)10.实验室中同学们进行了如下图所示实验,成功探究出了久置氢氧化钠固体的变质情况。下列说法正确的是 A.甲溶液可以选择稀盐酸或CaCl2溶液(查阅资料得知:CaCl2溶液显中性) B.若Ⅱ、Ⅲ均有明显现象,则说明样品部分变质 C.D物质可能是气体,也可能是沉淀 D.溶液B中的溶质一定只含有NaOH和甲 【答案】B (2018·广西桂林)11. 氢氧化钠的俗名是( ) A.烧碱 B.苏打 C.小苏打 D.熟石灰 【答案】A (2018·湖北江汉)“苛性钠、烧碱、纯碱、火碱”四种俗称中所代表的物质只有 A.1种 B.2种 C.3种 D.4种 【答案】B 12. (2018•黑龙江齐齐哈尔)推理是化学学习中常用的思维方法,下列推理正确的是 A.碱性溶液能使无色酚酞溶液变红,所以使无色酚酞溶液变红的溶液一定呈碱性 B.氯化钠、硫酸铜等盐中都含有金属元素,所以盐中一定都含有金属元素 C.离子是带电的粒子,所以带电的粒子一定是离子 D.置换反应有单质和化合物生成,所以有单质和化合物生成的反应一定是置换反应 【答案】A 7、(2018·北京)下列物质能与NaOH反应的是( ) A.Fe B.CO2 C.Fe2O3 D.NaCl 【答案】B 3.(2018·湖北恩施)下列关于氢氧化钠的描述中错误的是( ) A.可用于改良酸性土壤 B.易溶于水,溶解时放出大量的热 C.能去除油污,可作炉具清洁剂 D.对皮肤有强烈的腐独作用 3.A8.(2018·湖北荆州)下列物质的用途与性质对应关系错误的是( ) A.熟石灰可用来改良酸性土壤﹣﹣熟石灰呈碱性 B.氮气常用作保护气﹣﹣氮气化学性质不活泼 C.铁粉可做食品保鲜剂﹣﹣铁粉可以和空气中的氧气和水反应 D.金刚石能裁玻璃﹣﹣金刚石是硬度最大的金属 【答案】D 18.(2018·广东广州)下列有关氢氧化钾的说法正确的是 A.氢氧化钾固体露置在空气中易变质 B.氢氧化钾溶液能使石蕊溶液变红 C.氢氧化钾溶液与氧化铜反应生成蓝色沉淀 D.2mL氢氧化钾溶液与1mL硫酸溶液恰好完全反应 【答案】A 9.(2018·广东广州)下列物质属于碱的是 A. H2O B. NaHCO3 C.Ca(OH)2 D.H3BO3 【答案】C (2018·重庆B)10.氢氧化钠离液和氨水都能使酚酞溶液变红,其原因是二者的溶液中均含有义种相同的粒子是( ) A.H+ B.OH- C.H2O D.H 【答案】B 11.(2018•四川乐山) A、B、C三只小烧杯内分别依次盛有一定体积的浓氨水、酚酞溶液、酚酞溶液,按下图所示进行探究活动,不能得到的结论是( ) A.氨水能使酚酞溶液变红 B.碱能使酚酞溶液变红 C.空气不能使酚酞溶液变红 D.浓氨水易挥发,氨气易溶于水 【答案】B l4.(2018•天津)下列各组物质反应, 所得溶液能使酚酞溶液变红的是( ) A.一定量的稀盐酸与适量的氢氧化钠溶液恰好完会反应 B.相同质量、相同溶质质量分数的氢氧化钾溶液与盐酸相混合 C.将硫酸钾溶液滴入氢氧化钡溶液中恰好完全反应 D.将二氧化碳气体通入氢氧化钠溶液中得到碳酸钠溶液 【答案】CD 14.(2018·四川成都)下图物质经-步反应转化的两种途径,相关说法正确的是 A.氧化物为SO2 B.X只能是硫酸 C.②可能有沉淀生成 D.①②属于复分解反应 【答案】C 14.(2018·山东潍坊)下列根据实验操作所得出的现象和结论均正确的是( ) 选项 实验操作 实验现象 结论 A 用小木条蘸少量浓硫酸 小木条变成黑色 浓硫酸具有吸水性 B 向紫色石蕊溶液中通入CO2气体 溶液变成紅色 不能说明CO2与水反应 C 向盛有红棕色NO2气体的集气瓶中加入活性炭 红棕色消失 碳与NO2发生化学反应 D 向H2O2溶液中加入少量MnO2粉末 产生大量气体 MnO2是该反应的催化剂 【答案】D 二、填空题 (2018·河南)22.(2分)将锌粉加入到一定质量Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,可以得到溶液和固体。 (1)写出会导致溶液质量变小的有关反应的化学方程式。 (2)若所得溶液中只含有一种溶质,请分析所得固体的成分。 【答案】⑴Zn+2AgNO3 === Zn(NO3)2 +2Ag。⑵固体中一定有铜和银,可能有锌。 22. (2018•陕西)(7分)化学兴趣小组的同学按图示装置及步骤验证氢氧化钠的化学性质。 【实验步骤】 I.将注射器内的液体注入A中的锥形瓶。 II.打开K,观察到C中部分红色溶液沿导管倒吸入A,片刻后回流停止。 III.打开K2,观察到B中溶液倒吸入A、C中,液面稳定后观察到A中溶液仍为红色,C中溶液变为无色。 同学们对相关问题分组展开如下探究。 探究环节 甲组的探究 乙组的探究 [提出问题] A中使酚酞变为红色的物质是什么? C中溶液为什么变成无色? [做出猜想] 猜想一:Na2CO3 猜想二:Na2CO3和NaOH 猜想一:实验过程中酚酞变质了 猜想二:溶液中的NaOH反应完了 [实验验证] 小鹏取少量A中溶液于试管中,向其中滴加过量BaCl2溶液,若观察到______,证明猜想二成立。小丽认为用Ba(OH)2溶液也可证明猜想二成立,小鹏认为小丽的方案不合理,理由是_______。 (1)取少量C中溶液于试管中,向其中滴加NaOH溶液. 溶液又变为红色,证明猜想一不成立。 (2)用pH试纸测定C中溶液的酸碱度,若pH___7,证明猜想二成立。 【反思交流】(1)甲、乙两组同学的实验证明了NaOH能与稀盐酸、CO2发生反应;A中溶液里一定还存在NaCl。写出NaOH与CO2发生反应的化学方程式_________。 (2)[实验步骤]中的现象_____(填“能”或“不能”)证明NaOH与CO2发生了反应。 【拓展迁移】对于无明显现象的化学反应,可通过检验有新物质生成或检验_____的方法来证明反应发生了。 【答案】(甲组)生成白色沉淀,溶液仍为红色(溶液颜色无变化);向溶液中引入OH-,对NaOH的检验产生干扰。(乙组) ≤或<或= 【反思交流】(1)2NaOH +CO2= Na2CO3+H2O(未配平扣1分,化学式错误扣2分); (2)不能; 【拓展迁移】某种反应物消失(减少) (2018·贵州贵阳)12.(10分)某化学兴趣小组对酸、碱、盐的部分性质进行探究。 【探究一】氢氧化钠与二氧化碳反应 甲同学设计实验方案如图1所示 (1)实验现象为 ,甲同学由此判断氢氧化钠和二氧化碳发生了反应。 (2)小组内其他同学认为甲同学方案不完善,理由是 。 【探究二】氢氧化钠和盐酸发生中和反应时放出热量。 乙同学向一定量10%的氢氧化钠溶液中滴加10%的盐酸,滴加过程中温度变化如表 加入盐酸体积V/mL 2 4 6 8 10 12 14 16 18 20 混合溶液温度 T/℃ 15.2 19.6 22.0 26.0 28.2 26.7 25.7 24.7 23.7 22.9 (3)反应的化学方程式为 。 (4)根据表中数据分析混合溶液温度变化的原因 。 (5)小组内其他同学提出“将10%的盐酸直接滴入氢氧化钠固体中也能得出相同结论”,你认为是否合理并说明理由 。 (6)丙同学将甲同学和乙同学实验后的溶液混合,未发现明显现象。现将混合液中的氯化钠进行提纯,具体的操作为 。 【探究三】碳酸钠溶液与稀盐酸的分步反应 【查阅资料】向碳酸钠溶液中逐滴加入稀盐酸的反应是分步反应,第一步反应生成碳酸氢钠和氯化钠,当碳酸钠反应完后才发生第二步反应。 丁同学向106g质量分数为10%的碳酸钠溶液中逐滴加入质量分数为3.65%的稀盐酸,生成二氧化碳的质量变化如图2所示(不考虑CO2的溶解)。 (7)A→C段发生反应的化学方程式为 。 (8)若B点横坐标为150,则其纵坐标为 。 【答案】试管内液面上升;二氧化碳能溶于水;HCl+NaOH═NaCl+H2O;氢氧化钠与稀盐酸反应放出大量的热,故溶液溶液升高;过量盐酸起冷却降温作用,反应停止热量散失,故后逐渐下降;不合理,氢氧化钠固体溶于水放热;向混合溶液中加入适量的盐酸,调节溶液呈中性,然后对混合液进行蒸发结晶,过滤、洗涤、干燥;NaHCO3+HCl=NaCl+H2O+CO2↑;2.2; 21.(2018·吉林长春)为验证Ba(OH)2的化学性质做如图所示的四个实验: (1)实验一中能够观察到的明显现象是 ; (2)实验二、三验证了Ba(OH)2能和某些 (填物质类别)发生化学反应; (3)实验四中发生反应的化学方程式为 ; (4)讲上述实验后四支试管中的所有物质倒入同一个烧杯,充分混合后过滤,得到白色固体和溶液A。取一定量溶液A,加入少量Ba(OH)2溶液,振荡后只得到无色溶液,综上分析,溶液A中除酚酞外,一定还含有的溶质是 。 【答案】(1)溶液由无色变成红色 (2)盐 (3)Ba(OH)2+2HCl=BaCl2+2H2O (4)HCl、NaCl 19. (2018·江苏泰州) 为探究CO2与NaOH溶液发生的反应,某兴趣小组尝试用不同的方式进行实验。 【查阅资料】 Ⅰ.20℃时,几种物质在水中的溶解度见下表: 物质 Na2CO3 NaHCO3 Ca(OH)2 Ba(OH)2 溶解度/g 21.5 9.6 0.165 3.89 Ⅱ.本实验条件下,Na2CO3溶液和NaHCO3溶液的pH分别约为11.0和8.5。 【实验探究】 (1)实验一:小雨取一充满CO2的矿泉水瓶,加入一定量的水,立即拧紧瓶盖,振荡,发现瓶子变瘪,小雨另取一相同的充满CO2的矿泉水瓶,向其中加入与水等体积的NaOH溶液,立即拧紧瓶盖,振荡,得到溶液X,此时观察到的现象是_________________________________,实验中,小雨采用两只矿泉水瓶做对比实验的目的是_________________________________。 (2)实验二:为检验CO2与NaOH溶液反应的产物,小亮取实验一所得溶液X少许,向其中滴加BaCl2溶液,有白色沉淀产生,该反应的化学方程式为_____________________________,实验中不宜将BaCl2溶液换成CaCl2溶液的原因是_____________________________________。 (3)实验三:小华取实验一所得溶液X少许,向其中加入过量的BaCl2溶液,振荡,静置,取上层清液,滴入1滴酚酞试液,发现溶液呈____色,证明溶液X中有NaOH剩余。实验中,小华没有直接向少量溶液X中滴入酚酞试液,理由是___________________________________。 (4)实验四:兴趣小组将CO2持续通入一定浓度一定量的NaOH溶液中,用数字化实验技术测定反应过程中溶液的pH和温度变化,结果如图1、图2所示。 图1中,BC段发生反应的化学方程式为____________________________________。 图2中,DE段温度变化的原因是__________________________________________。 【反思感悟】 (5)实验从CO2减少、NaOH减少,Na2CO3生成等物质的变化,以及___________转化等视角多维度探究CO2与NaOH发生了反应,对于现象不明显的化学反应,可以通过现代技术手段进行数据测定,实现反应过程的“可视化”。 【答案】 (1). 瓶子变瘪,且比装水的更瘪 (2). 证明二氧化碳与氢氧化钠溶液反应 (3). BaCl2+Na2CO3=BaCO3↓+2NaCl (4). 氯化钙溶液与氢氧化钠溶液也会生成微溶的氢氧化钙 (5). 红 (6). 碳酸钠溶液显碱性,也能使酚酞变红 (7). Na2CO3+H2O+CO2=2NaHCO3 (8). 二氧化碳与氢氧化钠溶液反应放热 (9). 能量 17.(2018·四川成都)(8分)根据实验回答: (1)图1实验,用药匙的柄把端挑起一点氢氧化钙粉末于试管中,依次进行实验。观察到现象为:浑浊变红红色消失。 根据现象判断氢氧化钙的性质有 、 (物理和化学性质,各填一条) (2)按图1实验完毕,所得溶液中除酚酞外一定有的溶质是 ,可能有的溶质是 。 (3)图2装置气密性良好。取0.5g碳酸氢钠于甲中,加入2mL盐酸, (填操作),并将导管伸入澄清石灰水中,观察到出现浑浊。乙中反应的化学方程式为 。 (4)图2中甲作为发生装置还可制得的气体是 (填一种) 【答案】(1)微溶于水,能与稀盐酸反应(答案合理即可)(2)CaCl2 HCl (3)塞紧橡皮塞 Ca(OH)2+CO2=CaCO3↓+H2O(4)H2(或O2) (2018·四川巴中)54.(5分)小明在实验室发现一瓶未密封的KOH固体,对其成分进行实验探究 【查阅资料】:①KOH与NaOH的化学性质相似,请用化学方程式解释KOH变质的原因是 。 ② K2CO3溶液呈碱性,CaCl2溶液、KCl溶液呈中性。 【猜想假设】:假设I:只含KOH;只含II:含KOH和K2CO3;假设III只含K2CO3。 【进行实验】 实验操作步骤 实验现象 实验结论 ①取少量样品于试管中,加入足量的稀盐酸 有气泡产生 假设 不正确 ②另取少量样品于试管中,加水溶解,加入过量的BaCl2溶液,振荡,静置 假设Ⅲ正确 ③取②中上层清液,滴加无色酚酞溶液 【拓展应用】:完全变质的KOH也有利用价值,从K2CO3组成或性质看,这瓶变质的试剂在农业上的用途是 。 【答案】【查阅资料】①2KOH+CO2= K2CO3+H2O。【进行实验】① I;②产生沉淀; ③不变红;【拓展应用】钾肥。 28. (2018·浙江衢州)为探究一瓶久置的氢氧化钠固体样品是否全部变质,小柯取少量样品配制成溶液,再取少量溶液分别装入两支试管中,进行了如甲、乙两图所示实验。(注:BaCl2溶液呈中性) (1)小柯认为“甲图实验说明了氢氧化钠固体部分变质”。你认为小柯的观点是否正确,并说明理由____________。 (2)分析乙图实验的现象,可以确定样品的变质情况为________。 (3)进一步探究:另取少量样品溶液,加入一定质量分数的稀盐酸,直至过量。请在丙图中面出“生成CO2的质量随加入稀盐酸质量变化”的大致图像_______。 【答案】(1)不正确,无论氢氧化的是否全部变质,都能让无色酚酞变红色 (2)部分变质 (3)(如图所示) (2018·贵州安顺)13、(8分)氢化钙固体是登山运动员常用的能源提供剂。某探究小组的同学通过查阅资料得知:氢化钙(CaH2)遇水反应生成氢氧化钙和氢气。探究小组的同学把一定量的CaH2 加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。 【提出问题】滤液中溶质的成分是什么? 【猜想与假设】 猜想一:NaOH 猜想二:NaOH、Ca(OH)2 猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2 经过讨论,大家一致主为猜想四不合理,请用化学方程式说明原因 。 【实验验证】 实验 现象 结论 ⑴取少量滤液,向其中滴入少量碳酸钠溶液 无明显现象 猜想 不成立。 ⑵另取少量滤液,向其中加入足量稀盐酸 猜想三成立。 【反思与拓展】 (1)写出氢化钙(CaH2)与水反应的化学方程式 。 (2)若向NH4Cl的溶液中加入一定量的CaH2,充分反应,产生的气体有氢气和 。 (3)登山运动员携带CaH2作为能源提供剂与携带氢气相比,其优点是 (写一条即可)。 【答案】【猜想与假设】Na2CO3+ Ca(OH)2 ===2NaOH+CaCO3↓。【实验验证】⑴二;⑵有气泡产生;【反思与拓展】⑴CaH2+ 2H2O =Ca(OH)2+2H2↑;⑵氨气;⑶携带安全或携带方便。 31.(2018·浙江绍兴)实验室有甲乙两瓶久置的氢氧化钠固体,某学习小组为了研究其变质情况,进行了如下实验: (电子秤示数单位为克) (1)滴入紫色石蕊试液后溶液为红色,说明反应后溶液呈____性。 (2)上述实验中产生的二氧化碳气体质量为______克。 (3)计算甲瓶固体样品中碳酸钠的质量分数。 (4)某同学另取10克乙瓶中的固体样品,用100克15%的稀硫酸铵同样方法进行实验,他认为不管固体样品变质程度如何,稀硫酸加入后,都不需要使用石蕊试液,请计算说明他做出此判断的原因。 【答案】.(1)酸 (2)2.2 (3)53% (4)用100g15%的稀硫酸进行实验,稀硫酸一定过量,故稀硫酸加入后不需要加石蕊试液。 三、实验题查看更多