- 2021-05-22 发布 |
- 37.5 KB |
- 9页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
新高考总复习 化学实验热点物质的制备doc
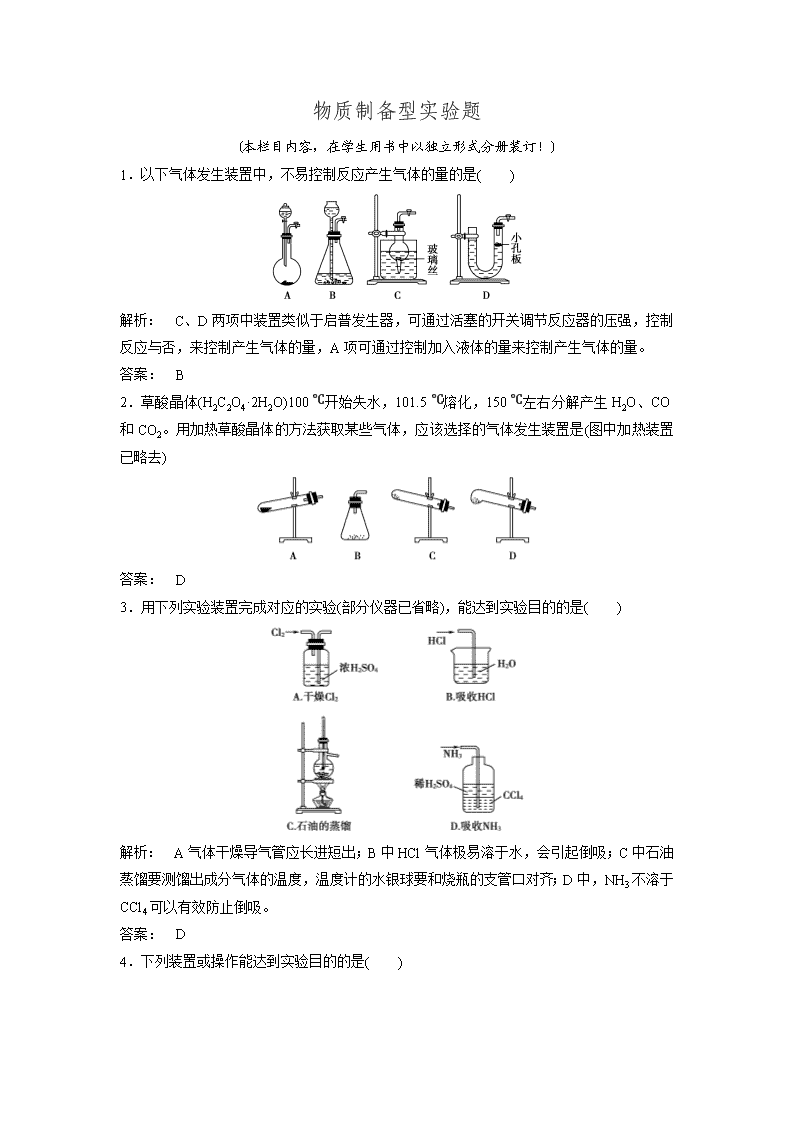
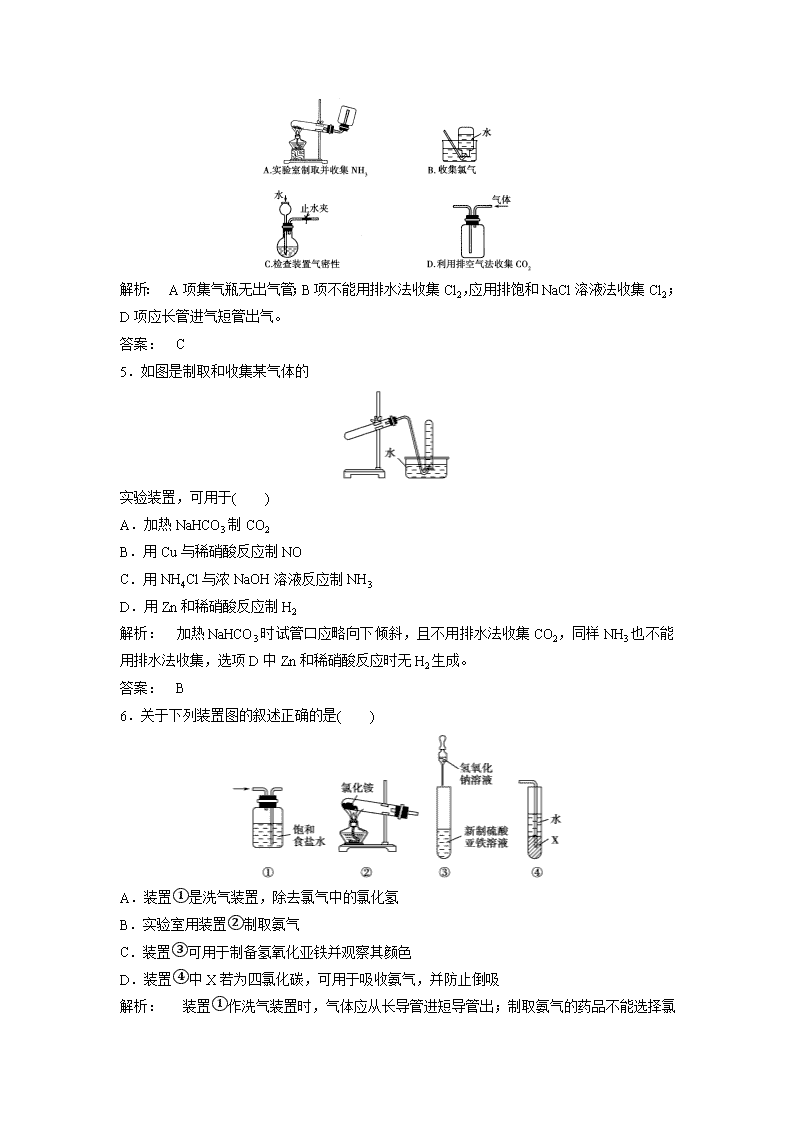
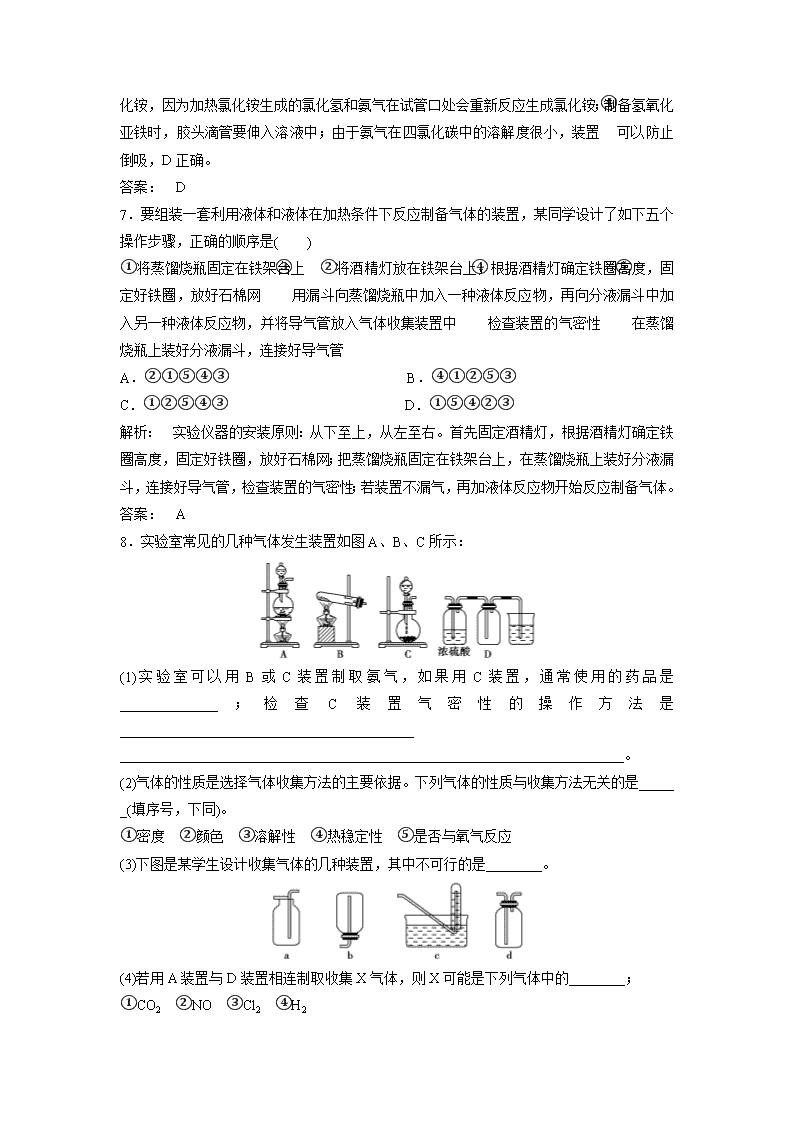
物质制备型实验题 (本栏目内容,在学生用书中以独立形式分册装订!) 1.以下气体发生装置中,不易控制反应产生气体的量的是( ) 解析: C、D两项中装置类似于启普发生器,可通过活塞的开关调节反应器的压强,控制反应与否,来控制产生气体的量,A项可通过控制加入液体的量来控制产生气体的量。 答案: B 2.草酸晶体(H2C2O4·2H2O)100 ℃开始失水,101.5 ℃熔化,150 ℃左右分解产生H2O、CO和CO2。用加热草酸晶体的方法获取某些气体,应该选择的气体发生装置是(图中加热装置已略去) 答案: D 3.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( ) 解析: A气体干燥导气管应长进短出;B中HCl气体极易溶于水,会引起倒吸;C中石油蒸馏要测馏出成分气体的温度,温度计的水银球要和烧瓶的支管口对齐;D中,NH3不溶于CCl4可以有效防止倒吸。 答案: D 4.下列装置或操作能达到实验目的的是( ) 解析: A项集气瓶无出气管;B项不能用排水法收集Cl2,应用排饱和NaCl溶液法收集Cl2;D项应长管进气短管出气。 答案: C 5.如图是制取和收集某气体的 实验装置,可用于( ) A.加热NaHCO3制CO2 B.用Cu与稀硝酸反应制NO C.用NH4Cl与浓NaOH溶液反应制NH3 D.用Zn和稀硝酸反应制H2 解析: 加热NaHCO3时试管口应略向下倾斜,且不用排水法收集CO2,同样NH3也不能用排水法收集,选项D中Zn和稀硝酸反应时无H2生成。 答案: B 6.关于下列装置图的叙述正确的是( ) A.装置①是洗气装置,除去氯气中的氯化氢 B.实验室用装置②制取氨气 C.装置③可用于制备氢氧化亚铁并观察其颜色 D.装置④中X若为四氯化碳,可用于吸收氨气,并防止倒吸 解析: 装置①作洗气装置时,气体应从长导管进短导管出;制取氨气的药品不能选择氯化铵,因为加热氯化铵生成的氯化氢和氨气在试管口处会重新反应生成氯化铵;制备氢氧化亚铁时,胶头滴管要伸入溶液中;由于氨气在四氯化碳中的溶解度很小,装置④可以防止倒吸,D正确。 答案: D 7.要组装一套利用液体和液体在加热条件下反应制备气体的装置,某同学设计了如下五个操作步骤,正确的顺序是( ) ①将蒸馏烧瓶固定在铁架台上 ②将酒精灯放在铁架台上,根据酒精灯确定铁圈高度,固定好铁圈,放好石棉网 ③用漏斗向蒸馏烧瓶中加入一种液体反应物,再向分液漏斗中加入另一种液体反应物,并将导气管放入气体收集装置中 ④检查装置的气密性 ⑤在蒸馏烧瓶上装好分液漏斗,连接好导气管 A.②①⑤④③ B.④①②⑤③ C.①②⑤④③ D.①⑤④②③ 解析: 实验仪器的安装原则:从下至上,从左至右。首先固定酒精灯,根据酒精灯确定铁圈高度,固定好铁圈,放好石棉网;把蒸馏烧瓶固定在铁架台上,在蒸馏烧瓶上装好分液漏斗,连接好导气管,检查装置的气密性;若装置不漏气,再加液体反应物开始反应制备气体。 答案: A 8.实验室常见的几种气体发生装置如图A、B、C所示: (1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是______________;检查C装置气密性的操作方法是__________________________________________ ________________________________________________________________________。 (2)气体的性质是选择气体收集方法的主要依据。下列气体的性质与收集方法无关的是_____ _(填序号,下同)。 ①密度 ②颜色 ③溶解性 ④热稳定性 ⑤是否与氧气反应 (3)下图是某学生设计收集气体的几种装置,其中不可行的是________。 (4)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的________; ①CO2 ②NO ③Cl2 ④H2 其中在D装置中连接小烧杯的目的是_____________________________________。 解析: (1)采用B装置制取氨气时应选用消石灰和氯化铵固体;C装置适用于固体与液体不需要加热的反应,故应选用浓氨水和氧化钙(或碱石灰、固体氢氧化钠等)。检查C装置气密性的操作是连接一根导管,将导管通入水槽中,用手捂或酒精灯微热圆底烧瓶底部,如果导管口处有气泡产生,松开手或停止加热后,在导管里形成一段水柱,则说明C装置气密性良好。 (2)选择气体收集方法,无需考虑气体的颜色和热稳定性,根据密度和是否与氧气反应选择能否采用向上或向下排空气法,根据溶解性判断能否选择排水或排其他液体的方法。 (3)收集气体时不应采取b、c装置,前者密闭不能排出空气,后者伸入试管内的导管过长。 (4)制取CO2时不需加热,也不必处理尾气;NO常温下与氧气反应,不能用排空气法收集;制取H2时不需加热,应采用向下排空气法,尾气处理时一般用点燃的方法,故X可能是氯气。D装置中的小烧杯用来吸收尾气,防止污染空气。 答案: (1)浓氨水和氧化钙(或碱石灰、固体氢氧化钠等) 连接一根导管,将导管通入水槽中,用手捂或酒精灯微热圆底烧瓶底部,如果导管口处有气泡产生,松开手或停止加热后,在导管里形成一段水柱,说明C装置气密性良好 (2)②④ (3)b、c (4)③ 吸收尾气,防止污染空气 9.(1)同一种制备装置可用于制取不同的气体,若用如图装置制取以下气体。 ①请在下表空格中填上所需药品。 所制气体 药品 分液漏斗内 烧瓶中 O2 MnO2 H2 稀H2SO4 NH3 CaO NO 稀HNO3 Cu CO2 稀H2SO4 石灰石 ②写出表中药品制备O2的化学方程式______________________________________。 ③请画出干燥NH3的装置图,并注明干燥剂和气体流向________________________。 ④表中给全药品的项目中,不能用于制备相应气体的有(可不填满) 气体 理由 (2)下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体)。 请回答下列问题: ①能用作干燥氨气的装置有__________(填字母); ②既能用于收集氯气又能用于收集一氧化氮气体的装置有________(填字母); ③若用C装置作二氧化硫与烧杯中氢氧化钠溶液反应的实验,则其中广口瓶的作用是_____ _______________________________________________________________。 答案: (1)①H2O2 锌粒 浓氨水 ②2H2O22H2O+O2↑ ③ CO2 ④稀硫酸与石灰石反应生成CaSO4微溶,覆盖于石灰石表面,阻止了稀硫酸与石灰石的进一步反应 (2)①D、E ②A、B ③防止倒吸或起安全瓶作用 10.实验室欲制取少量NaHCO3与NH4Cl。实验步骤如下: 请回答: (1)步骤Ⅰ、Ⅲ中需用到氨气,下列装置可用于实验室制氨气的是________。(填序号) (2)步骤Ⅰ中发生反应的化学方程式是___________________________________。 若用图甲装置进行该沉淀反应。实验时,须先从______________(填“a”、“b”或“c”)管通入__________。 (3)有人设计了如图乙所示的装置来验证步骤Ⅲ所得的晶体中含有NH。具体操作是取少量晶体于硬质试管中,对晶体部位加热。并在______(填“A”或“B”)处放置____________试纸,观察现象。 解析: (1)a中NH4Cl受热分解生成的HCl和NH3在试管口遇冷又重新生成NH4Cl,碱石灰起不到吸收HCl的作用。c中反应装置试管口应略向下倾斜。(2)实验时应先通入NH3再通入CO2,NH3极易溶于水,故应从a管通入。(3)由于NH3的密度比空气小,因此应把试纸放在硬质试管的上口。 答案: (1)bd (2)NaCl+CO2+NH3+H2O===NaHCO3↓+NH4Cl a NH3 (3)A 湿润的红色石蕊试纸或湿润的酚酞试纸 11.根据候德榜提出的工艺,制碱厂设计的生产流程如图。 (1)该流程中可循环利用的物质是________。向母液中通氨气,并加入细小食盐颗粒,冷却析出副产品,通氨气的作用有________。 A.增大NH的浓度,使NH4Cl更多地析出 B.使NaHCO3更多地析出 C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度 (2)检验产品纯碱中是否含有NaCl的试剂是________。 (3)某学习小组在实验室模拟制碱有关工艺。 ①若利用氯化铵和熟石灰制取氨气,反应方程式是____________________________,制得的氨气可用下列盛有NaCl溶液的 ________装置吸收。 ②已知用饱和NaNO2与NH4Cl溶液加热可制取氮气。该小组模拟工业合成氨设计如下装置: 仪器a的名称是________;氢气的发生装置应选用________;A装置加热片刻后,应移去酒精灯以防反应物冲出,其原因是________________________________________。 D装置的作用是A.除去N2、H2中的水;B.______________;C.观察并调节气泡速率,控制N2、H2的比例。有同学认为:从氨合成器(E装置)中出来的气体连续通入F装置的NaCl溶液中,可能会发生倒吸。你认为是否可能并说明理由_________________________ ________________________________________________________________________。 解析: (1)从煅烧炉得到碳酸钠的同时有CO2生成,CO2又回到沉淀池,可循环利用;从沉淀池出来的母液提取副产品之后剩余的成分主要为氯化钠,也可循环利用。母液中含氯化铵,通氨气和加入细小食盐颗粒,可增加溶液中铵根离子和氯离子浓度,有利于NH4Cl更多地析出;氨水显碱性,与NaHCO3反应,使其转化为Na2CO3,防止NaHCO3析出,利于提高NH4Cl纯度。(2)由于CO对Cl-的检验会造成干扰,可先加入硝酸,除去CO,再加入AgNO3溶液,所以检验产品纯碱中是否含有NaCl的试剂是AgNO3溶液、HNO3溶液。 (3)①实验室制氨气的反应需加热,氨气极易溶于水,b装置可防止倒吸。②仪器a有支管,是蒸馏烧瓶;氢气的发生装置应选用B不选C,因为C中的长颈漏斗未插入到隔板下;A装置反应后即移去酒精灯,反应继续进行,说明该反应放热;D装置的另一个作用是使气体混合均匀;合成氨的反应是可逆反应,所得气体中含较多氮气、氢气,不会发生倒吸。 答案: (1)CO2、NaCl(溶液) AC (2)AgNO3溶液、HNO3溶液 (3)①2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O b ②蒸馏烧瓶 B 该反应放热,不需持续加热 使N2、H2混合均匀 否 该反应生成的氨气中含有大量难溶于水的N2和H2,氨气溶于水后气压降低不是很大 12.某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去)。 请回答下列问题: (1)该实验中,液体是分批加入的。 将乙醇、乙酸和浓硫酸加入三颈烧瓶中时,最先加入的液体不能是__________。 (2)水从冷凝管的________(填“a”或“b”)处进入。 (3)已知下列数据: 乙醇 乙酸 乙酸乙酯 98%浓硫酸 熔点/℃ -117.3 16.6 -83.6 — 沸点/℃ 78.5 117.9 77.5 338.0 又知温度高于140 ℃时发生副反应:2CH3CH2OH―→CH3CH2OCH2CH3+H2O。 ①该副反应属于________反应(填字母)。 a.加成 b.取代 c.酯化 ②考虑到反应速率等多种因素,用上述装置制备乙酸乙酯时,反应的最佳温度(T)范围是________(填字母)。 a.T<77.5 ℃ b.T>140 ℃ c.115 ℃查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档