- 2021-05-22 发布 |
- 37.5 KB |
- 46页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
选修四化学反应原理十一年高考题汇编
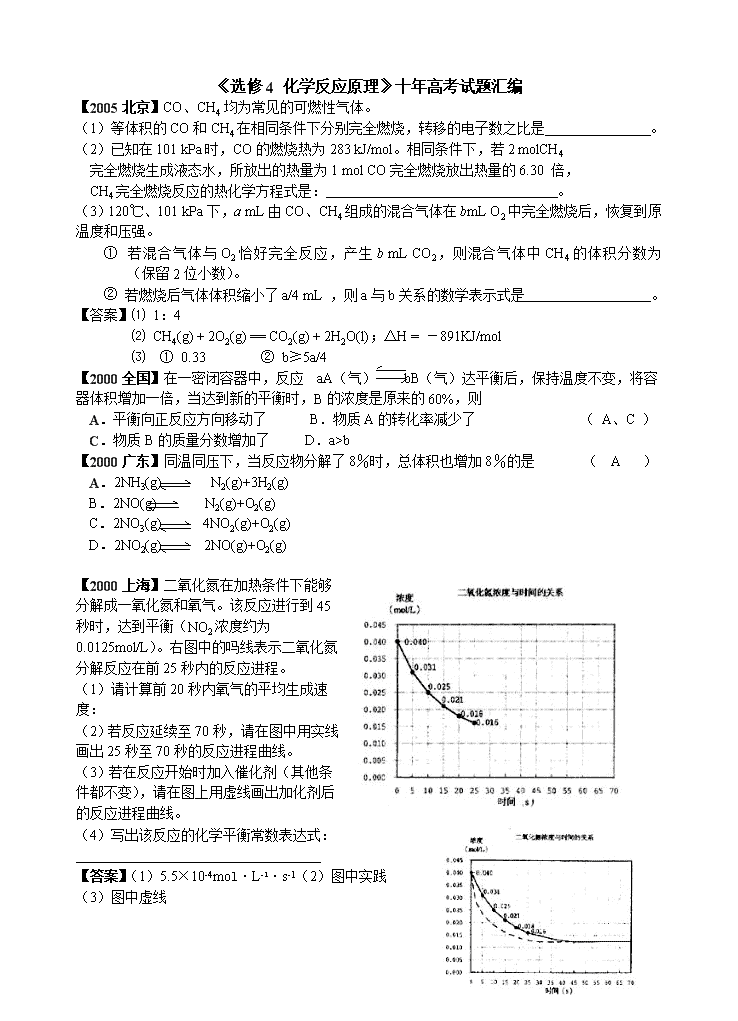
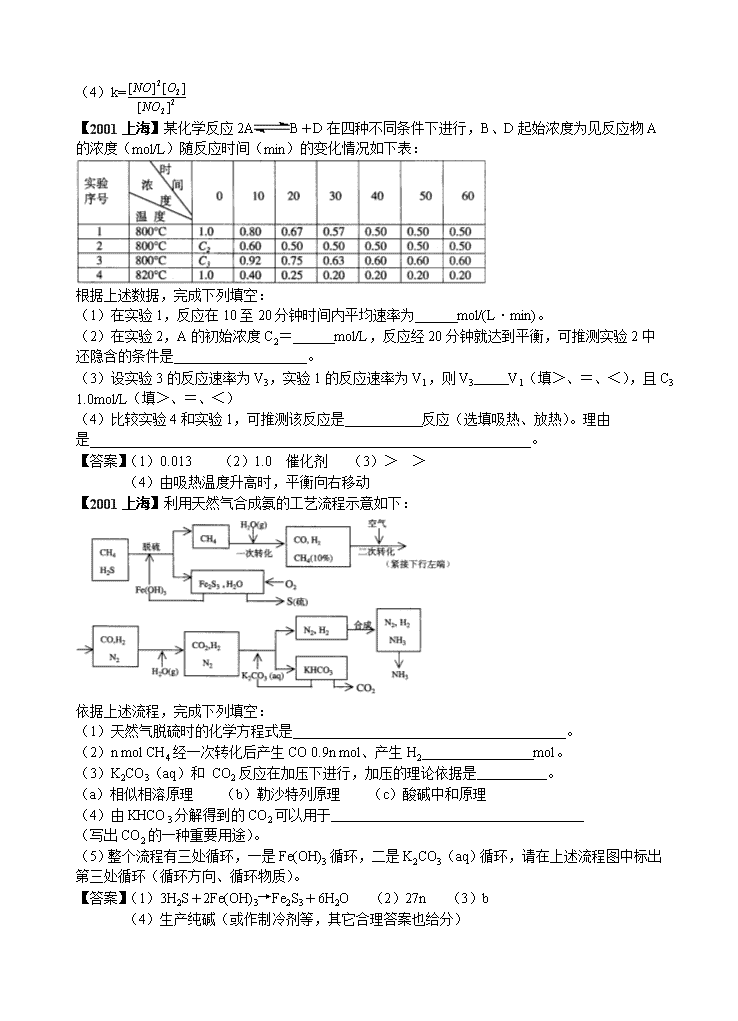
《选修4 化学反应原理》十年高考试题汇编 【2005北京】CO、CH4均为常见的可燃性气体。 (1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是 。 (2)已知在101 kPa时,CO的燃烧热为283 kJ/mol。相同条件下,若2 molCH4 完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30 倍, CH4完全燃烧反应的热化学方程式是: 。 (3)120℃、101 kPa下,a mL由CO、CH4组成的混合气体在bmL O2中完全燃烧后,恢复到原温度和压强。 ① 若混合气体与O2恰好完全反应,产生b mL CO2,则混合气体中CH4的体积分数为 (保留2位小数)。 ② 若燃烧后气体体积缩小了a/4 mL ,则a与b关系的数学表示式是 。 【答案】⑴ 1:4 ⑵ CH4(g) + 2O2(g) == CO2(g) + 2H2O(l);△H = -891KJ/mol ⑶ ① 0.33 ② b≥5a/4 【2000全国】在一密闭容器中,反应 aA(气) bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则 A.平衡向正反应方向移动了 B.物质A的转化率减少了 ( A、C ) C.物质B的质量分数增加了 D.a>b 【2000广东】同温同压下,当反应物分解了8%时,总体积也增加8%的是 ( A ) A.2NH3(g) N2(g)+3H2(g) B.2NO(g) N2(g)+O2(g) C.2NO3(g) 4NO2(g)+O2(g) D.2NO2(g) 2NO(g)+O2(g) 【2000上海】二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L)。右图中的吗线表示二氧化氮分解反应在前25秒内的反应进程。 (1)请计算前20秒内氧气的平均生成速度: (2)若反应延续至70秒,请在图中用实线画出25秒至70秒的反应进程曲线。 (3)若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加化剂后的反应进程曲线。 (4)写出该反应的化学平衡常数表达式:____________ 【答案】(1)5.5×10-4mol·L-1·s-1(2)图中实践 (3)图中虚线 (4)k= 【2001上海】某化学反应2AB+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表: 根据上述数据,完成下列填空: (1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。 (2)在实验2,A的初始浓度C2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。 (3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<),且C3 1.0mol/L(填>、=、<) (4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。理由是 。 【答案】(1)0.013 (2)1.0 催化剂 (3)> > (4)由吸热温度升高时,平衡向右移动 【2001上海】利用天然气合成氨的工艺流程示意如下: 依据上述流程,完成下列填空: (1)天然气脱硫时的化学方程式是 。 (2)n mol CH4经一次转化后产生CO 0.9n mol、产生H2 mol。 (3)K2CO3(aq)和 CO2反应在加压下进行,加压的理论依据是 。 (a)相似相溶原理 (b)勒沙特列原理 (c)酸碱中和原理 (4)由KHCO3分解得到的CO2可以用于 (写出CO2的一种重要用途)。 (5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。 【答案】(1)3H2S+2Fe(OH)3→Fe2S3+6H2O (2)27n (3)b (4)生产纯碱(或作制冷剂等,其它合理答案也给分) (5) 【2003江苏】I.恒温、恒压下,在一个可变容积的容器中发生如下发应: A(气)+B(气)C(气) (1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为 mol。 (2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。 (3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x= mol,y= mol。 平衡时,B的物质的量 (选填一个编号) (甲)大于2 mol (乙)等于2 mol (丙)小于2 mol (丁)可能大于、等于或小于2mol 作出此判断的理由是 。 (4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。 II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。 (5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比较 (选填一个编号)。 (甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小 作出此判断的理由是 。 【答案】(1)(1-a) (2)3a (3)2 3-3a 丁 若3a>1,B的物质的量小于2mol;若,B的物质的量等于2mol; 若3a<1,B的物质的量大于2mol (4) (5)乙 因为(5)小题中容器容积不变,而(1)小题中容器的容积缩小,所以(5)小题的容器中的压力小于(1)小题容器中的压力,有利于逆向反应,故反应达到平衡后a>b。 【2003上海】钾是—种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:Na(l)+KCl(l)NaCl(l)+K(g)一Q 该反应的平衡常数可表示为:K=C(K),各物质的沸点与压强的关系见下表。 (1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。 (2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是 。 (3)常压下,当反应温度升高900℃时,该反应的平衡常数可表示为:K= 【答案】(1)770℃ 890℃ (2)降低压强或移去钾蒸气 适当升高温度 (3)K=c(K)/c(Na) 【2004北京】在一定温度下,一定体积的密闭容器中有如下平衡: 已知H2和I2的起始浓度均为0.1mol·L-1时,达平衡时HI的浓度为0.16mol·L-1。若H2和I2的起始浓度均变为0.2mol·L-1,则平衡时H2的浓度(mol·L-1)是 ( C ) A.0.16 B.0.08 C.0.04 D.0.02 【2004理综】某温度下在密闭容器中发生如下反应: 2E(g) 若开始时只充入2mol E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2mol M和1mol N 的混合气体达平衡时M的转化率 A.20% B.40% C.60% D.80% ( C ) 【2004全国】恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应生成氨气: ⑴.若反应达平衡时某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值 ⑵.反应达平衡时,混合气体的体积为726.8L(标况下),其中NH3的含量(体积分数)为25%。计算平移时NH3的物质的量。 ⑶.原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) = 。 ⑷.原混合气体中,a∶b = 。 ⑸.达到平衡时,N2和H2的转化率之比,α(N2)∶α (H2)= 。 ⑹.平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。 【答案】⑴ a=16 ⑵n平(NH3) = 716.8L -1 ×25% = 32mol×25% = 8mol ⑶5∶4 ⑷2∶3 ⑸1∶2 ⑹ 3∶3∶2 【2004广东】在恒温时,一固定容积的容器内发生如下反应:2NO2(g) N2O4(g),达平衡是,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数 A.不变 B.增大 C.减小 D.无法判断 ( C ) 【2004广东】一定温度下,反应2SO2+O22SO3,达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物的量应是 A.0.4 mol B.0.6 mol C.0.8 mol D.1.2 mol ( A ) 【2004上海】在一定条件下,二氧化碳和氧气发生如下反应: 2SO2(g)+ O2 (g) 2SO3(g) (△H< 0) (1)写出该反应的化学平衡常数表达式 K=_______________。 (2)降低温度,该反应K值_______ ,二氧化碳转化率_______,化学反应速度_______(以上均填增大、减小或不变) (3)600℃时,在一密闭容器中,将二氧化碳和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是___________________________ 。 (4)据图判断,反应进行至20min时,曲线发生变化的原因是 __________________________________________(用文字表达) 10min到15min的曲线变化的原因可能是 __________________(填写编号)。 a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量 【答案】(1) (2)增大 增大 减小 (3)15—20min和25—30min (4)增加了O2的最 a b 0 x y 【2005广东】在一定条件下,固定容积的密闭容器中反应:2NO2(g) O2(g) + 2NO(g);ΔH>0, 达到平稳。当改变其中一个条件X,Y随X的变化符合图中曲线的是 ( AB ) A.当X表示温度时,Y表示NO2的物质的量 B.当X表示压强时,Y表示NO2的转化率 C.当X表示反应时间时,Y表示混合气体的密度 D.当X表示NO2的物质的量时,Y表示O2的物质的量 【2005全国】右图是温度和压强对X + Y 2Z 反应影响的示 意图。图中横坐标表示温度,纵坐标表示平衡混合气 体中Z的体积分数。下列叙述正确的是 ( C ) A.上述可逆反应的正反应为放热反应 B.X、Y、Z均为气态 C.X和Y中只有一种是气态,Z为气态 D.上述反应的逆反应的△H>0 【2005江苏】一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g) 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a %。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a %的是 ( A B ) A.2 mol C B.2 mol A、1 mol B和1 mol He(不参加反应) C.1 mol B和1 mol C D.2 mol A、3 mol B和3 mol C 【2005北京】在一定温度不同压强(P1<P2)下,可逆反应2X(g) 2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是 ( B ) 【05广东】、下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应: 323~353K 453~473K Ni(s) + 4CO(g) Ni(CO)4(g) 但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是 ( B ) A.纯Ni(s)和Ni(CO)4(g) B.纯Ni(s)和CO(g) C.不纯Ni(s)和CO(g) D.不纯Ni(s)和Ni(CO)4(g) 【05上海】在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g) + I2(g) ⇌ 2HI(g) + Q (Q>0),反应中各物质的浓度随时间变化情况如图1: (1)该反应的化学平衡常数表达式为 。 (2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为 。 (3)反应达到平衡后,第8分钟时: ①若升高温度,化学平衡常数K (填写增大、减小或不变)HI浓度的变化正确的是 (用图2中a-c的编号回答) ②若加入I2,H2浓度的变化正确的是 ,(用图2中d-f的编号回答) (4)反应达到平衡后,第8分钟时,若反容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况 【答案】(1)K = (2)0.167mol/L·min (3)① 减小 c ② f (4)见右图 【05广东】在密闭容器中,由一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如右图所示(己知气体的分压之比等于物质的量之比)。 温度/K 平 衡 体 系 的 分 压 /KPa 800 700 600 500 400 300 200 100 340 400 500 600 7000 800 900 1000 (1)420K时,发生反应的化学方程式为:____________________________;若反应中消耗l mol Xe,则转移电子______________mol。 (2)600~800K时,会发生反应:XeF6(g)XeF4(g)+ F2(g),其反应热△H _______0(填“>”“=”或“<”)。理由是_________________________ 。 (3)900K时,容器中存在的组分有_______________________________ 。 【答案】(1) Xe + 3 F2 === Xe F6 6 (2) > 随着温度的升高,Xe F6(g) Xe F4 (g) + F2 (g)平衡向右移动,根据温度升高平衡向吸热反应方向移动的原理,则该反应的ΔH>0。 (3) Xe F6 、Xe F4 、Xe F2 、Xe 、F2 【2006重庆】25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是 ( D ) A.C(s)+O2(g)=CO(g);△H =-393.5 kJ/mol B.2H2(g)+O2(g)=2H2O(g);△H =+571.6 kJ/mol C.CH4g)+2O2(g)=CO2(g)+2H2O(g);△H =-890.3 kJ/mol D.C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1 400 kJ/mol 【2006上海】(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_________________,K值大小与温度的关系是:温度升高,K值______________(填一定增大、一定减小、或可能增大也可能减小)。 (2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应: CO(g)十H2O(g) CO2(g)十H2 (g)十Q(Q>0) CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min) (3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。 ①表中3min—4min之间反应处于_________状态; C1数值_________0.08 mol/L (填大于、小于或等于)。 ②反应在4min—5min问,平衡向逆方向移动,可能的原因是________(单选), 表中5min—6min之间数值发生变化,可能的原因是__________(单选)。 a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度 【答案】 (1) 可逆反应的进行程度越大 可能增大也可能减小 (2) 0.03 (3) ①平衡 > ②d a 【2006四川】25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的PH=7时,下列关系正确的是 A.c(NH4+)==c(SO42-) B.c(NH4+)>c(SO42-) ( B ) C.c(NH4+)查看更多