- 2021-05-22 发布 |
- 37.5 KB |
- 22页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版中和滴定学案
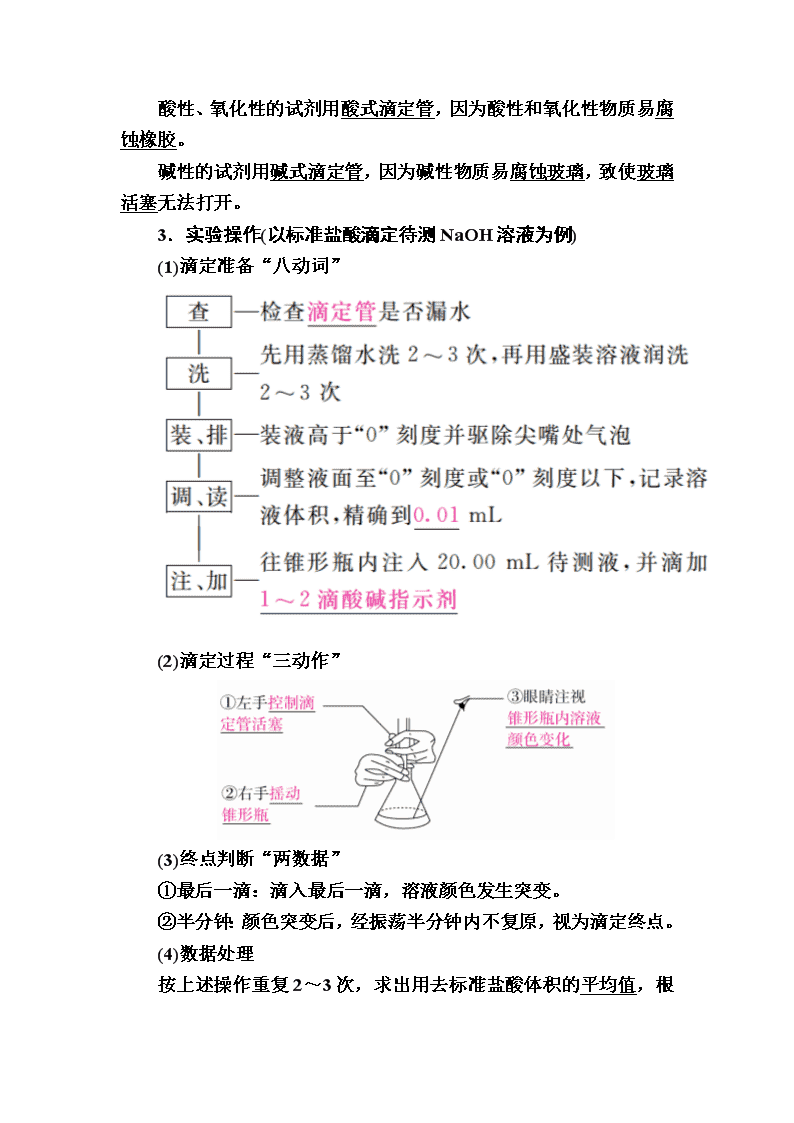
第28讲 中和滴定 1.实验原理 利用酸碱中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法。以标准盐酸溶液滴定待测的NaOH溶液,待测的NaOH溶液的物质的量浓度为c(NaOH)=。 酸碱中和滴定的关键: (1)准确测定参加反应的酸、碱溶液的体积。 (2)选取适当指示剂,准确判断滴定终点。 2.实验用品 (1)仪器:酸式滴定管(如图A)、碱式滴定管(如图B)、滴定管夹、铁架台、烧杯、锥形瓶。 (2)试剂:标准液、待测液、指示剂、蒸馏水。 (3)滴定管特征和使用要求 ①构造:“0”刻度线在上方,尖嘴部分无刻度。 ②精确度:读数可估计到0.01 mL。 ③洗涤:先用蒸馏水洗涤,再用待装液润洗2~3次。 ④排气泡:酸、碱式滴定管中的液体在滴定前均要排出尖嘴中的气泡。 ⑤滴定管的选用 酸性、氧化性的试剂用酸式滴定管,因为酸性和氧化性物质易 腐蚀橡胶。 碱性的试剂用碱式滴定管,因为碱性物质易腐蚀玻璃,致使玻璃活塞无法打开。 3.实验操作(以标准盐酸滴定待测NaOH溶液为例) (1)滴定准备“八动词” (2)滴定过程“三动作” (3)终点判断“两数据” ①最后一滴:滴入最后一滴,溶液颜色发生突变。 ②半分钟:颜色突变后,经振荡半分钟内不复原,视为滴定终点。 (4)数据处理 按上述操作重复2~3次,求出用去标准盐酸体积的平均值,根据c(NaOH)=计算。 4.常用酸碱指示剂及变色范围 1.正误判断,正确的画“√”,错误的画“×”。 (1)中和滴定实验时,用待测液润洗锥形瓶( ) (2)滴定终点就是酸碱恰好中和的点( ) (3)滴定管盛标准液时,其液面一定要调在0刻度( ) (4)用碱式滴定管量取20.00 mL KMnO4溶液( ) (5)滴定管在加入反应液之前一定要用所要盛装的反应液润洗2~3遍( ) 答案 (1)× (2)× (3)× (4)× (5)√ 2.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图所示,从下表中选出正确选项( ) 答案 D 解析 解答本题的关键是:① 明确酸式、碱式滴定管使用时的注意事项,②指示剂的变色范围。酸式滴定管不能盛放碱液,而碱式滴定管不能盛放酸液,指示剂应选择颜色变化明显的酚酞或甲基橙,不能选用石蕊。 考点1 中和滴定及误差分析 典例1 现用中和滴定来测定某烧碱溶液的浓度。 (1)滴定:用________式滴定管盛装c mol·L-1盐酸标准液。右图表示某次滴定时50 mL滴定管中前后液面的位置。把用去的标准盐酸的体积填入表格中,此次滴定结束后的读数为________mL,滴定管中剩余液体的体积为________。 该实验应选用________作指示剂。 (2)有关数据记录如下: 根据所给数据,写出计算烧碱溶液的物质的量浓度的表达式c=________________________________(不必化简)。 (3)对下列几种假定情况进行讨论(填“无影响”“偏高”或“偏低”): ①若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果________。 ②读数时,若滴定前仰视,滴定后俯视,则会使测定结果________。 ③若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果________。 ④滴加盐酸速度过快,未充分振荡,则看到溶液变色,立刻停止滴定,则会使测定结果________。 解析 (1)盛装盐酸用酸式滴定管;读数注意视线与凹液面最低点水平,精确到小数点后两位;酚酞的变色范围与7最接近。 (2)运用c(H+)·V(H+)=c(OH-)·V(OH-),c(OH-)=,消耗盐酸的体积取平均值。 (3)c(OH-)=,主要分析对V(H+)的影响。①不影响V(H+),无影响;②V(H+)偏小,结果偏低;③V(H+)偏大,结果偏高;④V(H+)偏小,结果偏低。 答案 (1)酸 24.90 大于25.10 mL 酚酞 (2) (3)①无影响 ②偏低 ③偏高 ④偏低 名师精讲 1.中和滴定的两个易错点 (1)分清完全中和与恰好为中性 ①完全中和强调的是酸、碱恰好反应生成盐,根据酸碱的强弱不同,溶液可能为中性,也可能为酸性或碱性。 ② 酸碱反应恰好为中性则强调的是反应后溶液为中性,而酸、碱不一定正好反应。可能酸不足,也可能酸过量,也可能恰好反应。这取决于酸碱的相对强弱。 (2)酸碱中和滴定指示剂的选择 ①指示剂的变色点与滴定终点的pH越接近越好。 ②指示剂在滴定终点时颜色变化明显,指示准确。 ③石蕊的“红色→紫色”“紫色→蓝色”的颜色变化不够明显,所以石蕊不能作为酸碱中和反应的指示剂。 2.酸碱中和滴定中常见误差分析 (1)误差分析的方法 依据原理c(标准)·V(标准)=c(待测)·V(待测),所以c(待测)=,因c(标准)与V(待测)已确定,因此只要分析出不正确的操作引起V(标准)的变化,即分析出结果。V(标准)变大,则c(待测)偏高;V(标准)变小,则c(待测)偏低。 (2)常见误差分析 以标准酸溶液滴定未知浓度的碱溶液(酚酞作指示剂)为例,常见的因操作不正确而引起的误差有: 1.某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白: (1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________________,直到加入最后一滴盐酸后,溶液由黄色变为橙色,并__________________________。 (2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________(填字母序号)。 A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 C.酸式滴定管在滴定前有气泡,滴定后气泡消失 D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 (3)某学生根据3次实验分别记录有关数据如下表: 依据上表数据列式计算该NaOH溶液的物质的量浓度。 答案 (1)锥形瓶中溶液颜色变化 在半分钟内不变色 (2)D (3)==26.10 mL, c(NaOH)==0.1044 mol·L-1 解析 在求c(NaOH)和进行误差分析时应依据公式:c(NaOH)=。欲求c(NaOH),须先求V[(HCl)aq],再代入公式;进行误差分析时,要考虑实际操作对V[(HCl)aq]和V[(NaOH)aq]的影响,进而影响c(NaOH)。 (3)先算出耗用标准盐酸的平均值: ==26.10 mL(第二次偏差太大,舍去), c(NaOH)==0.1044 mol·L-1。 考点2 酸碱中和滴定曲线分析 典例2 (2016·全国卷Ⅰ)298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是( ) A.该滴定过程应该选择酚酞作为指示剂 B.M点对应的盐酸体积为20.0 mL C.M点处的溶液中c(NH)=c(Cl-)=c(H+)=c(OH-) D.N点处的溶液中pH<12 解析 酚酞的变色范围是8.2~10.0,又因为NH4Cl是强酸弱碱盐,水解显酸性,故正好中和时溶液显酸性,盐酸的量不足时溶液可能就褪色了,使测量值偏小,故应用甲基橙作指示剂,A错误;当加入盐酸20.0 mL时正好生成NH4Cl,因为NH的水解使溶液pH<7,而M点对应pH=7,故加入盐酸少于20.0 mL,B错误;由电荷守恒知:c(NH)+c(H+)=c(OH-)+c(Cl-),又因pH=7,故c(H+)=c(OH-),所以c(NH)=c(Cl-),但c(NH)=c(Cl-)>c(H+)=c (OH-),C错误;由0.10 mol·L-1氨水的电离度为1.32%可知: c(OH-)=0.10 mol·L-1× 1.32%=0.00132 mol·L-1,所以c(H+)= mol·L-1> mol·L-1=1.0×10-12 mol·L-1,故pH<12,D正确。 答案 D 名师精讲 滴定曲线分析的方法 (1)分析步骤:首先看纵坐标,搞清楚是酸加入碱中,还是碱加入酸中;其次看起点,起点可以看出酸性或碱性的强弱,这在判断滴定终点时至关重要;再次找滴定终点和pH=7的中性点,判断滴定终点的酸碱性,然后确定中性点(pH=7) 的位置;最后分析其他的特殊点(如滴定一半点,过量一半点等),分析酸、碱过量情况。 (2)滴定过程中的定量关系:①电荷守恒关系在任何时候均存在;②物料守恒可以根据加入酸的物质的量和加入碱的物质的量进行确定,但不一定为等量关系。 2.常温下,用pH=m的盐酸滴定20 mL pH=n的MOH溶液,且m+n=14。混合溶液的pH与盐酸体积V的关系如图所示。下列说法正确的是( ) A.a点:c(Cl-)>c(M+)>c(OH-)>c(H+) B.b点:MOH和HCl恰好完全反应 C.c点:c(H+)=c(OH-)+c(MOH) D.a点到d点:水电离的c(H+)·c(OH-)先变大,后变小 答案 D 解析 m+n=14,从图像看出,b点时,盐酸体积与MOH溶液体积相等,溶液呈碱性,说明混合溶液中MOH过量,MOH继续电离,说明MOH是弱碱。A项,a点对应的溶液呈碱性,溶液中离子浓度大小顺序为c(M+)>c(Cl-)>c(OH-)>c(H+),错误;B项,b点对应的溶液中MOH未完全反应,溶液呈碱性,错误;C项,c点对应的溶液显中性,c(H+)=c(OH-),错误;D项,在碱溶液中滴加盐酸,水的电离程度逐渐增大,当碱与酸恰好完全反应时,水的电离程度最大,然后随着盐酸的不断加入,水的电离受到抑制,则水电离的c(H+)·c(OH-)先变大,后变小,正确。 3.室温下,向a点(pH=a)的20.00 mL 1.000 mol·L-1氨水中滴入1.000 mol·L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法错误的是( ) A.将此氨水稀释,溶液的导电能力减弱 B.b点溶液中离子浓度大小可能存在: c(NH)>c(Cl-)>c(OH-)>c(H+) C.c点时消耗盐酸体积V(HCl)<20.00 mL D.a、d两点的溶液,水的离子积Kw (a)>Kw(d) 答案 D 解析 A项,稀释氨水,虽然促进一水合氨的电离,但溶液中离子浓度减小,导电能力降低,正确;B项,b点pH>7,c(OH-)>c(H+),溶液中电荷守恒为c(NH)+c(H+)=c(Cl-)+c(OH-),则c(NH)>c(Cl-),即c(NH)>c(Cl-)>c(OH-)>c(H+),正确;C项,溶液显中性时,HCl的物质的量小于一水合氨,所以c点消耗盐酸体积V(HCl)<20.00 mL,正确;D项,d点温度高于a点,水的离子积Kw(a)查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档