- 2021-05-21 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习通用版5-3应用层面位、构、性关系的综合推断(怎么用)学案
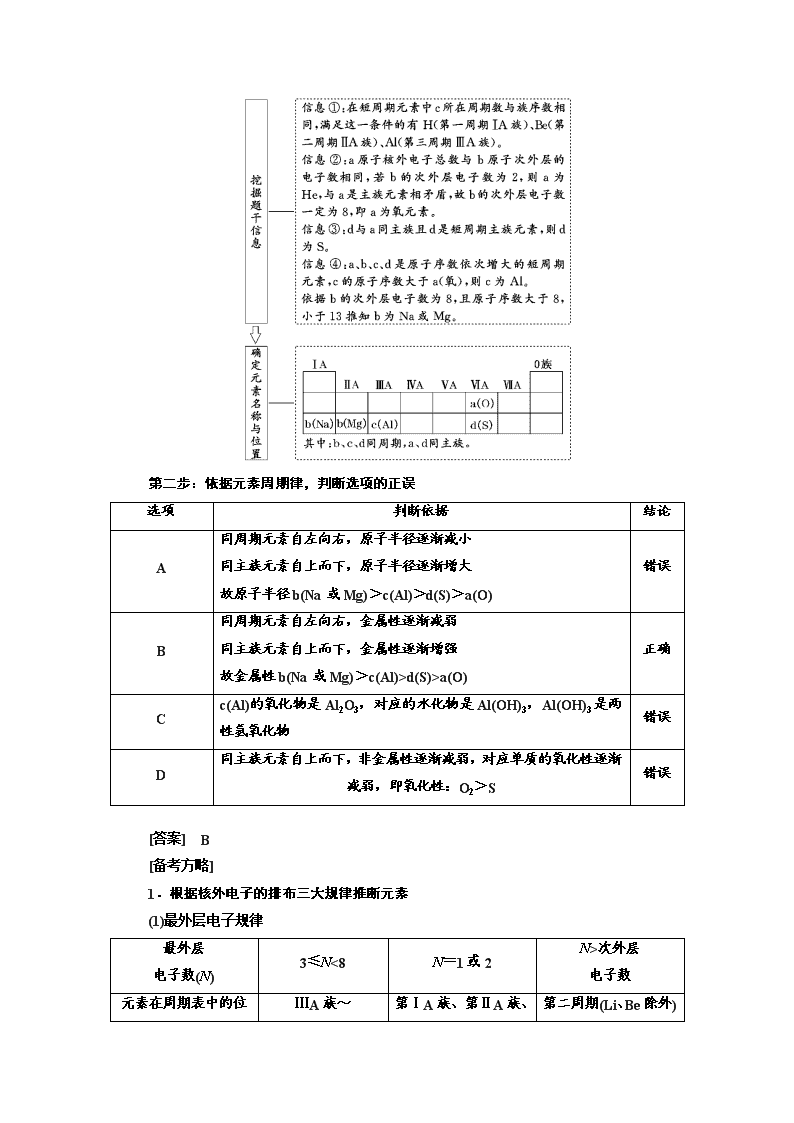
第3课时 应用层面——位、构、性关系的综合推断(怎么用) 元素推断题集基本概念、基本理论及元素化合物的知识于一身,具有综合性强、思维容量大的特点,是每年高考全国卷的必考题型,特别是近几年试题中,元素推断题的灵活性和综合性逐年增强,主要表现在条件渗透交叉、题眼隐藏较深等,增加了考生寻找题目题眼的难度。解答这些元素推断题,不仅要求学生掌握必要的知识,还要求学生有一定的逻辑推理能力,其考查主要有以下三种题型,其解题思路如下。 题型一 依据元素原子结构的特征推断元素 利用原子结构、核外电子排布特征为元素推断的突破口,是元素推断的重要类型之一,题目通常以文字叙述的形式给出元素原子的核外电子排布,位置关系等关键信息。解题时可结合短周期元素的原子结构及元素的特殊性质,对元素进行合理的推断。 [典例1] (2017·全国卷Ⅱ)a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族。下列叙述正确的是( ) A.原子半径:d>c>b>a B.4种元素中b的金属性最强 C.c的氧化物的水化物是强碱 D.d单质的氧化性比a单质的氧化性强 [解题流程] 第一步:挖掘题干信息,确定元素名称 第二步:依据元素周期律,判断选项的正误 选项 判断依据 结论 A 同周期元素自左向右,原子半径逐渐减小 同主族元素自上而下,原子半径逐渐增大 故原子半径b(Na或Mg)>c(Al)>d(S)>a(O) 错误 B 同周期元素自左向右,金属性逐渐减弱 同主族元素自上而下,金属性逐渐增强 故金属性b(Na或Mg)>c(Al)>d(S)>a(O) 正确 C c(Al)的氧化物是Al2O3,对应的水化物是Al(OH)3,Al(OH)3是两性氢氧化物 错误 D 同主族元素自上而下,非金属性逐渐减弱,对应单质的氧化性逐渐减弱,即氧化性:O2>S 错误 [答案] B [备考方略] 1.根据核外电子的排布三大规律推断元素 (1)最外层电子规律 最外层 电子数(N) 3≤N<8 N=1或2 N>次外层 电子数 ⅢA族~ 第ⅠA族、第ⅡA 第二周期(Li、Be除外) 元素在周期表中的位置 ⅦA族 族、第Ⅷ族、副族、0族元素氦 (2)“阴三、阳四”规律 某元素阴离子最外层电子数与次外层电子数相等,该元素位于第三周期;若为阳离子,则位于第四周期。如S2-、K+最外层电子数与次外层电子数相等,则S位于第三周期,K位于第四周期。 (3)“阴上、阳下”规律 电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期。如O2-、F-、Na+、Mg2+、Al3+电子层结构相同,则Na、Mg、Al位于O、F的下一周期。 2.根据元素在周期表中位置,确定其化合物的化学式 知道元素在周期表中的主族序数后,根据化合价规律就可以写出它的化合物的化学式,例如(用R代表元素): ⅣA ⅤA ⅥA ⅦA 氢化物 RH4 RH3 H2R HR 最高价氧化物 RO2 R2O5 RO3 R2O7 最高价含氧酸 H4RO4 或H2RO3 H3RO4 或HRO3 H2RO4 HRO4 [对点练1] a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是( ) A.d元素的非金属性最强 B.它们均存在两种或两种以上的氧化物 C.只有a与其他元素生成的化合物都是离子化合物 D.b、c、d分别与氢形成的化合物中化学键均为极性共价键 解析:选D 短周期元素中M层电子数是1,则a的核外电子排布是2、8、1,a是Na元素;b的最外层电子数为内层电子数的2倍,则b核外电子排布是2、4,b是C元素;c的最高化合价为最低化合价绝对值的3倍,则c是S元素;c、d的原子处于同一周期,d的原子半径小于c,根据元素周期律可知d是Cl元素。A项,在上述元素中非金属性最强的元素是Cl元素,正确;B项,Na可以形成Na2O、Na2O2两种氧化物,C可以形成CO、CO2两种氧化物,S可以形成SO2、SO3两种氧化物,而Cl元素则可以形成Cl2O、ClO2、ClO3等多种价态的氧化物,正确;C项,Na是金属元素,可以与非金属元素C、S、Cl 形成离子化合物,正确;D项,C元素可以与H元素形成乙烷,该分子中含有非极性键,错误。 [对点练2] (2018·全国卷Ⅱ)W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是( ) A.X与其他三种元素均可形成两种或两种以上的二元化合物 B.Y与其他三种元素分别形成的化合物中只含有离子键 C.四种元素的简单离子具有相同的电子层结构 D.W的氧化物对应的水化物均为强酸 解析:选A W、X、Y、Z四种元素原子序数依次增大且为短周期元素,由W与X可生成一种红棕色有刺激性气味的气体可知,W为N,X为O;由Y的周期数是族序数的3倍可知,Y为Na;由Z原子最外层的电子数与W的电子总数相同可知,Z最外层有7个电子,Z为Cl。O与N可形成NO、NO2、N2O3等,O与Na可形成Na2O、Na2O2,O与Cl可形成Cl2O、ClO2、Cl2O7等,A项正确;Na2O2中含有共价键,B项错误;Cl-比N3-、O2-、Na+多一个电子层,C项错误;W的氧化物中,N2O3对应的水化物HNO2是弱酸,D项错误。 题型二 依据元素周期表的“片段结构”推断元素 残缺元素周期表型推断题一般给出两种信息: 一是给出局部的元素周期表,展示出几种不同元素的相对位置; 二是给出某种元素的位置特征、原子结构特征或由该元素形成的单质或化合物的特殊性质。解答此类题目时,要先根据给出的某种元素的特殊结构或性质,确定该元素在周期表中的位置,然后以此为“坐标原点”,根据其他元素与该元素的位置关系,进而确定其他未知的元素。 [典例2] (2017·全国卷Ⅲ)短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( ) A.氢化物沸点:W查看更多