备战2021 浙教版科学中考专题训练 第35讲 水 和 溶 液
第 - 1 - 页 共 15 页
- 1 -
第 35 讲 水 和 溶 液
重点突破
溶液的概念与特点
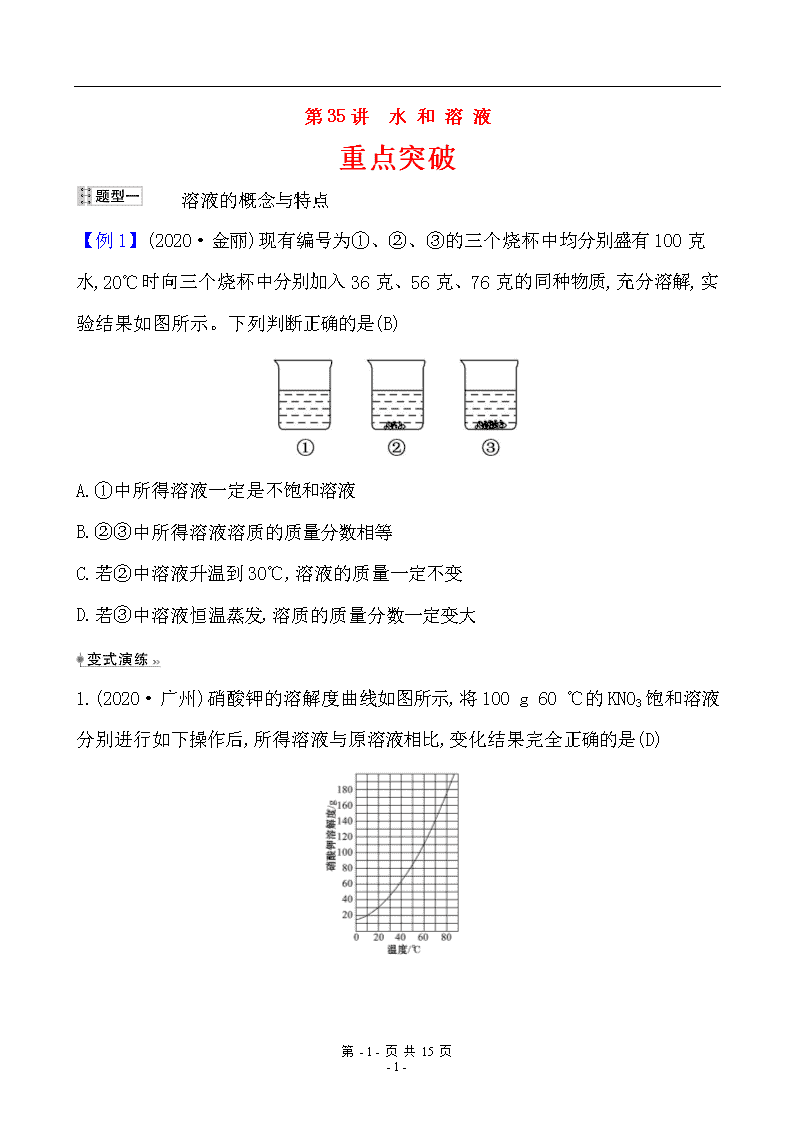
【例 1】(2020·金丽)现有编号为①、②、③的三个烧杯中均分别盛有 100 克
水,20℃时向三个烧杯中分别加入 36 克、56 克、76 克的同种物质,充分溶解,实
验结果如图所示。下列判断正确的是(B)
A.①中所得溶液一定是不饱和溶液
B.②③中所得溶液溶质的质量分数相等
C.若②中溶液升温到 30℃,溶液的质量一定不变
D.若③中溶液恒温蒸发,溶质的质量分数一定变大
1.(2020·广州)硝酸钾的溶解度曲线如图所示,将 100 g 60 ℃的 KNO3 饱和溶液
分别进行如下操作后,所得溶液与原溶液相比,变化结果完全正确的是(D)
第 - 2 - 页 共 15 页
- 2 -
选项 操作
溶质质
量
溶液质
量
溶质的质量
分数
KNO3的溶解度
A 升温 变大 变大 不变 变大
B 降温 变小 变小 不变 变小
C 加入 KNO3 固体 不变 变大 变大 变大
D 恒温蒸发部分水 变小 变小 不变 不变
溶解度及其应用
【例 2】(2020·绍兴)下表是 A、B、C 三种固体物质在不同温度下(t1
7.3%(其他解法也可)
答:变大。
解释:蒸发的水占水总质量的百分比大于挥发的 HCl 占 HCl 总质量的百分比
第 - 5 - 页 共 15 页
- 5 -
3.如图是配制溶质质量分数为 10%的 NaCl 溶液的实验操作示意图:
(1)用图表示的序号表示配制溶液的正确操作顺序 ②⑤①④③ 。
(2)称量 NaCl 时,天平平衡后的状态如图⑤所示,游码标尺示数见图,则称取的
NaCl 质量为 18.2 g 。
(3)称量 NaCl 质量完毕放回砝码时,发现有一个砝码缺损了一个小角,若其他操
作步骤正确,则所配溶液的溶质质量分数 小于 (填“大于”“小于”或“等
于”)10%。
第 - 6 - 页 共 15 页
- 6 -
诊断自测
1.下列有关溶液说法正确的是(A)
A.溶液都是均一、稳定的混合物
B.形成溶液的溶质都是固体
C.所有饱和溶液都比不饱和溶液要浓
D.溶液的体积等于溶质的体积与溶剂的体积之和
2.(2020·嘉兴)某兴趣小组分别用加溶质和恒温蒸发溶剂的方法,将一定质量
的硝酸钾不饱和溶液转化为饱和溶液。实验过程中,硝酸钾溶解度的变化情况分
别是(D)
A.变大、不变 B.变大、变小
C.不变、变大 D.不变、不变
3.(2019·嘉兴)20 ℃时,把 36 克氯化钠放入 64 克水中,使其充分溶解(20 ℃时
氯化钠的溶解度为 36 克)。对所得溶液的有关说法错误的是(C)
A.该溶液是饱和溶液
B.溶液中 Na+和 Cl-个数一定相等
C.溶液质量为 100 克
D.溶质与溶剂质量比为 9∶25
4.(2020·衢州)一杯热硝酸钾溶液放在桌面上,一段时间后观察到烧杯底部有
少量的晶体析出,如图所示。忽略水的蒸发,下列关于硝酸钾及其溶液的分析正
确的是(B)
第 - 7 - 页 共 15 页
- 7 -
A.溶液质量不变
B.溶液的溶质质量分数变小
C.硝酸钾的溶解度变大
D.原溶液一定是饱和溶液
5.(2020·北京)下列是两个关于水的实验。
(1)实验 1,反应的化学方程式为 2H2O 2H2↑+O2↑ 。
(2)下列说法正确的是 AC (填序号)。
A.实验 1,试管 a 中得到的气体能燃烧
B.实验 1,反应前后原子的种类、个数均改变
C.实验 2,水变化前后分子的种类不变
6.某同学配制 50 g 6%氯化钠溶液,整个操作过程如图所示,回答下列问题:
(1)配制溶液的正确操作顺序为 ②①⑤③④ (填序号,下同),其中操作错误
的是 ① ;
第 - 8 - 页 共 15 页
- 8 -
(2)图②中盛放氯化钠固体的仪器名称是 广口瓶 ,需称取氯化钠 3 g;
(3)量水时选用的量筒的量程最合适的是 C (填序号),读数时视线要与量筒
内 凹液面的最低处 保持水平;
A.10 mL B.25 mL C.50 mL D.100 mL
(4)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是 AD (填序
号)。
A.氯化钠固体不纯
B.用生锈砝码称量
C.装瓶时有少量溶液洒出
D.溶解时烧杯内壁有水珠
第 - 9 - 页 共 15 页
- 9 -
高效提分作业
1.(2020·苏州)下列关于溶液的说法正确的是 (C)
A.溶液一定是无色透明的液体
B 饱和溶液降温后都有溶质结晶析出
C.碘酒溶液中,碘是溶质,酒精是溶剂
D.水加入蔗糖后形成溶液,导电性明显增强
2.(2019·金丽)甲是 60 ℃的蔗糖溶液,按如图所示进行操作。以下分析错误的
是 (D)
A.甲一定是不饱和溶液
B.丙和丁一定是饱和溶液
C.乙的溶质质量分数一定比甲大
D.甲和丙的溶质质量分数一定不相等
3.如表是不同温度时硝酸钾的溶解度,有关说法正确的是 (D)
温度/℃ 0 20 40 60 80 100
溶解度/克 13.3 31.6 63.9 110 169 246
A.20 ℃时,100 克水中溶解的硝酸钾越多溶解度就越大
B.40 ℃时,100 克硝酸钾饱和溶液中含有硝酸钾 63.9 克
C.100 ℃的水能溶解的硝酸钾一定比 80 ℃的水能溶解的硝酸钾多
D.0 ℃的硝酸钾饱和溶液一定比 60 ℃的硝酸钾饱和溶液的溶质质量分数小
第 - 10 - 页 共 15 页
- 10 -
4.(2018·宁波)20 ℃时,四个实验小组分别取不同质量的 NaCl,逐渐加入各盛有
50 g 水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余 NaCl 的质量。
记录数据如表:
实验小组 第一组第二组第三组第四组
水的质量/g50 50 50 50
所取 NaCl
的质量/g
15 20 25 30
剩余 NaCl
的质量/g
0 2 7 12
下列说法错误的是 (A)
A.20 ℃时,50 g NaCl 饱和溶液中含有 18 g NaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为 9∶25
D.相同温度下,NaCl 在水里的溶解度与水的质量无关
5.(2018·潍坊)M 是硝酸钾或氯化铵中的一种。硝酸钾和氯化铵的溶解度曲线如
图 1 所示。某化学兴趣小组用物质 M 进行了如图 2 所示实验。下列说法不正确
的是 (C)
第 - 11 - 页 共 15 页
- 11 -
A.物质 M 是硝酸钾
B.溶液②中溶质质量分数为 37.5%
C.溶液①②③中,溶质质量分数的关系是②>③>①
D.溶液①为不饱和溶液,溶液②和③为饱和溶液
6.(2019·青岛)向下列物质中分别加入适量水,充分搅拌,不能得到溶液的是 (C)
A.硝酸钾 B.蔗糖 C.花生油 D.酒精
7.(2020·天津)溶液与人类生产、生活密切相关。
(1)把少量下列物质分别放入水中,充分搅拌,能得到溶液的是 A (填序
号)。
A.硝酸钾 B.植物油 C.面粉
(2)下列有关溶液的说法中,正确的是 B (填序号)。
A.凡是均一的、稳定的液体一定是溶液
B.溶液是均一的、稳定的混合物
C.溶液一定是无色的,且溶剂一定是水
(3)如图为甲、乙、丙三种固体物质的溶解度曲线。
①t1 ℃时,甲、乙两种物质的溶解度 相等 (填“相等”或“不相等”)。
②t2 ℃时,甲物质饱和溶液中溶质与溶剂的质量比为 1∶2 (填最简比)。
③现有 t1 ℃时甲、乙、丙三种物质的饱和溶液,将这三种溶液分别升温到 t2 ℃,
所得溶液中溶质质量分数大小关系是 C (填序号)。
第 - 12 - 页 共 15 页
- 12 -
A.甲>乙>丙 B.甲=乙<丙 C.甲=乙>丙
(4)用固体氯化钠和蒸馏水配制 50 g 溶质质量分数为 6%的氯化钠溶液,需要氯化
钠的质量为 3 g。若用已配好的 50 g 溶质质量分数为 6%的氯化钠溶液配制溶
质质量分数为 3%的氯化钠溶液,需要加水的质量为 50 g。
8.在宏观、微观和符号之间建立联系是化学特有的思维方式。根据电解水的实
验,回答下列问题。
(1)从宏观上观察:如图所示,试管 a 和 b 中产生气体的体积比约为 2∶1 ,b 中
产生的气体是 O2 (填化学式)。
(2)从微观上分析:下列说法正确的是 C (填字母)。
A.水是由氢气和氧气组成的
B.水是由氢原子和氧原子构成的
C.每个水分子是由 2 个氢原子和 1 个氧原子构成的
(3)从符号上表示:电解水的化学方程式为 2H2O 2H2↑+O2↑ 。
9.(2019·绍兴)如表是硝酸钾在不同温度时的溶解度,根据表中数据回答下列
问题。
温度/℃ 0 10 20 30 40
溶解度/克 13.3 20.9 31.6 45.8 63.9
(1)10 ℃时,100 克水中最多可溶解硝酸钾的质量为 20.9 克。
(2)20 ℃时,将 10 克硝酸钾加入 40 克水中,所得溶液的溶质质量分数为
第 - 13 - 页 共 15 页
- 13 -
20% 。
(3)如图是硝酸钾溶液的变化情况,请写出一种可行的操作方法。(写出计算过
程)
解:方法一:设要加入硝酸钾的质量为 x。
100 克×10%+x=(100 克+x)×25%
x=20 克
答:可向烧杯中加入 20 克硝酸钾。
方法二:设蒸发去水的质量为 y。
100 克×10%=(100 克-y)×25%
y=60 克
答:可蒸发去 60 克水。
10.在室温条件下,对 100 mL 氯化钠饱和溶液进行如图所示操作:
(1)最终甲、乙两烧杯中溶液一定是饱和溶液的是 甲 。
(2)乙溶液在加 50 mL 水的过程中,下列这些量逐渐减小的是 ②④ 。
①溶解度 ②溶质质量分数
③溶剂的质量 ④溶液的密度
11.如表是不同温度下 KNO3 的溶解度。
第 - 14 - 页 共 15 页
- 14 -
温度(℃) 0 20 40
溶解度(g/100 g 水) 13.3 31.6 63.9
(1)称取 30 g KNO3 固体时,在加一定量的固体 KNO3 后发现托盘天平指针偏右,接
下来的操作是 继续加 KNO3 固体 ,直到天平平衡。
(2)20 ℃时,将 30 g KNO3 固体加入盛有 100 g 水的烧杯中,所得溶液是否饱和?
不饱和 。
(3)要使 20 ℃时的上述 KNO3 不饱和溶液变为饱和溶液,可采用 降低温度(或蒸
发水或加 KNO3 固体) 的方法。(写出一种即可)
12.(2020·宜宾)实验室按如图步骤配制 100 g 质量分数为 22%的蔗糖溶液。
回答下列问题:
(1)所需蔗糖的质量为 22 g 。
(2)用规格为 100 (填“50”“100”或“500”)mL 的量筒量取 78 mL 蒸馏
水倒入盛有蔗糖的烧杯中进行溶解。(水的密度约为 1 g·cm-3)。
(3)溶解时玻璃棒的作用是 搅拌,加速溶解 。
(4)下列情况会导致所配溶液中溶质的质量分数偏高的是 D (填字母序号)
A.蔗糖中混有少量杂质
B.称量时蔗糖和砝码位置放反了(使用了游码)
C.用于溶解蔗糖的烧杯洗净后残留有少量的水
第 - 15 - 页 共 15 页
- 15 -
D.用量筒量取水时,俯视读数
13.(2018·岳阳)小兰进行水的电解实验时,在水中加入少许硫酸钠以增强导电
性。她将 2.7 g 硫酸钠固体加入 52.7 g 水中充分溶解,倒入电解器中通电,当正
极产生 4.8 g 氧气时结束实验。忽略气体在水中的溶解,请计算(写出计算过程):
(1)负极产生氢气的质量;
(2)实验结束时所得溶液的溶质质量分数。
解:设生成的氢气的质量为 x,消耗的水的质量为 y
2H2O 2H2↑+O2↑
36 4 32
y x 4.8 g
= = ,x=0.6 g,y=5.4 g
实验结束时所得溶液的溶质质量分数为 ×100%=5.4%
答:(1)负极产生氢气的质量为 0.6 g;
(2)实验结束时所得溶液的溶质质量分数为 5.4%。