- 2021-05-21 发布 |
- 37.5 KB |
- 17页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考专题复习——水和溶液
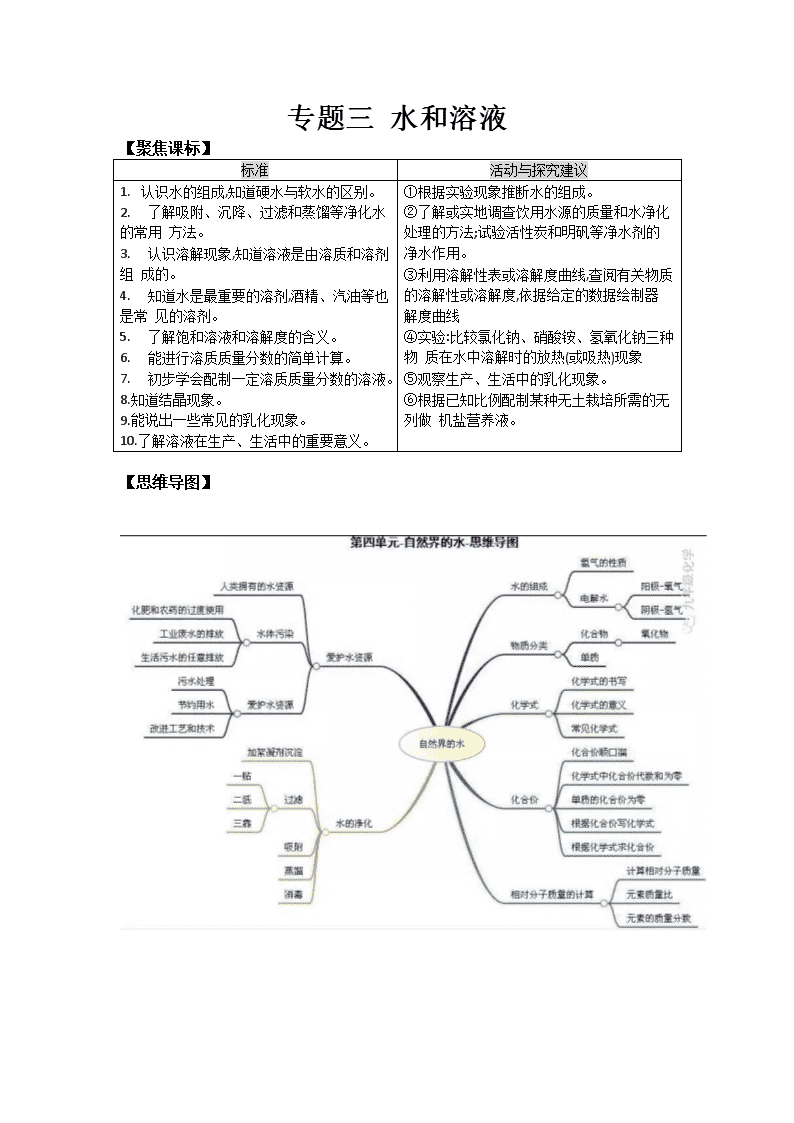
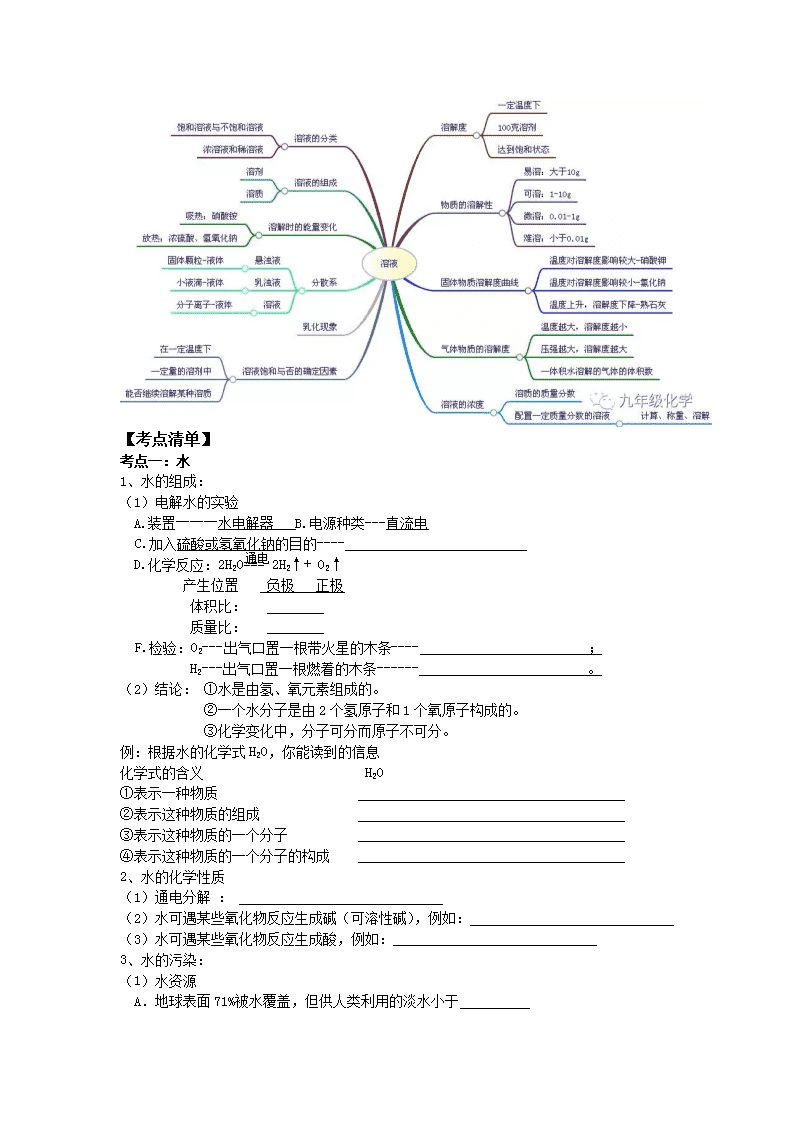
专题三 水和溶液 【聚焦课标】 标准 活动与探究建议 1. 认识水的组成,知道硬水与软水的区别。 2. 了解吸附、沉降、过滤和蒸馏等净化水的常用 方法。 3. 认识溶解现象,知道溶液是由溶质和溶剂组 成的。 4. 知道水是最重要的溶剂,酒精、汽油等也是常 见的溶剂。 5. 了解饱和溶液和溶解度的含义。 6. 能进行溶质质量分数的简单计算。 7. 初步学会配制一定溶质质量分数的溶液。 8.知道结晶现象。 9.能说出一些常见的乳化现象。 10.了解溶液在生产、生活中的重要意义。 ①根据实验现象推断水的组成。 ②了解或实地调查饮用水源的质量和水净化 处理的方法;试验活性炭和明矾等净水剂的 净水作用。 ③利用溶解性表或溶解度曲线,查阅有关物质 的溶解性或溶解度,依据给定的数据绘制器 解度曲线 ④实验:比较氯化钠、硝酸铵、氢氧化钠三种物 质在水中溶解时的放热(或吸热)现象 ⑤观察生产、生活中的乳化现象。 ⑥根据已知比例配制某种无土栽培所需的无列做 机盐营养液。 【思维导图】 【考点清单】 考点一:水 1、水的组成: (1)电解水的实验 A.装置―――水电解器 B.电源种类---直流电 通电 C.加入硫酸或氢氧化钠的目的---- D.化学反应:2H2O=== 2H2↑+ O2↑ 产生位置 负极 正极 体积比: 质量比: F.检验:O2---出气口置一根带火星的木条---- ; H2---出气口置一根燃着的木条------ 。 (2) 结论: ①水是由氢、氧元素组成的。 ②一个水分子是由2个氢原子和1个氧原子构成的。 ③化学变化中,分子可分而原子不可分。 例:根据水的化学式H2O,你能读到的信息 化学式的含义 H2O ①表示一种物质 ②表示这种物质的组成 ③表示这种物质的一个分子 ④表示这种物质的一个分子的构成 2、水的化学性质 (1)通电分解 : (2)水可遇某些氧化物反应生成碱(可溶性碱),例如: (3)水可遇某些氧化物反应生成酸,例如: 3、水的污染: (1)水资源 A.地球表面71%被水覆盖,但供人类利用的淡水小于 B.海洋是地球上最大的储水库。海水中含有80多种元素。海水中含量最多的物质是 ,最多的金属元素是 ,最多的元素是 。 C.我国水资源的状况 。 (2)水污染 A、水污染物:工业“三废”(废渣、废液、废气);农药、化肥的不合理施用;生活污水的任意排放 B、防止水污染:工业三废要经处理达标排放、提倡零排放;生活污水要集中处理达标排放、提倡零排放;合理施用 ,提倡使用农家肥;加强水质监测。 (3)爱护水资源:节约用水,防止水体污染 4、水的净化 (1)水的净化效果由低到高的是 静置、吸附、过滤、蒸馏(均为 方法),其中净化效果最好的操作是 ;既有过滤作用又有吸附作用的净水剂是 。 (2)硬水与软水 A.定义 硬水是 的水;软水是 的水。 B.鉴别方法:用 ,有浮渣产生或泡沫较少的是 ,泡沫较多的是 C.硬水软化的方法: (实验室)、 (家庭中) D.长期使用硬水的坏处:浪费肥皂,洗不干净衣服;锅炉容易结成水垢,不仅浪费燃料,还易使管道变形甚至引起锅炉爆炸。 5、其他 (1) 水是最常见的一种溶剂,是相对分子质量最小的氧化物。 (2) 水的检验:用无水硫酸铜,若由白色变为蓝色,说明有水存在; (3) CuSO4+5H2O = CuSO4·5H2O 水的吸收:常用浓硫酸、生石灰、固体氢氧化钠、铁粉。 考点二、分子与原子 分子 原子 定义 分子是 原子是 性质 体积小、质量小;不断运动;有间隙 联系 分子是由原子构成的。分子、原子都是构成物质的微粒。 区别 化学反应的实质: 。 考点三、物质的组成、构成及分类 组成:物质(纯净物)由元素组成 原子:金属、稀有气体、碳、硅等。 物质 构成 分子:如氯化氢由氯化氢分子构成。 H2、O2、N2、Cl2。 离子:NaCl等离子化合物,如氯化钠由钠离子(Na+)氯离子(Cl-)构成 混合物(多种物质) 分类 单质 :金属、非金属、稀有气体(一种元素) 纯净物 (一种物质) 化合物: 有机化合物 CH4、C2H5OH、C6H12O6、淀粉、蛋白质 (多种) 氧化物 H2O CuO CO2 无机化合物 酸 HCl H2SO4 HNO3 碱 NaOH Ca(OH)2 KOH 盐 NaCl CuSO4 Na2CO3 考点四、溶液的形成 一 、溶液 (1)溶液的概念:一种或几种物质分散到另一种物质里形成的 混合物, (2)溶液的基本特征:均一性、稳定性的混合物 注意:a、溶液不一定无色, 如CuSO4为 FeSO4为 Fe2(SO4)3 b、溶质可以是 ; 是最常用的溶剂 c、溶液的质量 = 的质量 + 的质量 溶液的体积 ≠ 溶质的体积 + 溶剂的体积 d、溶液的名称:溶质的溶剂溶液(如:碘酒——碘的酒精溶液)碘酒中溶质是碘,溶剂是酒精。盐酸溶质是HCl,石灰水溶质为Ca(OH)2, (1)概念: (2)饱和溶液和不饱和溶液之间的转化 ① ② 饱和溶液 不饱和溶液 ① ② ③ 熟石灰对温度例外 饱和石灰水变成不饱和的石灰水的方法是:①加水②降温 对于同一种溶质的溶液来说,在同一温度下,饱和溶液一定比不饱和溶液要浓。 注:①Ca(OH)2和气体等除外,它的溶解度随温度升高而降低 ②最可靠的方法是:加溶质、蒸发溶剂 (3)溶解时放热、吸热现象 溶解吸热:如 溶解放热:如 溶解没有明显热现象:如NaCl 考点五、溶解度 二、溶解度 1、固体的溶解度 (1)溶解度定义:在一定温度下,某固态物质100g溶剂里达到饱和状态时所溶解的质量 四要素:①条件: ②标准: ③状态: ④质量:单位: (2)溶解度的含义: 20℃时NaCl的溶液度为36g含义: 在20℃时,在100克水中最多能溶解36克NaCl 或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克 20℃时,易溶物质的溶解度为﹥10g,可溶物质的溶解度1g—10g,微溶物质的溶解度为0.01g—1g,难溶物质的溶解度为﹤0.01g。 (3)影响固体溶解度的因素:①溶质、溶剂的性质(种类) ②温度 大多数固体物的溶解度随温度升高而升高;如KNO3 少数固体物质的溶解度受温度的影响很小;如NaCl 极少数物质溶解度随温度升高而降低。如Ca(OH)2 (4)溶解度曲线 · 0 t1 t2 t3 N t S P A 例: (1)t3℃时A的溶解度为 80 · (2)P点的的含义 B (3)N点为 t3℃时A的 ,可通过 的方法使它变为饱和。 C (4)t1℃时A、B、C、溶解度由大到小的顺序 (5)从A溶液中获取A晶体可用 的方法获取晶体。 (6)t2℃ 时A、B、C的饱和溶液各W克,降温到t1℃ 会析出晶体的有 , 无晶体析出的有 ,所得溶液中溶质的质量分数由小到大依次为 。 (8)除去A中的泥沙用 法;分离A与B(含量少)的混合物,用 法 2、气体的溶解度 (1)气体溶解度的定义:在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。 (2)影响因素: ①气体的性质 ②温度(温度越高,气体溶解度越 ) ③压强(压强越大,气体溶解度越 ) 3、混合物的分离 (1)过滤法:分离可溶物 + 难溶物 (2)结晶法:分离几种可溶性物质 分离:KCl和MnO2方法为过滤,步骤:溶解、过滤、蒸发, NaCl和KNO3方法为结晶,步骤:溶解、冷却结晶。(冷却热饱和溶液法) 对溶解度受温度变化不大的物质采用 的方法来得到晶体(如NaCl)。 对溶解度受温度变化比较大的物质采用 的方法来得到晶体(如KNO3、CuSO4) 结晶的两种方法 蒸发溶剂,如NaCl(海水晒盐) 降低温度(冷却热的饱和溶液,如KNO3) 考点六、溶质的质量分数 三、溶质的质量分数 溶质的质量 溶液的质量 1、公式: 溶质质量分数= × 100% 2、 配制一定溶质质量分数的溶液 配制一定质量分数的溶液 实验用品 托盘天平、烧杯、玻璃棒、药匙、量筒、胶头滴管、溶质、水 实验步骤 ① _______:计算所需溶质的质量和水的体积 ② _______:用天平称出溶质的质量 ③ _______:用量筒量取水的体积 ④ _______:固体和水倒在烧杯中混合,用玻璃棒搅拌至充分溶解即可 ⑤ _______:将配好的溶液装入试剂瓶中并贴上标签 用浓溶液配制一定质量分数的稀溶液 实验用品 烧杯、玻璃棒、量筒、胶头滴管、浓溶液、水 实验步骤 ① _______:计算所需浓溶液的体积和所需水的体积 ② _______:用合适的量筒量取浓溶液和水 ③ _______:将称取的浓溶液和水倒在烧杯中,用玻璃棒搅拌混合均匀 ④ _______:在试剂瓶的标签上写明药品的名称和溶质的质量分数 实验误差分析 操作 误差分析 溶质质 量分数 用含有不溶性杂质的固体药品来配制溶液 药品的实际质量偏小 偏小 用托盘天平称量固体药品质量时砝码放在左盘,物体放在右盘(称量时使用了游码) 若左盘放砝码,药品的实际质量_______ 量取水的体积时仰视读数 水的实际体积_______ 量取水的体积时俯视读数 水的实际体积_______ 将固体药品倒入烧杯中时有少量撒在外面(或纸片上残留少量固体药品) 药品的实际质量_____ 往烧杯中加水时有水溅出 水的实际体积_______ 烧杯中原来有少量水 水的实际体积_______ 将配制好的溶液往试剂瓶中转移时有少量溅出 【典例剖析】 1.【2017年重庆市B】自然界的水都不是纯净水,下列有关水的净化的说法不正确的是( ) A.过滤不能使硬水转化为软水 B.净水时活性炭起吸附作用 C.蒸馏可将海水淡化 D.电解水是一种常用的净水方法 【答案】D 2.【2017年山东省聊城市】关于水的说法正确的是 A.水蒸气遇冷凝结成水,说明水分子体积变小 B.生活中帝用肥皂水将硬水转化成软水 C.通过电解水实验说明水是由氢氧两种元素组成的 D.天然水经过自来水厂净化后得到的是纯净物 【答案】C 【解析】A.水蒸气遇冷凝结成水,说明水分子间隔变小。故A错误。B.生活中常用肥煮沸方法将硬水转化成软水。故B错误。C.通过电解水实验说明水是由氢氧两种元素组成的。故C正确。D.天然水经过自来水厂净化后得到的是混合物。故D错误。 3.【2017年浙江省杭州市】小金在做电解水实检时,先在水中加人少量含酚酞的硫酸钠溶液(硫酸钠溶液呈中性),再通直流电一段时间,现象如图所示。则下列说法正确的是 A.用燃着的木条检验气体a,发现木条上火焰熄灭 B.在酒精灯火焰上检验气体b,气体b不能燃烧 C.与电源负极相连的电极附近的溶液中存在大量OH- D.在此反应中化学能转化为电能 【答案】C 【解析】根据电解水的实验现象可知a试管中为氧气,b试管中的气体为氢气;故AB叙述错误;C选项因为电极附近溶液呈现红色,故与电源负极相连的电极附近的溶液中存在大量OH- 是正确的叙述;D选项此反应中电能转化为化学能;故答案选择C 4.【2017年重庆市B】下列相关实验方法能达到目的是( ) 选项 实验目的 实验方法 A 鉴别稀硫酸和硫酸钠溶液 滴加酚酞 B 鉴别氢气和甲烷 点燃,火焰上罩一个冷而干燥的烧杯 C 除去KCl固体中的MnO2 溶解、过滤和蒸发 D 除去NaCl溶液中少量的Na2CO3 加入足量的石灰水,过滤 A.A B.B C.C D.D 【答案】C 【解析】A、稀硫酸和硫酸钠溶液分别显酸性、中性,均能使酚酞溶液显无色,不能鉴别,错误;B、氢气和甲烷燃烧均能生成水蒸气,点燃,火焰上罩一个冷而干燥的烧杯,烧杯内壁上均出现水雾,不能鉴别,错误; C、KCl易溶于水,MnO2难溶于水,可采取加水溶解、过滤、蒸发的方法进行分离除杂,正确; D、除杂质的要求是:要把杂质除去,但不能除去了需要的物质,更不能带入新的杂质。Na2CO3能与足量的石灰水反应生成碳酸钙沉淀和氢氧化钠,能除去杂质但引入了新的杂质氢氧化钠,不符合除杂原则,错误。故选C 5.【2017年江苏省扬州市】物质甲与乙的溶解度曲线如图所示。下列说法一定正确的是 A.常温下,乙易溶于水 B.甲溶液中溶质的质量分数比乙的大 C.从t2℃降至t1℃,甲溶液中有晶体析出 D.甲的溶解度受温度的影响程度比乙的大 【答案】AD 【解析】因为乙物质在常温下溶解度大于10g,故为易容物质是正确的叙述;B选项没有说明溶液是否饱和和温度没有可比性;C选项因为没有具体说明溶液的性质,从t2℃降至t1℃,甲溶液中有晶体析出如果甲物质的溶液时饱和的有晶体析出,不饱和溶液不一定有晶体析出;D选项根据溶解度曲线的变化趋势可知是正确的叙述;故答案选择AD 6.【2017年四川省自贡市】如表是不同温度时硝酸钾的溶解度,有关说法正确的是( ) 温度/℃ 0 20 40 60 80 100 溶解度/克 13、3 31、6 63、9 110 169 246 温度/℃ 0 20 40[来源:Zxxk.Com] 60 80 100 溶解度/克 13.3 31.6 63.9 110 169 246 A.20℃时,100g水中溶解的硝酸钾越多溶解度就越大 B.40℃时,100g硝酸钾饱和溶液中含有硝酸钾63、9克 C.100℃的水能溶解的硝酸钾一定比80℃的水能溶解的硝酸钾多 D.0℃的硝酸钾饱和溶液一定比60℃的硝酸钾饱和溶液的溶质质量分数小 【答案】D 【解析】A、温度不变,物质的溶解度不变,错误;B、40℃时,硝酸钾的溶解度为63.9g,即40℃时,100g水中能溶解63.9g硝酸钾形成饱和溶液,那么40℃时,100g硝酸钾饱和溶液中含有硝酸钾小于63.9g,错误;C、由于没有确定溶剂的质量,故100℃的水能溶解的硝酸钾不一定比80℃的水能溶解的硝酸钾多,错误;D、0℃的硝酸钾的溶解度小于60℃的溶解度,故0℃的硝酸钾饱和溶液一定比60℃的硝酸钾饱和溶液的溶质质量分数小,正确。故选D。 【高频易混】 1. 饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液。有些物质的溶解能力较弱,溶液虽饱和,但属于稀溶液;溶解能力较强的物质,其不饱和溶液也可能是浓溶液。 2. 饱和溶液升高温度后,不一定变为不饱和溶液。如氢氧化钙的溶解能力随温度的升高反而降低,其饱和溶液升高温度后会析出溶质,所以升温后溶液仍饱和。 3. 酒精的水溶液没有饱和溶液。有些液态物质 相互能以任意比例互溶,不能形成饱和溶液。 4. 物质的溶解度不随溶剂量的改变而改变。因为溶解度只是物质溶解在100g的溶剂里达到饱和状态时所溶解溶质的质量。 5. 从一瓶溶液中无论取出多少溶液,取出的和剩下的溶液中溶质的质量分数都不变。因为取出的和剩下的溶液中溶质与溶剂的质量之比都不变。 6. 一定温度时,向某物质的饱和溶液中加入该物质,溶液中溶质的质量分数不会改变。因为溶液已达到饱和,加入的物质不能继续溶解。 【山西真题】 1.(2015·山西3题2分)下列物质放入水中,不能形成溶液的是 A.植物油 B.蔗糖 C.食盐 D.食用纯碱 2.(2011·山西8题2分)物质的组成和结构决定性质,性质决定用途。下列叙述正确的是 A.洗洁精含有乳化剂,可以除去油污 B.尿素[CO(NH2)2]、HNO3、NH4HCO3中都含氮元素,可用作氮肥 C.煤、石油、天然气都有可燃性,可大量用作燃料 D.生铁坚硬,可以作医疗手术器械 3.(2017山西23题3分)小华在饮用碳酸饮料时,发现有大量气泡逸出,她联系学过的知识从不同角度加以解释。从物理变化的角度解释为 ,从化学变化的角度解释为 (用化学方程式表示) 4.(2017 山西22题3分)我们胃液中含有盐酸它有助于消化,但盐酸过多会引起胃部不适,有时可用小苏打治疗,反应的化学方程式 ,反应前后一定没有发生变化的离子是 。 4.(2015山西23题5分)如图是甲、乙两种固体物质的溶解度曲线 (1)由图可获得的一条信息是 . (2)若乙中混有少量甲,提纯乙的方法是 (3)2℃时,将不饱和的甲溶液,转化成该温度下的饱和溶液的一种方法是 ,变化过程中,溶质的质量分数 (填“增大”、“减小”或“不变”)。 (4)将等质量的甲、乙两种物质的溶液由t2℃降温至t1℃时,析出晶体的质量 (选序号)。 A甲>乙 B.甲<乙 C.无法确定 5.(2014山西23题5分)根据表中的数据,回答下列问题。 (1)40℃时,NaCl的溶解度是 (2)20℃时,称取31.6gKNO3固体加入盛有100g水的烧杯中,充分溶解形成的溶液是 (填“饱和”或“不饱和”)溶液;称取31.6gKN固体时,发现托盘天平指针偏右,接下来的操作是 3)当KNO3中混有少量NaCl时,提纯KNO3所采用的方法为 4)将等质量KNO3的饱和溶液和NaCl的饱和溶液从60℃降温到20℃,对所得溶液的叙述正确的是 (填序号) A都是饱和溶液 B溶剂质量:KNO3>NaCl C溶液质量;KNO3查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档