- 2021-02-26 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2019届山东省济宁市微山县第二中学高二上学期第一次月考(2017
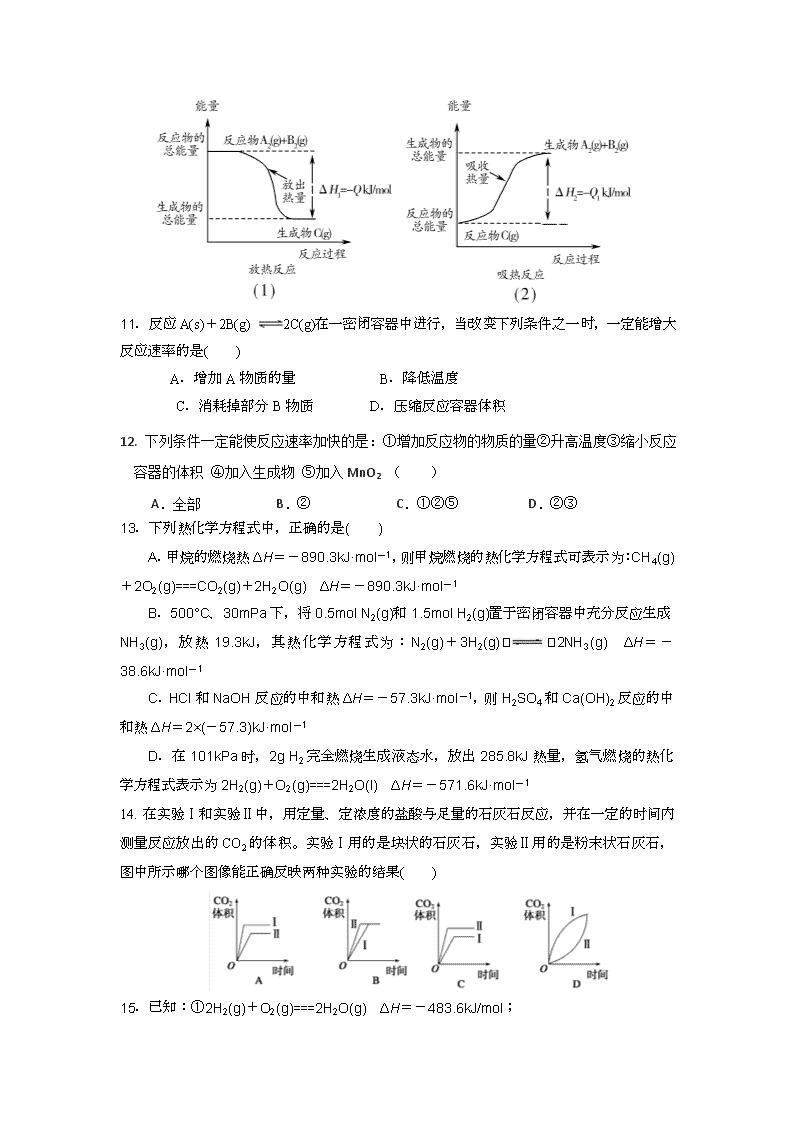
17-18学年度上学期高二年级第一学段 化学试卷 第Ⅰ卷(选择题,共48分) 原子量:H:1 O:16 C:12 N:14 Na:23 Mg:24 Al:27 S:32 一、选择题(本题共16小题,每小题3分,共48分) 1.下列与化学反应能量变化相关的叙述正确的是 ( ) A.生成物总能量一定低于反应物总能量 B.放热反应的反应速率总是大于吸热反应的反应速率 C.应用盖斯定律,可计算某些难以直接测量的反应焓变 D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同 2.下列过程伴随的能量变化中,属于反应热的是( ) A.形成1 mol H—Cl键放出的能量 B.石墨转变成金刚石吸收的能量 C.1 mol O2形成2 mol O原子吸收的能量 D.水蒸气变成液态水放出的能量 3. 下列能正确表示氢气与氯气反应生成氯化氢过程中能量变化的示意图是( ) 4. 下列变化过程,属于放热反应的是( ) ①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4稀释 ④固体NaOH溶于水 ⑤H2在Cl2中燃烧 ⑥食物腐败 A.②③④⑤⑥ B.②③④ C. ①③⑤ D.②⑤⑥ 5. 下列有关热化学方程式的说法中不正确的是( ) A.热化学方程式未注明温度和压强时,ΔH表示标准状况下的数据 B.热化学方程式中的化学计量数只代表反应物或生成物的物质的量 C.在加热或点燃条件下才能进行的化学反应既可以为放热反应,也可以为吸热反应 D.同一化学反应化学计量数不同,ΔH值不同。化学计量数相同而状态不同,ΔH值也不同 6. 在某化学反应中,生成物B的浓度在10 s内从1.5 mol/L变成2.0 mol/L,则这10 s内B的平均反应速率是( ) A. 0.05 mol/(L·s) B. 0.05 mol/L C. 0.20 mol/(L·s) D. 0.20 mol/L 7.在一定条件下,反应N2 + 3H2 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7 g,则反应速率为( ) A.v(H2)=0.03 mol/(L·min) B.v(N2)=0.02 mol/(L·min) C.v(NH3)=0.01 mol/(L·min) D.v(NH3)=0.17 mol/(L·min) 8.反应A(g)+3B(g)2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是( ) A.υ (C)=0.5 mol / (L·s) B.υ(D)=0.4 mol / (L·s) C.υ(B)=0.6 mol / (L·s) D.υ(A)=0.15 mol / (L·s) 9.通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。 则下列热化学方程式不正确的是( ) A.1/2A2(g)+1/2B2(g)=AB(g) ΔH=-91.5kJ·mol-1 B.A2(g)+B2(g)=2AB(g) ΔH=-183kJ·mol-1 C.2AB(g)=A2(g)+B2(g) ΔH=+183kJ·mol-1 D.1/2A2(g)+1/2B2=AB(g) ΔH=+91.5kJ·mol-1 10.如图所示,下列说法不正确的是( ) A.反应过程(1)的热化学方程式为A2(g)+B2(g)===C(g) ΔH1=-QkJ/mol B.反应过程(2)的热化学方程式为C(g)===A2(g)+B2(g) ΔH2=+Q1kJ/mol C.Q与Q1的关系:Q>Q1 D.ΔH2>ΔH1 11.反应A(s)+2B(g) 2C(g)在一密闭容器中进行,当改变下列条件之一时,一定能增大反应速率的是( ) A.增加A物质的量 B.降低温度 C.消耗掉部分B物质 D.压缩反应容器体积 12. 下列条件一定能使反应速率加快的是:①增加反应物的物质的量②升高温度③缩小反应容器的体积 ④加入生成物 ⑤加入MnO2 ( ) A.全部 B.② C.①②⑤ D.②③ 13.下列热化学方程式中,正确的是( ) A.甲烷的燃烧热ΔH=-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1 B.500°C、30mPa下,将0.5mol N2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)2NH3(g) ΔH=-38.6kJ·mol-1 C.HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1 D.在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6kJ·mol-1 14. 在实验Ⅰ和实验Ⅱ中,用定量、定浓度的盐酸与足量的石灰石反应,并在一定的时间内测量反应放出的CO2的体积。实验Ⅰ用的是块状的石灰石,实验Ⅱ用的是粉末状石灰石,图中所示哪个图像能正确反映两种实验的结果( ) 15.已知:①2H2(g)+O2(g)===2H2O(g) ΔH=-483.6kJ/mol; ②H2(g)+S(g)===H2S(g) ΔH=-20.1kJ/mol。下列判断一定正确的是( ) A.由①、②知,2H2S(g)+O2(g)===2S(g)+2H2O(g) ΔH=-443.4kJ/mol B.由①知,氢气的燃烧热为241.8kJ C.反应②中的能量变化可用如图表示 D.若反应②中改用固态硫,则放热大于20.1kJ 16. 一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如下图所示: 下列描述正确的是( ) A.反应开始到10s,用Z表示的反应速率为0.158 mol/(L·s)-1 B.反应开始到l0s,X的物质的量浓度减少了0.79 mol/L C.反应开始到10s时,Y的转化率为79.0% D.反应的化学方程式为:X(g)+Y(g)Z(g) 第Ⅱ卷(共52分) 二、非选择题(共52分) 17.(8分,每空2分) (1)化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化: N2(g)和O2 (g)生成NO(g)过程中的能量变化 ①人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N的键能为________kJ/mol。 ②由上图写出N2(g)和O2(g)生成NO(g)的热化学方程式:___________________________ (2)①已知:C(石墨,s)+O2(g)===CO2(g) ΔH1=-393.5kJ/mol 2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6kJ/mol 2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599.2kJ/mol, 则由C(石墨,s)和H2(g)反应生成1mol C2H2(g)时ΔH=________kJ/mol。 ②火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。 反应的热化学方程式为 。 18.(6分,每空2分)已知化学反应N2+3H2=2NH3的能量变化如图所示, (1)1mol N 和3mol H 生成1mol NH3(g)是--------------------------------能量的过程(填“吸收”或“释放”)。 (2)N2(g)+H2(g)=NH3(g); △H= ; (3)N2(g)和H2生成NH3(1)的热化学方程式为_______________________________。 19. (18分,每空2分) 用50mL0.50mol·L-1的盐酸与50mL0.55mol·L-1的氢氧化钠溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题。 (1)仪器A的名称是____________________________________。 (2)A的材质能否用铁质的代替? (填“能”或“不能”),其原因是: 。 (3)实验时氢氧化钠溶液的浓度要用0.55mol·L-1的原因是: 。 实验中若改用60mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量________(填“相等”或“不相等”),若实验操作均正确,则所求中和热________(填“相等”或“不相等”); (4)已知在稀溶液中,强酸和强碱发生中和反应生成1molH2O时,放出57.3kJ的热量,则上述反应的热化学方程式为:_________________________________________________。 (5)若用KOH代替NaOH,对测定结果________(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果________(填“有”或“无”)影响。 20.(10分,每空2分)下图表示8000C时A、B、C三种气体的物质的量浓度随时间变化的情况,t时各组分浓度不再变化。试回答: (1)该反应的反应物是___________________,达平衡时其转化率是 (2)该反应的化学方程式是 (3)若t是2min,A物质的平均反应速率是_________________,B的反应速率是 21.(10分,每空2分)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。 实验编号 反应物 催化剂 ① 10 mL 2% H2O2溶液 无 ② 10 mL 5% H2O2溶液 无 ③ 10 mL 5% H2O2溶液 1 mL 0.1 mol·L-1 FeCl3溶液 ④ 10 mL 5% H2O2溶液+少量HCl溶液 1 mL 0.1 mol·L-1 FeCl3溶液 ⑤ 10 mL 5% H2O2溶液+少量NaOH溶液 1 mL 0.1 mol·L-1 FeCl3溶液 (1)催化剂能加快化学反应速率的原因是_________________________________________。 (2) H2O2分解的化学方程式为________________________。 (3)实验①和②的目的是_______________________________________________________。 实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是______________________________。 (4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图: 分析上图能够得出的实验结论是_______________________________________________。 …………○…………外…………○…………装…………○…………订…………○…………线…………○………… …………○…………内…………○…………装…………○…………订…………○…………线…………○………… 学校:___________姓名:___________班级:___________准考证号:___________ 17-18学年度上学期高二年级第一学段化学答题卷 说明:请将第Ⅰ卷涂在答题卡上,第Ⅱ卷答案写在本答案卷上 第Ⅱ卷(共52分) 题号 17 18 19 20 21 总分 得分 17.(8分,每空2分) (1) ①______________kJ/mol ②___________________________________________________________ (2)①________________kJ/mol ②_______________kJ/mol 18.(6分,每空2分) (1)_____________________ (2)_____________________ (3)__________________________________________________________ 19.(18分,每空2分) (1) ____________________________________ (2) , _______________________________________________________________ (3) ____________________________________________________________ ____________________, ____________________; (4) _________________________________________________________________ (5) ____________; ______________。 20.(10分,每空2分) (1) ___________________, ____ (2) (3) _______________________,________________ 21.(10分,每空2分) (1) _____________________________________________________________________ (2) ____________________________________________________ (3) _______________________________________________________________________; ________________________________________________________________________。 (4) ________________________________________________________________________ 17-18学年上学期高二年级化学学科学段试卷答案 一、 选择题 题号 1 2 3 4 5 6 7 8 答案 C B B D A A C A 题号 9 10 11 12 13 14 15 16 答案 D C D B D B A C 二、 填空题 17. (8分,每空2分) (1) ①946 ②N2(g)+O2(g)===2NO(g) ΔH=+180kJ/mol (2) ①+226.8 ②N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol; 18. (6分,每空2分) (1)释放 (2)(a-b) kJ·mol-1 (3)N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1 19.(18分,每空2分) (1)环形玻璃搅拌棒 (2)不能 金属铁易导热,容易造成热量的散失,引起较大的实验误差 (3)保证0.50mol/L的盐酸完全被NaOH中和 不相等 相等 HCl(aq)+NaOH(aq) = NaCl(aq)+H2O( l ) ΔH=-57.3 KJ/mol(写成离子方程式也给分) 无 有 20(12分,每空2分) (1)A 50% (2)3AB+3C (3)0.6mol·L-1·min-1 0.2mol·L-1·min-1 21. (10分,每空2分) (1)降低了反应的活化能 (2)2H2O22H2O+O2↑ (3)探究浓度对反应速率的影响 向反应物中加入等量同种催化剂 (或将盛有反应物的试管放入同一热水浴中) (4)碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率查看更多