- 2021-05-21 发布 |
- 37.5 KB |
- 27页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年化学精品教学课件11单元 复习课件
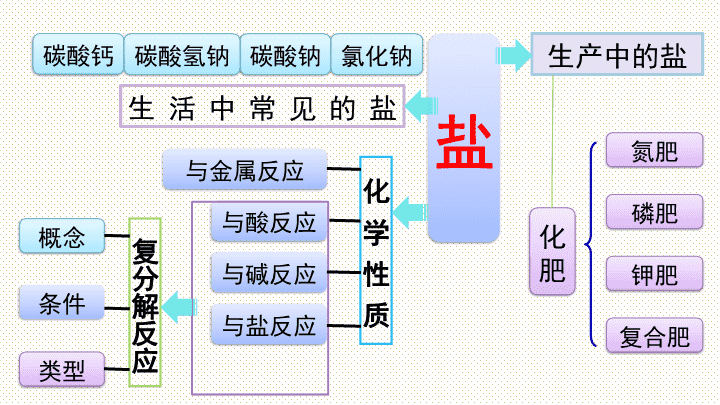
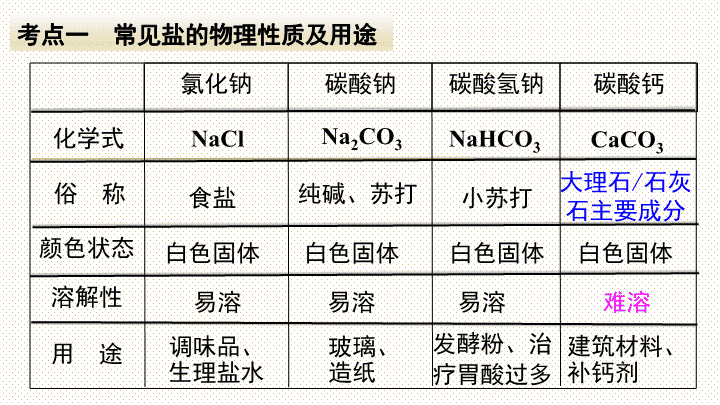
第十一单元 盐 化肥 小结与复习 盐 概念 生活中常见的盐 生产中的盐 氯化钠 碳酸钠 碳酸氢钠 碳酸钙 氮肥 类型 复合肥 钾肥 磷肥 化肥 与盐反应 与碱反应 与酸反应 与金属反应 化 学 性 质 复分解反应 条件 调味品、 生理盐水 大理石 / 石灰石主要成分 氯化钠 碳酸钠 碳酸氢钠 碳酸钙 化学式 俗 称 用 途 颜色状态 溶解性 NaCl Na 2 CO 3 NaHCO 3 CaCO 3 食盐 纯碱、苏打 小苏打 白色固体 白色固体 白色固体 白色固体 易溶 易溶 易溶 难溶 玻璃、 造纸 发酵粉、治 疗胃酸过多 建筑材料、 补钙剂 考点一 常见盐的物理性质及用途 考点二 常见盐的化学性质 1 .与盐酸的反应 Na 2 CO 3 + 2HCl===2NaCl + H 2 O + CO 2 ↑ NaHCO 3 + HCl === NaCl + H 2 O + CO 2 ↑ CaCO 3 + 2 HCl === CaCl 2 + H 2 O + CO 2 ↑ 待检验物质 +稀盐酸 产生气体 变浑浊 CO 2 CaCO 3 (含 CO 3 2- 或 HCO 3 - ) 碳酸根或碳酸氢根离子的检验: +澄清石灰水 2 .特征反应 Na 2 CO 3 + Ca(OH) 2 == CaCO 3 ↓+ 2NaOH Na Cl + Ag NO 3 == AgCl ↓ + NaNO 3 2NaHCO 3 === Na 2 CO 3 + H 2 O + CO 2 ↑ △ CaCO 3 === CaO+ CO 2 ↑ 高温 【练习1】(2018广西梧州中考)关于碳酸钠的说法错误的是( ) A .易溶于水 B .可用于洗涤油污 C .受热易分解 D .可用于制造普通玻璃 C 【练习 2 】(2018湖南衡阳中考)现有下列四种物质: A. 碳酸钙 B. 二氧化碳 C. 活性炭 D. 氯化钠 请用合适物质的代号填空。 (1)可用于防毒面具的是 ______ (2)可用于灭火的是 ______ (3)可用作调味品的是 _____ ( 4 )可用作补钙剂的是 _____ C B D A 考点三 盐的化学性质 化 学 性 质 举 例 盐+金属 1 → 新盐+金属 2 CuSO 4 + Fe===FeSO 4 + Cu 盐+酸 → 新盐+新酸 Na 2 CO 3 + 2HCl===2NaCl + H 2 CO 3 盐+碱 → 新盐+新碱 Na 2 CO 3 + Ca(OH) 2 ===CaCO 3 ↓+2NaOH 盐+盐 → 另外两种盐 Na 2 CO 3 + CaCl 2 ==CaCO 3 ↓+2NaCl H 2 O + CO 2 ↑ 考点四 酸、碱、盐的溶解性 钾盐、钠盐、硝酸盐 、 铵盐都可溶; 碳酸盐只钾、钠、铵盐可溶, 碳酸镁 微溶。 硫酸盐只有 硫酸钡 不可溶; 盐酸盐 ( 氯化物 ) 只有 氯化银、 氯化亚汞不可溶; 注意 盐酸、硫酸、硝酸可溶。 碱中还有 Ba(OH) 2 可溶, Ca(OH) 2 微溶。 钾钠硝铵皆可溶 碳酸盐大多不可溶 硫酸盐除了硫酸钡 盐酸盐除了银、亚汞 这些你都记住了吗? 考点五 复分解反应 在溶液里, 由两种 化合物 相互交换成分,生成另外两种 化合物 的反应。 1. 复分解反应: 2.复分解反应发生的条件 有酸可不溶,无酸必须溶 或①有水生成;或②有气体生成; 或③有沉淀生成。 ( 满足一条即可 ) 生成物 反应物 表达式: AB + CD →AD + CB 特征:双交换,价不变 盐与盐能发生复分解反应,如: Na 2 SO 4 +BaCl 2 =BaSO 4 ↓ +2NaCl 盐 与 碱 能发生复分解反应,如: Na 2 CO 3 +Ca(OH) 2 =CaCO 3 ↓ +2NaOH 盐与酸能发生复分解反应,如: Na 2 CO 3 +2HCl=2NaCl + H 2 CO 3 酸 与 某些金属氧化物 能发生复分解反应,如: Fe 2 O 3 +6HCl=2FeCl 3 + 3H 2 O 酸 与 碱 发生的中和反应属于复分解反应,如: NaOH + HCl=NaCl + H 2 O H 2 O +CO 2 ↑ 3.复分解反应的类型 写法 【例 1 】(2018贵州黔南州中考)下列各种溶质的溶液混合后无明显现象的一组是( ) A.HCl、Na 2 C O 3 、K 2 S O 4 B.KN O 3 、Ba (O H ) 2 、NaCl C.KCl、AgN O 3 、HN O 3 D.Na O H、FeCl 3 、 ( NH 4 ) 2 S O 4 解题思路: A 组有气体产生; C 组有白色沉淀生成; D 组有红褐色沉淀生成。只有 B 组无明显现象。所以选 B B 【例 2 】(2018湖北襄阳中考)下列各组离子能在 p H =3 的溶液中大量共存的是( ) A. NH 4 + 、Na + 、N O 3 - 、C O 3 2- B. N O 3 - 、Cu 2+ 、S O 4 2 - 、 O H - C. Mg 2+ 、K + 、S O 4 2 - 、C l - D. Ca 2 + 、Na + 、HCO 3 - 、C l - 解题思路:溶液中一组离子相遇,若有沉淀或水或气体生成,则该组离子就不能大量共存。 p H =3 的溶液显酸性,溶液里有 H + 。与 A 组中 C O 3 2- 和 D 组中 HCO 3 - 相遇会有 CO 2 气体生成;与 B 组中 O H - 相遇会有水生成,同时 B 组中Cu 2+ 和 O H - 相遇会产生沉淀。所以答案选 C C 【练习 3 】 ( 2018四川德阳中考 ) 向一定质量的 CaCl 2 和 HC1 的混合溶液中逐滴加入溶质质量分数为 10.6 % 的 Na 2 C O 3 溶液,实验过程中加入 Na 2 C O 3 溶液的质量与产生沉淀或气体的质量关系如图所示。下列说法错误的是( ) A. P 点时的溶液只含一种溶质 B . R 点对应横坐标的数值为 180 C. O 至P 过程中溶液的 pH 变大 D. Q 至 R 段表示生成沉淀的过程 A 【练习 4 】 ( 2018 广东中考)学习了单质、氧化物、酸、碱、 盐的性质后,发现有很多不同类别的物质在发生反应时都有盐生成(其他物质省略),如 图所示。请回答: (1)若盐是硫酸钾,则①中发生反应的化学方程式为 _________________________________; ( 2)若盐是氯化亚铁,则在已显示的变化中可以通过置换反应来实现的有 _______ (填序号) ; (3)若盐是硝酸铜,由⑦来实现的化学方程式为 ______________________________________________ 或 ____________________________________________ (4)图中⑤处应补充的文字是 ________________ (写一种,不能与图中已有信息重复) ④⑥ 金属氧化物 + 酸 2KOH+H 2 SO 4 === K 2 SO 4 +2H 2 O Ba(NO 3 ) 2 +CuSO 4 === BaSO 4 ↓+ Cu(NO 3 ) 2 2AgNO 3 +CuCl 2 === 2AgCl↓+ Cu(NO 3 ) 2 考点六 化肥的种类、作用及区分 1.常用化肥的种类和作用 种类 常 用 化 肥 作 用 氮肥 CO(NH 2 ) 2 、 NH 3 ·H 2 O 、 NH 4 Cl 、 NH 4 NO 3 、 NH 4 HCO 3 促进作物茎、叶的生长茂 盛、叶色浓绿 (壮叶) 磷肥 磷矿粉、钙镁磷肥、过磷酸钙 促进作物根系发达,增强抗 寒、抗旱能力 (壮根) 钾肥 硫酸钾 ( K 2 SO 4 ) 、氯化钾 ( KCl ) 促进作物生长健壮,茎秆粗 硬,增强抗倒伏能力 (壮茎) 复合 肥 硝酸钾 ( K N O 3 ) 、磷酸二氢铵 ( N H 4 H 2 P O 4 ) 同时供给几种养分,有 效成分高 ( 多元肥效 ) 2 .化肥的简易鉴别 铵态氮肥 钾肥 磷肥 看外观 ________ 色晶体 ______ 色粉末 加水 全部溶于水 大多不溶于水 或部分溶于水 加熟石灰 研磨 有具有刺激性气味的氨气放出 无气味 白 灰白 利用物理性质、化学性质的不同,初步区分常用的 氮肥、磷肥和钾肥。 【练习 5 】 ( 2018广东广州中考)下列关于化肥的说法不正确的是( ) A. 化肥对提高农作物的产量具有重要作用 B. 氯化钾 ( KC1 ) 和磷酸氢二铵 [( NH 4 ) 2 HP O 4 ] 都属于复 合肥料 C. 铵态氮肥与熟石灰混合研磨后能嗅到刺激性气味 D. 化肥的过度使用会造成土壤酸化,可用熟石灰改良 B 考点七 粗盐中难溶性杂质的去除 ① _____ ;② _____ ;③ _____ ;④ __________ 。 步骤 玻璃棒的作用 搅拌,加速溶解 搅拌,防止液滴飞溅 引流 转移固体 溶解 过滤 蒸发 计算产率 误差分析:产率偏低的原因 ① 粗盐没有完全溶解 ②过滤时有滤液损失 ③ 蒸发时有液体溅出 【练习 6 】(2018湖南邵阳中考)在粗盐的提纯实验中(2)下图是某同学过滤的操作图,指出图中明 显错误: _________________ ; 过滤后,如果滤液仍然浑浊,其原因可能是 _________________________ ____________________________________; (3)蒸发时,蒸发皿内出现 ____________ 时 停止加热。 没有用玻璃棒引流 液面高于滤纸边缘 ( 或滤纸破损或仪器不干净 ) 较多固体 易错点归纳 1 .注意区分纯碱与烧碱,苏打与小苏打,生石灰与熟石灰、石灰石。 2 .盐溶液不一定显中性。 3 .不能准确判断复分解反应能否发生。 4 .不能正确推断溶液中离子能否共存。 化学方程式网络构建 1.碳酸钠与酸、碱、盐之间的反应及转化 ②盐酸 ③硫酸 碳酸钠 ⑥氯化钙⑦氯化钡 ④氢氧化钙 ⑤氢氧化钡 碳酸氢钠 氢氧化钠 ① ⑧ ① ________________________________________ ② ________________________________________ ③ ________________________________________ ④ ________________________________________ ⑤ ________________________________________ ⑥ ________________________________________ ⑦ ________________________________________ ⑧ ________________________________________ Na 2 CO 3 +H 2 SO 4 === Na 2 SO 4 +H 2 O+CO 2 ↑ Na 2 CO 3 +Ca(OH) 2 === CaCO 3 ↓+2NaOH Na 2 CO 3 +Ba(OH) 2 === BaCO 3 ↓+2NaOH Na 2 CO 3 +CaCl 2 === CaCO 3 ↓+2NaCl Na 2 CO 3 +BaCl 2 === BaCO 3 ↓+2NaCl 2NaOH+CO 2 === Na 2 CO 3 +H 2 O 2NaHCO 3 === Na 2 CO 3 + H 2 O + CO 2 ↑ △ Na 2 CO 3 + 2HCl===2NaCl + H 2 O + CO 2 ↑ 2. 含钙化合物之间的转化 A 的化学式 __________ CaCO 3 氧化钙 氯化钙 ③ 氢氧化钙 A ①高温 ② ④ ⑤ ⑥ ① ____________________________________________ ② ____________________________________________ ③ ____________________________________________ ④ ____________________________________________ ⑤ ____________________________________________ ⑥ ____________________________________________ CaO+H 2 O=== Ca(OH) 2 Ca(OH) 2 +2HCl=== CaCl 2 +2H 2 O(合理即可) CaCO 3 +2HCl=== CaCl 2 +H 2 O+CO 2 ↑ CaCl 2 +Na 2 CO 3 === CaCO 3 ↓+2NaCl(合理即可) Ca(OH) 2 +CO 2 === CaCO 3 ↓+H 2 O(合理即可) CaCO 3 === CaO+ CO 2 ↑ 高温查看更多