2021届高考化学一轮复习电解质溶液的图像分析学案
考情剖析 电解质溶液中的图像能把抽象的溶液中平衡理论形象地表述出来,借助图形可以更直观地认识到外界条件对溶液中离子平衡的影响。纵观近年高考试题,电解质溶液图像题越来越受到命题者的青睐。除2014年全国卷Ⅰ第11题和2015年浙江卷第12题、29题,2015年山东卷第13题、2015年福建卷第23题、2015年广东卷第11题、2015年海南卷第11题、2015年江苏卷第18题等考查外,全国卷近四年考查情况:
年份
2018
2017
2016
2015
题号
全国卷Ⅲ第12题
全国卷Ⅰ第13题、全国卷Ⅱ第12题、全国卷Ⅲ第13题、全国卷Ⅲ第27题
全国卷Ⅰ第12题
全国卷Ⅰ第13题
增分点一 滴定曲线类图像
【解题策略】 本类题纵坐标是溶液的pH,横坐标一般是加入某一溶液的体积,2017年全国卷Ⅰ出现了横坐标是离子浓度的变化。一般分三步解答本类试题时,第一步总体读图,通过观察弄清横坐标的含义及单位;第二步是识图,注意特殊点的意义图像含义,分析曲线的变化趋势弄清pH变化的原因;第三步是分析,进行信息提取,挖掘隐含信息、排除干扰信息、提炼有用信息,在统摄信息的基础上进行逻辑推理或运用数据计算分析。
图Z10-1
例1 25 ℃时,将0.1 mol·L-1 NaOH溶液加入20 mL 0.1 mol·L-1 CH3COOH溶液中,所加入溶液的体积(V)和混合液的pH的关系曲线如图Z10-1所示。下列结论正确的是 ( )
A.①点时,c(CH3COO-)+c(CH3COOH)=c(Na+)
B.对曲线上①②③任何一点,溶液中都有c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C.③点时,醋酸恰好反应完,溶液中有c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D.滴定过程中可能出现c(H+)>c(Na+)>c(CH3COO-)>c(OH-)
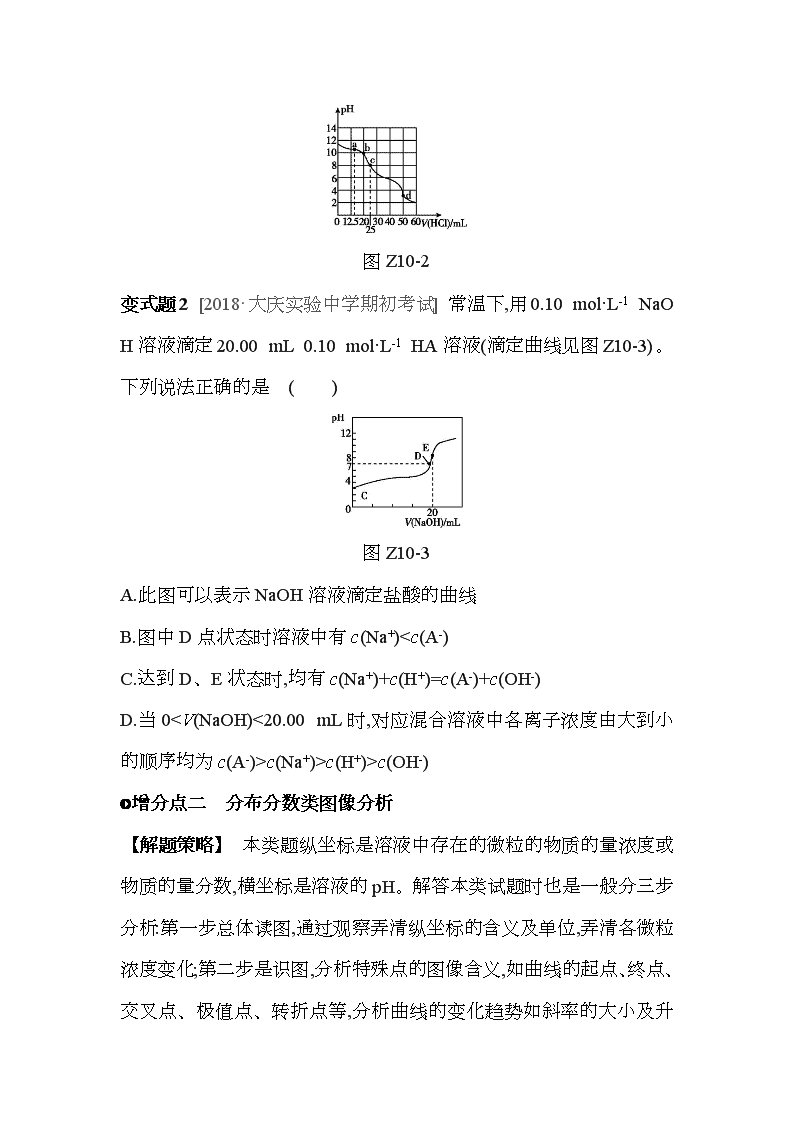
变式题1 [2018·山东青州三模] 在常温下,用0.100 0 mol·L-1的盐酸滴定25 mL 0.100 mol·L-1 Na2CO3溶液,所得滴定曲线如图Z10-2所示。下列相关微粒浓度间的关系不正确的是( )
A.a点:c(CO32-)>c(Cl-)>c(HCO3-)
B.b点:c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+2c(CO32-)+c(OH-)
C.c点:c(OH-)+c(CO32-)=c(H+)+c(H2CO3)
D.d点:c(Cl-)=c(Na+)
图Z10-2
变式题2 [2018·大庆实验中学期初考试] 常温下,用0.10 mol·L-1 NaOH溶液滴定20.00 mL 0.10 mol·L-1 HA溶液(滴定曲线见图Z10-3)。下列说法正确的是 ( )
图Z10-3
A.此图可以表示NaOH溶液滴定盐酸的曲线
B.图中D点状态时溶液中有c(Na+)
c(Na+)>c(H+)>c(OH-)
增分点二 分布分数类图像分析
【解题策略】 本类题纵坐标是溶液中存在的微粒的物质的量浓度或物质的量分数,横坐标是溶液的pH。解答本类试题时也是一般分三步分析:第一步总体读图,通过观察弄清纵坐标的含义及单位,弄清各微粒浓度变化;第二步是识图,分析特殊点的图像含义,如曲线的起点、终点、交叉点、极值点、转折点等,
分析曲线的变化趋势如斜率的大小及升降;第三步是分析,进行信息提取,挖掘隐含信息、排除干扰信息、提炼有用信息,在统摄信息的基础上进行逻辑推理或运用数据计算分析。
例2 [2017·浙江4月选考] 25 ℃时,在含CH3COOH和CH3COO-的溶液中,CH3COOH、CH3COO-二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图Z10-4所示。下列说法不正确的是 ( )
图Z10-4
A.在pH<4.76的溶液中,c(CH3COO-)4.76的溶液中,c(CH3COO-)与c(OH-)之和可大于c(H+)
D.在pH=4.76的溶液中加盐酸,α(CH3COOH)与α(CH3COO-)之和保持不变
变式题1 [2017·全国卷Ⅱ] 改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图Z10-5所示[已知δ(X)=c(X)c(H2A)+c(HA-)+c(A2-)]。下列叙述错误的是( )
图Z10-5
A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
变式题2 [2018·沧州质量监测] 常温下,将HCl气体通入到1 L浓度均为0.1 mol·L-1的NaA和NaB的混合溶液中,混合溶液的pH与离子浓度变化的关系如图Z10-6所示(忽略溶液体积的变化)。下列叙述不正确的是 ( )
图Z10-6
A.Ka(HB)的数量级为10-9
B.酸性的强弱顺序为HCl>HA>HB
C.当通入0.1 mol HCl气体时,c(B-)>c(A-)
D.当混合溶液呈中性时,c(Na+)=c(Cl-)+c(A-)+c(B-)
1.[2015·山东卷] 室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液,pH的变化曲线如图Z10-7所示。下列说法正确的是 ( )
图Z10-7
A.a点所示溶液中,c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中c(A-)>c(HA)
图Z10-8
2.[2018·辽宁六校协作体初联考] 25 ℃,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图Z10-8所示。下列有关叙述正确的是 ( )
A.pH=5.5的溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B.W点所示溶液中:2c(Na+)=c(CH3COO-)+c(CH3COOH)
C.pH=3.75的溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.只根据图中数据,无法计算出25 ℃时醋酸的电离平衡常数
3.[2015·浙江卷] 40 ℃,在氨-水体系中不断通入CO2,各种离子的变化趋势如图Z10-9所示。
图Z10-9
下列说法不正确的是 ( )
A.在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-)
B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)
C.随着CO2的通入,c(OH-)c(NH3·H2O)不断增大
D.在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
4.(1)[2017·江苏卷节选] H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图Z10-10(a)和图Z10-10(b)所示。
(a)
(b)
图Z10-10
①以酚酞为指示剂(变色范围pH 8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为 。
②H3AsO4第一步电离方程式H3AsO4 ⇌H2AsO4-+H+的电离常数为Ka1,则pKa1= (pKa1=-lgKa1)。
(2)金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度[S/(mol·L-1)]如图Z10-11所示。
难溶金属氢氧化物的S-pH图
图Z10-11
①pH=3时溶液中铜元素的主要存在形式是 。
②若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH (填字母)。
A.<1 B.在4左右 C.>6
③在Ni(NO3)2溶液中含有少量的Co2+杂质, (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是 。
④已知一些难溶物的溶度积常数如下表:
物质
FeS
MnS
CuS
Ksp
6.3×10-18
2.5×10-13
1.3×10-35
物质
PbS
HgS
ZnS
Ksp
3.4×10-28
6.4×10-33
1.6×10-24
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的 (填选项)。
A.NaOH B.FeS C.Na2S
【增分典例探究】
例1 B [解析] 本题图像是将NaOH溶液加入CH3COOH溶液中,所得混合溶液的pH与加入NaOH溶液体积的关系图,分析时应注意各点溶质的分析。
在曲线上①点时混合溶液为等物质的量浓度的CH3COONa和CH3COOH溶液,根据物料守恒c(CH3COO-)+c(CH3COOH)=2c(Na+),A项错误。曲线上①②③点溶液中均存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),B项正确。③点时,NaOH与CH3COOH恰好完全反应,溶液呈碱性,则存在c(Na+)>c(CH3COO-)>c(OH-)>c(H+),C项错误。滴定过程中,溶液中均存在离子CH3COO-、Na+、H+、OH-,根据溶液电中性原则知,D项错误。
变式题1 A [解析] a点n(HCl)=0.100 0 mol·L-1×0.012 5 L=0.001 25 mol,n(Na2CO3)=0.100 0 mol·L-1×0.025 L=0.002 5 mol,反应生成0.001 25 mol NaCl和NaHCO3,剩余0.001 25 mol Na2CO3,碳酸根离子水解程度大于碳酸氢根离子,所以c(CO32-)c(Cl-)>c(CO32-),A不正确;b点时根据电荷守恒可知c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+2c(CO32-)+c(OH-),B正确;c点时n(HCl)=0.1 mol·L-1×0.025 L=0.002 5 mol,恰好完全反应生成NaHCO3,根据质子守恒得c(OH-)+c(CO32-)=c(H+)+c(H2CO3),C正确;d点n(HCl)=0.100 0 mol·L-1×0.050 L=0.005 mol,为碳酸钠物质的量的二倍,二者反应方程式为 Na2CO3+2HCl=2NaCl+CO2↑+H2O,溶液中的溶质为NaCl,根据物料守恒得c(Cl-)=c(Na+),D正确。
变式题2 C [解析] 0.10 mol·L-1 HCl溶液pH=1,此图开始时溶液的pH≠1,A项错误;溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(A-),D点溶液呈中性,c(H+)=c(OH-),此时c(Na+)=c(A-),B项错误;达到D、E状态时溶液中均存在电荷守恒式c(Na+)+c(H+)=c(A-)+c(OH-),C项正确;在滴加NaOH溶液的过程中,混合溶液从酸性过渡到中性、碱性,D项错误。
例2 B [解析] 由图可知:当pH=4.76时,n(CH3COOH)=n(CH3COO-),在同一体系中,c(CH3COOH)=c(CH3COO-),且溶液中存在平衡CH3COOH⇌CH3COO-+H+。当pH<4.76时,即增大了c(H+),电离平衡朝逆方向移动,c(CH3COOH)增大,c(CH3COO-)减小,即c(CH3COO-)c(H+),C正确;根据原子守恒,α(CH3COOH)+α(CH3COO-)=1恒成立,故D正确。
变式题1 D [解析] 根据图像可知,pH=1.2时H2A曲线和HA-曲线相交,则有c(H2A)=c(HA-),A项正确; pH=4.2时,K2(H2A)=c(H+)c(A2-)c(HA-)=c(H+)=10-4.2,lg[K2(H2A)]=-4.2,B项正确; pH=2.7时,H2A曲线和A2-
曲线相交,则有c(H2A)=c(A2-),C项正确;pH=4.2时,c(HA-)=c(A2-),且物质的量分数约为0.48,c(H+)=10-4.2,因此c(HA-)=c(A2-)>c(H+),D项错误。
变式题2 C [解析] 根据图像可知,当lg c(HB)c(B-)=3时,pH=6,此时,c(H+)=10-6 mol·L-1,c(HB)c(B-)=103,Ka(HB)=c(H+)·c(B-)c(HB)=10-6×10-3=10-9,故A项正确;pH一定时,lg c(HB)c(B-)>lg c(HA)c(A-),则有c(HB)c(B-)>c(HA)c(A-),c(B-)c(HB)HB,向NaA和NaB的混合溶液中通入HCl后,溶液中存在HA、HB,则说明HCl酸性强于HA和HB,所以酸性强弱顺序为HCl>HA>HB,故B项正确;原溶液中NaA和NaB均为0.1 mol,根据强酸制弱酸原理,通入0.1 mol HCl,H+先与B-反应,反应后溶液中溶质为0.1 mol NaA、0.1 mol NaCl、0.1 mol HB,NaA完全电离,微弱水解,而HB部分电离,所以溶液中c(B-)c(A-)>c(OH-)>c(HA),A项错误;a点为NaA溶液,由于A-发生水解,促进水的电离,而b点是HA和NaA的混合溶液,水的电离程度比a点小,B项错误;根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+c(A-),pH=7时c(Na+)=c(A-),C项错误;b点溶液为等物质的量浓度的HA和NaA的混合溶液,由于溶液的pH=4.7,说明HA的电离大于NaA的水解,故
c(A-)>c(HA),D项正确。
2.A [解析] pH=5.5的溶液中存在的电荷守恒式为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),A项正确;溶液存在电荷守恒,应为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),W点时溶液显酸性,c(H+)>c(OH-),则c(Na+)c(Na+),C项错误;根据图中数据,W点c(CH3COOH)=c(CH3COO-),平衡常数K=c(CH3COO-)·c(H+)c(CH3COOH)=10-4.75,D项错误。
3.C [解析] 在图中pH=9处作一垂线,不难得出关系式c(NH4+ )>c(HCO3-)>c(NH2COO-)>c(CO32-),A项正确;溶液中存在的所有阴、阳离子遵循电荷守恒,即c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-),在不同的pH处,有些离子浓度小,可以忽略,但是电荷守恒式仍然存在,B项正确;氨水的电离平衡常数Kb=c(NH4+)·c(OH-)c(NH3·H2O),Kb仅与温度有关,从图中知,通入CO2,酸性增强,pH减小时,c(NH4+)增多,故c(OH-)c(NH3·H2O)减小,C项错误;从图知,溶液pH不断降低的过程中,c(NH2COO-)先增大再减小,即可说明有含NH2COO-的中间产物生成,D项正确。
4.(1)①OH-+H3AsO3=H2AsO3-+H2O ②2.2 (2)①Cu2+ ②B
③不能 Co2+和Ni2+沉淀的pH范围相差太小 ④B
[解析] (1)①由题图可知pH由小变大时,H3AsO3浓度减小,H2AsO3-浓度增大,当溶液由无色变为浅红色时,主要反应的离子方程式为OH-
+H3AsO3=H2AsO3-+H2O;②由图(b)可知,当pH=2.2时,c(H3AsO4)=c(H2AsO4-),Ka1=c(H+)·c(H2AsO4-)c(H3AsO4),则Ka1=10-2.2,pKa1=-lgKa1=2.2。(2)①由图可知,在pH=3时溶液中不会出现Cu(OH)2沉淀,铜元素主要以Cu2+形式存在;②要除去Fe3+的同时必须保证Cu2+不能沉淀,因此pH应保持在4左右;③从图示关系可以看出,Co2+和Ni2+沉淀的pH范围相差太小,不能通过调节pH而达到分离的目的;④要使三种离子生成沉淀,最好选择难溶于水的FeS,使三种杂质离子转化为更难溶解的金属硫化物沉淀,同时又不会引入其他离子。