- 2021-05-19 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习化学反应速率学案
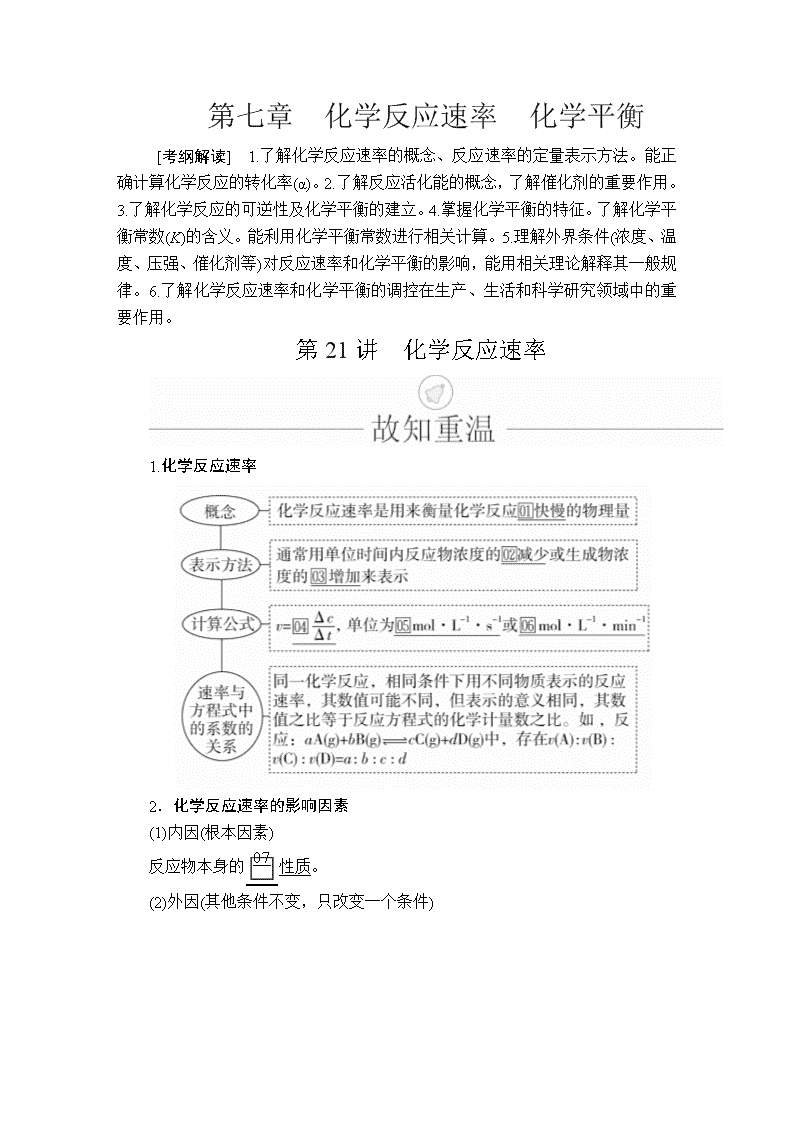
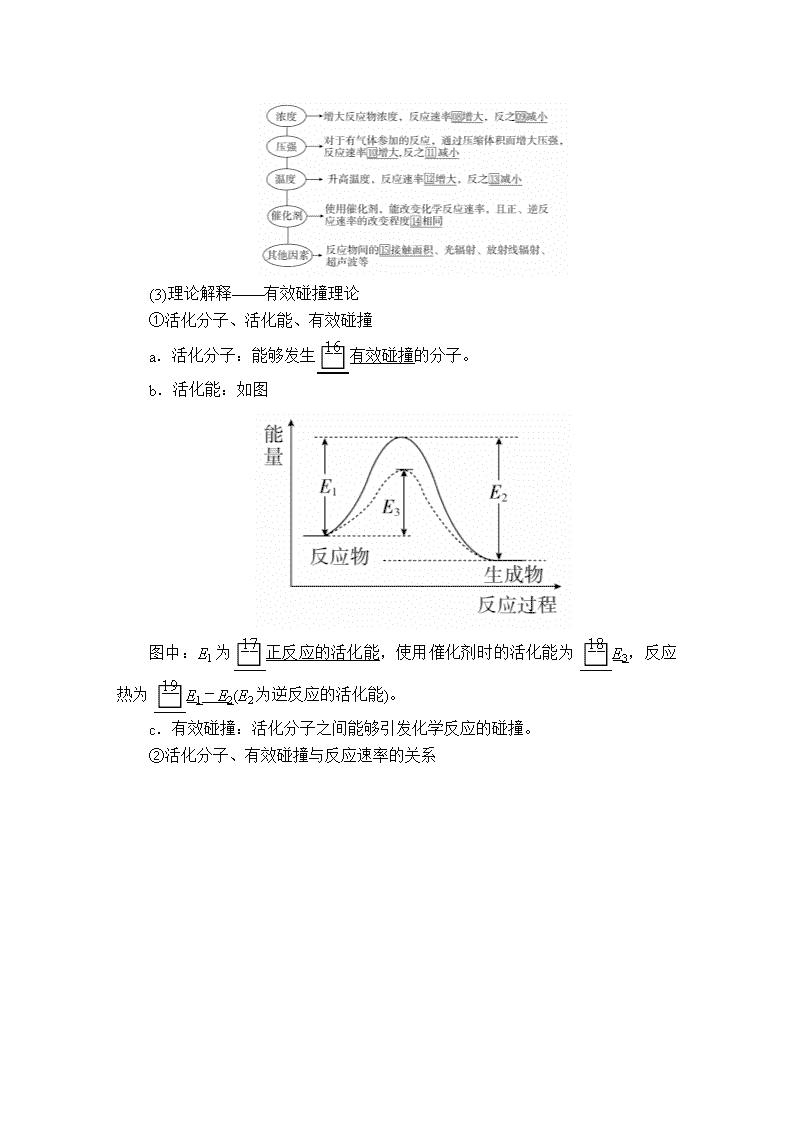
第七章 化学反应速率 化学平衡 [考纲解读] 1.了解化学反应速率的概念、反应速率的定量表示方法。能正确计算化学反应的转化率(α)。2.了解反应活化能的概念,了解催化剂的重要作用。3.了解化学反应的可逆性及化学平衡的建立。4.掌握化学平衡的特征。了解化学平衡常数(K)的含义。能利用化学平衡常数进行相关计算。5.理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,能用相关理论解释其一般规律。6.了解化学反应速率和化学平衡的调控在生产、生活和科学研究领域中的重要作用。 第21讲 化学反应速率 1.化学反应速率 2.化学反应速率的影响因素 (1)内因(根本因素) 反应物本身的性质。 (2)外因(其他条件不变,只改变一个条件) (3)理论解释——有效碰撞理论 ①活化分子、活化能、有效碰撞 a.活化分子:能够发生有效碰撞的分子。 b.活化能:如图 图中:E1为正反应的活化能,使用催化剂时的活化能为E3,反应热为E1-E2(E2为逆反应的活化能)。 c.有效碰撞:活化分子之间能够引发化学反应的碰撞。 ②活化分子、有效碰撞与反应速率的关系 1.判断正误,正确的画“√”,错误的画“×”,并指明错因。 (1)化学反应速率为0.8 mol·L-1·s-1是指1 s时某物质的浓度为0.8 mol·L-1。(×) 错因:化学反应速率是指单位时间内的平均速率。 (2)温度、催化剂能改变活化分子的百分数。(√) 错因:_______________________________________________ (3)同一化学反应,相同条件下用不同物质表示的反应速率,数值越大,表示化学反应速率越快。(×) 错因:同一反应相同条件下用不同物质表示的反应速率可能不同,但反应的快慢相同。 (4)增大反应体系的压强,反应速率不一定增大。(√) 错因:_________________________________________________ (5)增大反应物的浓度,能够增大活化分子的百分含量,所以反应速率增大。(×) 错因:增大反应物的浓度,活化分子的百分含量不变。 (6)对可逆反应FeCl3+3KSCNFe(SCN)3+3KCl,增加氯化钾浓度,逆反应速率加快。(×) 错因:该反应的离子方程式为Fe3++3SCN-Fe(SCN)3,所以改变KCl的量对该反应无影响。 (7)固体和纯液体的浓度是固定的,增加固体或纯液体的用量,反应速率保持不变。(√) 错因:____________________________________________________ (8)已知反应①N2+3H22NH3 ΔH<0,反应②C+CO2===2CO ΔH >0,升温时,反应①速率增大,反应②速率减小。(×) 错因:升高温度时,反应①、②的速率均增加。 2.教材改编题 (据人教选修四P19 T5)某温度下,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,经t min后,测得各物质的浓度分别为c(X2)=0.4 mol·L-1,c(Y2)=0.6 mol·L-1,c(Z)=0.4 mol·L-1,则该反应的化学方程式可表示为( ) A.2X2+3Y22X2Y3 B.3X2+2Y22X3Y2 C.X2+2Y22XY2 D.2X2+Y22X2Y 答案 B 考点 化学反应速率及有关的计算 [典例1] (2018·南昌模拟)反应4A(s)+3B(g)2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的正确表示是( ) A.用A表示的反应速率是0.8 mol·L-1·s-1 B.分别用B、C、D表示的反应速率,其比值是3∶2∶1 C.在2 min末时的反应速率,用反应物B来表示是0.3 mol·L-1·min-1 D.在这2 min内用B和C表示的反应速率的值都是相同的 解析 A项,A物质是固体,浓度视为常数,不能用来表示反应速率,错误;化学反应速率之比等于相应物质的化学计量数之比,其比值为3∶2∶1,B正确、D错误;C项,v(B)= mol·L-1·min-1=0.3 mol·L-1·min-1,但化学反应速率是平均速率,不是瞬时速率,错误。 答案 B 名师精讲 1.有关化学反应速率的注意事项 (1)化学反应速率一般指平均速率而不是某一时刻的瞬时速率,且无论用反应物还是用生成物表示均取正值。 (2)不能用固体或纯液体物质表示化学反应速率,因为固体或纯液体物质的浓度视为常数。 2.化学反应速率计算的三个方法 (1)定义式法:v(B)==。 (2)比例关系法:化学反应速率之比等于化学计量数之比,如mA(g)+nB(g)===pC(g)中,v(A)∶v(B)∶v(C)=m∶n∶p。 (3)三段式法:列起始量、转化量、最终量,再根据定义式或比例关系计算。 3.化学反应速率大小的比较方法 (1)同一物质比较法。换算成同一物质表示的速率,再比较数值的大小。 (2)归一法。当化学反应速率单位一致时,可用各物质的速率除以该物质前面的化学计量数,即全部“归一”,然后比较,数值大的反应速率最大。 注意 无论采用何种方法,都要确保所比较物质的速率单位统一。 1.(2018·长沙模拟)反应A(g)+3B(g)===2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.45 mol·L-1·s-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1。 下列有关反应速率的比较中正确的是( ) A.④>③=②>① B.①>④>②=③ C.①>②>③>④ D.④>③>②>① 答案 B 解析 用比值法进行反应速率大小的比较,v(A)=0.45 mol·L-1·s-1;v(B)=×0.6=0.2 mol·L-1·s-1;v(C)=×0.4=0.2 mol·L-1·s-1;v(D)=×0.45=0.225 mol·L-1·s-1,故①>④>②=③,B项正确。 2.一定温度下,向一个容积为2 L的真空密闭容器中(事先装入催化剂)通入1 mol N2和3 mol H2,3 min后测得密闭容器内的压强是起始时的0.9倍,在此时间内v(H2)是 ( ) A.0.2 mol/(L·min) B.0.6 mol/(L·min) C.0.1 mol/(L·min) D.0.3 mol/(L·min) 答案 C 解析 考点 化学反应速率的影响因素 [典例2] (2018·江南十校联考)反应C(s)+H2O(g)CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是 ( ) ①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大 A.①④ B.②③ C.①③ D.②④ 解析 ①固体用量的改变对速率几乎没有影响,正确;②容器的体积缩小一半,压强增大,速率增大,错误;③保持体积不变,充入N2使体系压强增大,但各物质的浓度保持不变,速率不变,正确;④保持压强不变,充入N2使容器体积变大,各物质的浓度减小,速率减小,错误。 答案 C 名师精讲 1.外界因素对速率的影响的几点说明(其他条件不变,只改变一个条件) (1)升高温度,不论是放热反应还是吸热反应,化学反应速率均加快。 (2)催化剂能同等程度的改变正、逆化学反应速率,但不能改变反应进行的程度。 (3)压强及惰性气体对化学反应速率的影响 ①改变压强,实质是通过改变物质的浓度来实现化学反应速率改变的。若压强改变导致了反应物浓度增大或减小,则化学反应速率会增大或减小。 ②根据上述第① 条原则,充入惰性气体对化学反应速率的影响可分为以下两种情况: ③对于没有气体参加的反应,改变体系压强,反应物的浓度不变,则化学反应速率不变。 (4)固体反应物量的增减,不能改变化学反应速率,固体的表面积改变才能改变化学反应速率。 2.“控制变量法”的解题方法 3.(2018·石家庄四校联考)等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图。根据图示分析实验条件,下列说法中一定不正确的是( ) A.第4组实验的反应速率最慢 B.第1组实验中盐酸的浓度大于2.5 mol·L-1 C.第2组实验中盐酸的浓度等于2.5 mol·L-1 D.第3组实验的反应温度低于30 ℃ 答案 D 解析 从图中四条曲线可判断a反应最快,d反应最慢,A项正确;第1、2、4组实验温度相同,1、2组铁为粉末状,反应速率:1>2>4,故第1组实验中盐酸浓度大于2.5 mol·L-1,第2组实验中盐酸的浓度等于2.5 mol·L-1,B、C正确;若第3组实验的温度低于30 ℃,在其他条件都相同的情况下反应速率应该比第4组慢,与实验事实不符,D项错误。 4.草酸与高锰酸钾在酸性条件下能够发生如下反应: MnO+H2C2O4+H+―→Mn2++CO2↑+H2O(未配平) 用4 mL 0.001 mol·L-1KMnO4溶液与2 mL 0.01 mol·L-1 H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如表所示: (1)该反应中氧化剂和还原剂的物质的量之比为__________。 (2)如果研究催化剂对化学反应速率的影响,使用实验________和________(用Ⅰ~Ⅳ表示,下同):如果研究温度对化学反应速率的影响,使用实验______和______。 (3)对比实验Ⅰ和Ⅳ,可以研究____________对化学反应速率的影响,实验Ⅳ中加入1 mL蒸馏水的目的是____________。 答案 (1)2∶5 (2)Ⅰ Ⅱ Ⅰ Ⅲ (3)c(H+)(或硫酸溶液的浓度) 确保所有实验中c(KMnO4)、c(H2C2O4)不变和总体积不变 解析 (1)MnOMn2+,H2C2O42CO2。 根据氧化还原反应中氧化剂得电子数目等于还原剂失电子数目可确定MnO与H2C2O4的物质的量之比为2∶5。 (2)实验Ⅰ与实验Ⅱ中反应物浓度相同,温度相同,实验Ⅱ中加入MnSO4溶液,应是研究催化剂对化学反应速率的影响,实验Ⅰ与实验Ⅲ中温度不同,其他条件相同,应是对比考查温度对化学反应速率的影响。 (3)实验Ⅰ与实验Ⅳ相比,实验Ⅳ中H2SO4的浓度不同,是研究c(H+)对反应速率的影响。查看更多