2020届高考化学一轮复习化学能与热能作业(4)
课时作业
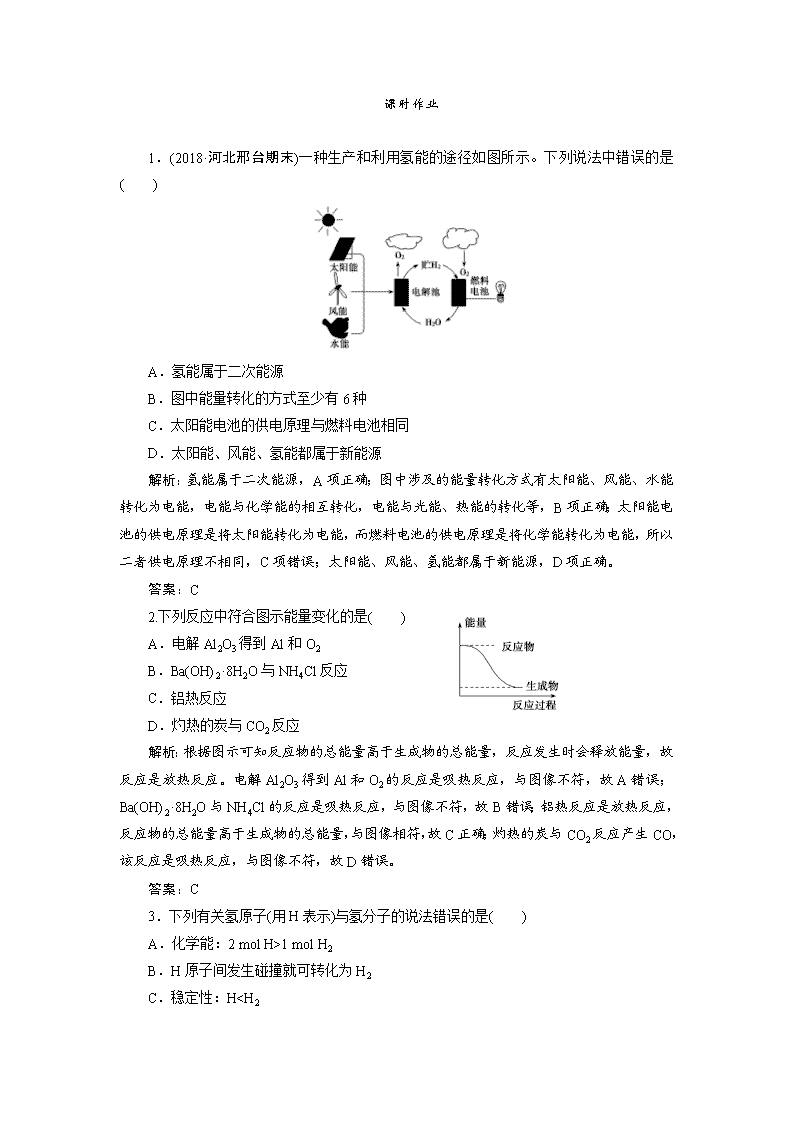
1.(2018·河北邢台期末)一种生产和利用氢能的途径如图所示。下列说法中错误的是 ( )
A.氢能属于二次能源
B.图中能量转化的方式至少有6种
C.太阳能电池的供电原理与燃料电池相同
D.太阳能、风能、氢能都属于新能源
解析:氢能属于二次能源,A项正确;图中涉及的能量转化方式有太阳能、风能、水能转化为电能,电能与化学能的相互转化,电能与光能、热能的转化等,B项正确;太阳能电池的供电原理是将太阳能转化为电能,而燃料电池的供电原理是将化学能转化为电能,所以二者供电原理不相同,C项错误;太阳能、风能、氢能都属于新能源,D项正确。
答案:C
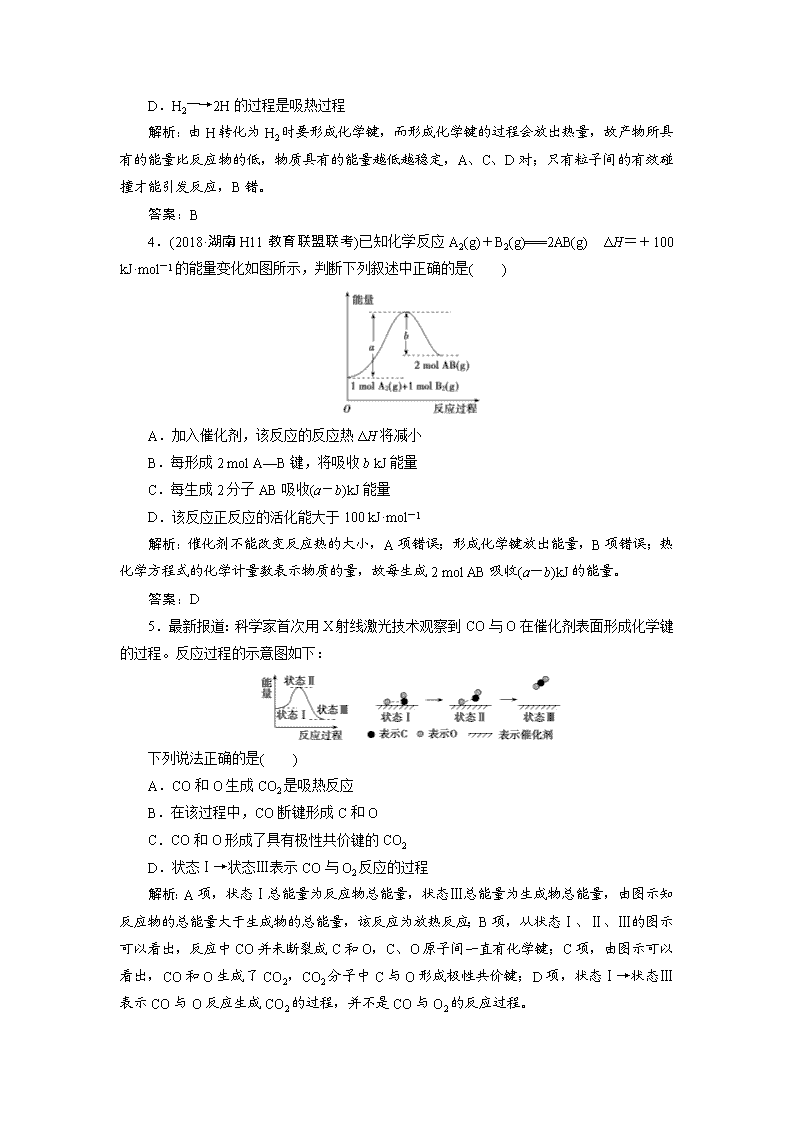
2.下列反应中符合图示能量变化的是( )
A.电解Al2O3得到Al和O2
B.Ba(OH)2·8H2O与NH4Cl反应
C.铝热反应
D.灼热的炭与CO2反应
解析:根据图示可知反应物的总能量高于生成物的总能量,反应发生时会释放能量,故反应是放热反应。电解Al2O3得到Al和O2的反应是吸热反应,与图像不符,故A错误;Ba(OH)2·8H2O与NH4Cl的反应是吸热反应,与图像不符,故B错误;铝热反应是放热反应,反应物的总能量高于生成物的总能量,与图像相符,故C正确;灼热的炭与CO2反应产生CO,该反应是吸热反应,与图像不符,故D错误。
答案:C
3.下列有关氢原子(用H表示)与氢分子的说法错误的是( )
A.化学能:2 mol H>1 mol H2
B.H原子间发生碰撞就可转化为H2
C.稳定性:H
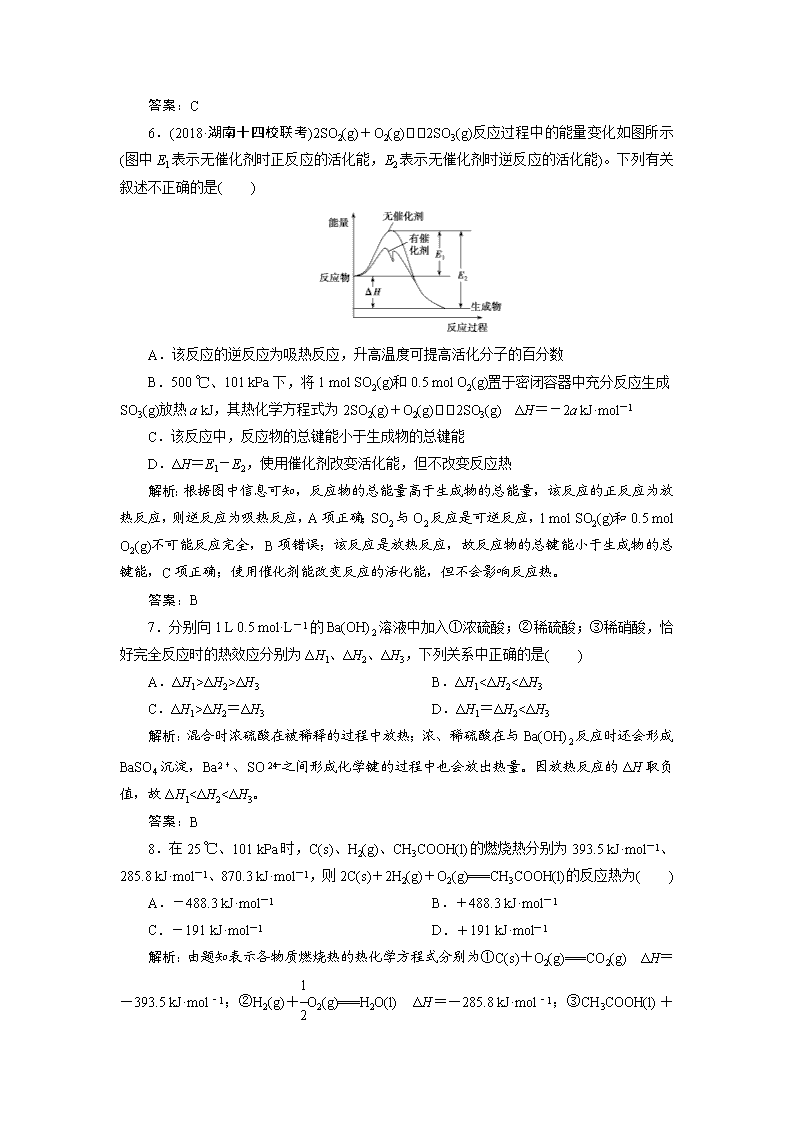
ΔH2>ΔH3 B.ΔH1<ΔH2<ΔH3
C.ΔH1>ΔH2=ΔH3 D.ΔH1=ΔH2<ΔH3
解析:混合时浓硫酸在被稀释的过程中放热;浓、稀硫酸在与Ba(OH)2反应时还会形成BaSO4沉淀,Ba2+、SO之间形成化学键的过程中也会放出热量。因放热反应的ΔH取负值,故ΔH1<ΔH2<ΔH3。
答案:B
8.在25 ℃、101 kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ·mol-1、285.8 kJ·mol-1、870.3 kJ·mol-1,则2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )
A.-488.3 kJ·mol-1 B.+488.3 kJ·mol-1
C.-191 kJ·mol-1 D.+191 kJ·mol-1
解析:由题知表示各物质燃烧热的热化学方程式分别为①C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1;②H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1;③CH3COOH(l)
+2O2(g)===2CO2(g)+2H2O(l) ΔH=-870.3 kJ·mol-1。则2C(s)+2H2(g)+O2(g)===CH3COOH(l)可由反应①×2+②×2-③得出,则反应热为-393.5 kJ·mol-1×2+(-285.8 kJ·mol-1×2)-(-870.3 kJ·mol-1)=-488.3 kJ·mol-1。
答案:A
9.已知丙烷的燃烧热ΔH=-2 215 kJ·mol-1。若一定量的丙烷完全燃烧后生成1.8 g水,则放出的热量约为( )
A.55 kJ B.220 kJ
C.550 kJ D.1 108 kJ
解析:由丙烷的燃烧热ΔH=-2 215 kJ·mol-1,可写出其燃烧的热化学方程式C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-2 215 kJ·mol-1,丙烷完全燃烧产生1.8 g水,n(H2O)===0.1 mol,所以反应放出的热量Q=0.1 mol×≈55 kJ,A项正确。
答案:A
10.常温下,1 mol化学键分解成气态原子所需要的能量用E表示。结合表中信息判断下列说法不正确的是( )
共价键
H—H
F—F
H—F
H—Cl
H—I
E/(kJ·mol-1)
436
157
568
432
298
A.432 kJ·mol-1>E(H—Br)>298 kJ·mol-1
B.表中最稳定的共价键是H—F键
C.H2(g)―→2H(g) ΔH=+436 kJ·mol-1
D.H2(g)+F2(g)===2HF(g) ΔH=-25 kJ·mol-1
解析:观察表中数据知,氟、氯、碘与氢原子形成的化学键的键能逐渐减小,故432 kJ·mol-1>E(H—Br)>298 kJ·mol-1,A项正确;表中H—F共价键的键能最大,即H—F共价键最稳定,B项正确;H2(g)―→2H(g),共价键断裂要吸收能量,即H2(g)―→2H(g) ΔH=+436 kJ·mol-1,C项正确;反应H2(g)+F2(g)===2HF(g)的反应热ΔH=436+157-2×568=-543 (kJ·mol-1),D项不正确。
答案:D
11.常温下,0.01 mol·L-1MOH溶液的pH为10。已知:2MOH(aq)+H2SO4(aq)===M2SO4(aq)+2H2O(l) ΔH1=-24.2 kJ·mol-1;H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ·mol-1。
则MOH在水溶液中电离的ΔH为( )
A.+33.1 kJ·mol-1 B.+45.2 kJ·mol-1
C.-81.5 kJ·mol-1 D.-33.1 kJ·mol-1
解析:常温下,0.01 mol·L-1MOH溶液的pH为10,说明MOH为弱碱。
①2MOH(aq)+2H+(aq)===2M+(aq)+2H2O(l) ΔH1=-24.2 kJ·mol-1
②H+(aq)+OH-(aq)===H2O(l) ΔH2=
-57.3 kJ·mol-1
根据盖斯定律,[①-②×2]/2可得:MOH(aq)M+(aq)+OH-(aq) ΔH=+45.2 kJ·mol-1。
答案:B
12.为探究NaHCO3、Na2CO3分别与1 mol·L-1盐酸反应(设两反应分别是反应Ⅰ、反应Ⅱ)过程中的热效应,进行实验并测得如下数据:
序号
液体
固体
混合前温度
混合后最高温度
①
35 mL水
2.5 g NaHCO3
20 ℃
18.5 ℃
②
35 mL水
3.2 g Na2CO3
20 ℃
24.3 ℃
③
35 mL盐酸
2.5 g NaHCO3
20 ℃
16.2 ℃
④
35 mL盐酸
3.2 g Na2CO3
20 ℃
25.1 ℃
下列有关说法正确的是( )
A.仅通过实验③即可判断反应Ⅰ是吸热反应
B.仅通过实验④即可判断反应Ⅱ是放热反应
C.通过实验可判断出反应Ⅰ、Ⅱ分别是吸热反应、放热反应
D.通过实验可判断出反应Ⅰ、Ⅱ分别是放热反应、吸热反应
解析:通过实验①可判断出NaHCO3溶于水吸热,通过实验①③可判断出NaHCO3与盐酸反应是吸热反应;通过实验②可判断出Na2CO3溶于水放热,通过实验②④可判断出Na2CO3与盐酸反应是放热反应。综上所述,可判断出反应Ⅰ、Ⅱ分别是吸热反应、放热反应,C项正确。
答案:C
13.碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
ΔH=+88.6 kJ·mol-1。则M、N相比,较稳定的是________。
(2)已知CH3OH(l)的燃烧热ΔH=-726.5 kJ·mol-1,CH3OH(l)+O2(g)===CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a________726.5(填“>”“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2
参与反应时释放出145 kJ热量,写出该反应的热化学方程式:_______________________________________
________________________________________________________________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可做耐高温材料,4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为________。
解析:(1)M转化为N是吸热反应,所以N的能量高,不稳定。(2)甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量少,故a<726.5。(3)反应的化学方程式为2Cl2+2H2O+C===4HCl+CO2,当有2 mol Cl2参与反应时释放出290 kJ热量,所以该反应的热化学方程式为2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g) ΔH=-290 kJ·mol-1。(4)所给反应中共转移12 mol电子,故每转移1 mol电子放出的热量为1 176 kJ÷12=98 kJ。
答案:(1)M (2)<
(3)2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g) ΔH=-290 kJ·mol-1
(4)98 kJ
14.某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行反应热的测定。
(1)写出该反应的热化学方程式[生成1 mol H2O(l)时的反应热为-57.3 kJ·mol-1]:
________________________________________________________________________
________________________________________________________________________。
(2)取50 mL NaOH溶液和30 mL 硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
温度
次数
起始温度t1/℃
终止温度t2/℃
温度差平均值(t2-t1)/℃
H2SO4
NaOH
平均值
1
26.2
26.0
26.1
30.1
2
27.0
27.4
27.2
33.3
3
25.9
25.9
25.9
29.8
4
26.4
26.2
26.3
30.4
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1.0 g·mL-1,中和后生成溶液的比热容c=4.18 J/(g·℃)。则生成1 mol H2O(l)时的反应热ΔH=________(取小数点后一位)。
③上述实验数值结果与-57.3 kJ·mol-1有偏差,产生偏差的原因不可能是(
填字母)________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
解析:(2)①第2组数据偏差较大,应舍去,其他三组的温度差平均值为4.0 ℃。
②ΔH=-=
-53.5(kJ·mol-1)。
③放出的热量小可能是散热、多次加入碱或起始温度读的较高等原因。
答案:(1)H2SO4(aq)+2NaOH(aq)===Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
(2)①4.0 ②-53.5 kJ·mol-1 ③b
15.氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料。
(1)纳米级的Cu2O可作为太阳光分解水的催化剂。一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.10 mol水蒸气发生反应:2H2O(g)2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时段产生O2的量见表格:
时间/min
20
40
60
80
n(O2)/mol
0.001 0
0.001 6
0.002 0
0.002 0
上述反应过程中能量转化形式为光能转化为________能,达平衡过程中至少需要吸收光能________kJ(保留三位小数)。
(2)氢气是合成氨工业的原料,合成塔中每产生2 mol NH3,放出92.2 kJ热量。已知:
则1 mol N—H键断裂吸收的能量约等于________。
解析:(1)题述反应过程中能量转化形式为光能转化为化学能,达平衡时,生成氧气0.002 mol,至少需要吸收的光能为0.002 mol×484 kJ·mol-1=0.968 kJ。
(2)3H2(g)+N2(g)2NH3(g),反应的焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量=3×436 kJ·mol-1+945.8 kJ·mol-1-6×E(N—H)=-92.2 kJ·mol-1,E(N—H)=391 kJ·mol-1。
答案:(1)化学 0.968 (2)391 kJ