- 2021-05-19 发布 |
- 37.5 KB |
- 22页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
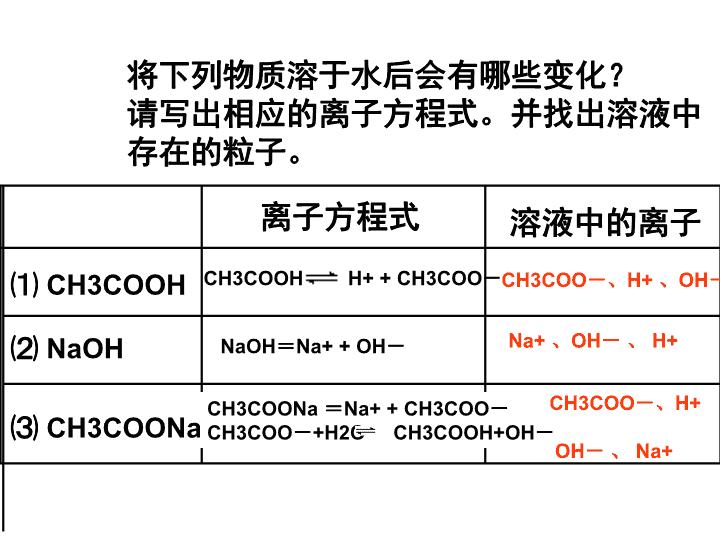
高中化学 离子浓度
将下列物质溶于水后会有哪些变化? 请写出相应的离子方程式。并找出溶液中 存在的粒子。 ⑴ CH3COOH 离子方程式 溶液中的离子 ⑵ NaOH ⑶ CH3COONa NaOH=Na+ + OH- CH3COONa =Na+ + CH3COO- CH3COO-+H2O CH3COOH+OH- Na+ 、OH- 、 H+ CH3COO-、H+ 、OH-CH3COOH H+ + CH3COO- CH3COO-、H+ OH- 、 Na+ 电解质溶液中的离子来源是: 1、电解质的电离过程。 (包括溶质的电离和水的电离) 2、弱电解质离子的水解过程。 (包括弱酸根离子和弱碱阳离子) 电解质溶液中的离子来源是: 2、电解质的电离过程。 (包括溶质的电离和水的电离) 1、弱电解质离子的水解过程。 (包括弱酸根离子和弱碱阳离子) 向100 mL1 mol/L 的CH3COOH溶液中逐滴加入 1mol/L的NaOH溶液。随着NaOH的加入,溶液中的 离子浓度的大小关系是如何变化的? 互 相 讨 论 一 下 , 看 看 能 写 出 几 种 结 果 ? 加入 NaOH溶 液的体积 溶液的 酸碱性 溶液中的 溶质 离子 种类 离子浓度大小 比较 向100 mL1 mol/L 的CH3COOH溶液中逐滴加入1mol/L的NaOH溶液 加入 NaOH 溶液的 体积 溶液 的酸 碱性 溶液中的溶质 离子种类 离子浓度大小比较 ①0m L ② ③ ④ ⑤ ⑥ 100mL ⑦ c(H+ )>c(CH3COO-)>c(OH-) 碱性 酸性 CH3COOH CH3COONa CH3COO-、H+ 、OH- CH3COO-、H+ 、 Na+ 、OH- c(Na+)>c(CH3COO-)>c(OH-) >c(H+) 单一 溶液 单一 溶液 1、要充分考虑弱酸(弱碱)的电离平衡和弱 离子的水解平衡,尤其不能漏掉水的电离。 。 2、弱电解质的电离是微弱的。只有很少量 的弱酸(弱碱)电离。 3、弱离子的水解是微弱的。只有少量的弱离子 水解。 加入 NaOH 溶液的 体积 溶液 的酸 碱性 溶液中的溶质 离子种类 离子浓度大小比较 ①0mL ②0.5m L ③一定 体积 ④ 一定 体积 ⑤一定 体积 ⑥ 100mL ⑦ 500mL c(H+ )>c(CH3COO-)>c(OH-) 碱性 中性 酸性 酸性 CH3COOH CH3COOH CH3COONa CH3COOH CH3COONa CH3COONa CH3COO-、H+ 、OH- CH3COO-、H+ 、 Na+ 、OH- c(CH3COO-)>c(Na+)>c(H+) >c(OH-) c(CH3COO-)=c(Na+)>c(H+) =c(OH-) c(Na+)>c(CH3COO-)>c(OH-) >c(H+) 碱性 c(CH3COO-)>c(H+)>c(Na+ ) >c(OH-)酸性 CH3COOH CH3COONa CH3COONa NaOH CH3COO-、H+ 、 Na+ 、OH- CH3COO-、H+ 、 Na+ 、OH- c(Na+)>c(OH-)>c(CH3COO-) >c(H+) 1∶1 碱性 CH3COOH CH3COONa CH3COO-、H+ 、 Na+ 、OH- CH3COO-、H+ 、 Na+ 、OH- CH3COO-、H+ 、 Na+ 、OH- c(Na+)>c(CH3COO-)>c(OH-) >c(H+) 50mL 碱很少 碱很多 1、要充分考虑弱酸(弱碱)的电离平衡和弱 离子的水解平衡,尤其不能漏掉水的电离。 。 2、弱电解质的电离是微弱的。只有很少量 的弱酸(弱碱)电离。 3、弱离子的水解是微弱的。只有少量的弱离子 水解。 4、若同时存在弱电解质的电离和弱离子的水解 过程,则要考虑二者的相对强弱。分析时只考虑 相对较强的过程。 电荷守恒关系: c(H+)+c(Na+ )=c(CH3COO-)+c(OH-) c(CH3COO-)=c(Na+)>c(H+)=c(OH -) c(H+)>c(CH3COO-)>c(Na+)>c(OH -)c(OH-)>c(Na+)>c(CH3COO-)> c(H+) pH=7: 溶 液 中 的 粒 子 浓 度 的 守 恒 关 系 有 哪 些 ? c(Na+)=c(CH3COO-) + c(CH3COOH ) 尝试一下,把电荷守恒式和物料守恒式加合一 下,看看得到什么? c(OH-)=c(H+ ) + c(CH3COOH) CH3COONa 1、电荷守恒关系: c(H+)+c(Na+ )=c(CH3COO-)+c(OH-) 2、物料守恒关系: 1、粒子浓度之间的守恒关系包括电荷守恒关系 (溶液是电中性的)和物料守恒关系(元素守 恒)。 2、电荷守恒式中的阴阳离子分列等号两边,特 别注意高价离子的系数; 3、出现分子必然是物料守恒式。 4、物料守恒式代入电荷守恒式后可得新的守恒 式。 NaHCO3 水溶液中 存在的粒 子之间的 关系不正 确的是: Na+ 、 HCO3- 、 OH-、H2CO3 、 CO32- 、 H+ NaHCO3=Na+ +HCO3- HCO3- + H2O H2CO3 + OH- HCO3- CO3 2- + H+ H2O H+ +OH- (主) (次) A、 c(Na+ )>c(HCO3-) >c(OH-) >c(CO32- )> c(H+) B、 c(Na+ )+ c(H+)=c(HCO3-)+c(CO32- )+c(OH-) C、 c(Na+ )=c(HCO3-)+c(CO32- )+c(H2CO3) D、 c(OH-)=c(H+)+c(H2CO3) — c(CO32- ) 不 同 溶 液 中 同 种 离 子 浓 度 的 比 较 : 1、有物质的量浓度相同的下列溶液: ①NH4Cl ②(NH4)2SO4 ③(NH4)2CO3 ④NH4HCO3 ⑤NH4HSO4 ⑥(NH4)2Fe(SO4)2 ⑦CH3COONH4 c(NH4+)由大到小的顺序是: 。 ⑥②③⑤①④⑦ 不 同 溶 液 中 同 种 离 子 浓 度 的 比 较 : 2、温度相同、浓度均为0.2mol/L的溶液, ①(NH4)2SO4 ②NaNO3 ③NH4HSO4 ④NH4Cl Na2CO3 ⑥ CH3COONa ⑦NaHCO3 它们的pH值由小到大的排列顺序是: ③①④②⑥⑦⑤ 1、注意被比较离子的数量关系。 2、注意被比较离子的变化。 3、按影响因素分组讨论: 将盐分为抑制电离的、不影响电离的、不电 离的、不水解的、抑制水解的、水解的、促进 水解的几组,再在小组内按程度不同进行具体 比较。 按溶液的酸碱性将溶液先分为三组:酸性的、 中性的、碱性的。再在小组内程度不同进行具体 比较。 100 mL0.1mol/L醋酸与50 mL0.2mol/L氢氧化 钠溶液混合,在所得溶液中 ( ) A. c(Na+)>c(CH3COO )>c(OH )>c(H+) B. c(Na+)>c(CH3COO )>c(H+)>c(OH ) C. c(Na+)>c(CH3COO )>c(H+)=c(OH ) D. c(Na+)=c(CH3COO )>c(OH )>c(H+) A 将盐酸溶液和氨水等体积混合后溶液呈中性, 下列关系式中正确的是 A. c(Cl )>c(NH4+)>c(H+)>c(OH ) B. c(NH4+)>c(Cl )>c(H+)>c(OH ) C. c(Cl )=c(NH4+)>c(H+)=c(OH ) D. c(Cl )=c(NH4+)>c(H+)>c(OH ) 注意: 氨水有剩余,所得溶液为NH4Cl和NH3·H2O的混 合溶液。 电荷守恒关系: c( H+ ) + c(NH4+ ) = c(Cl-) + c(OH-) C 在25℃时将pH=11 的NaOH 溶液与pH=3 的 CH3COOH溶液等体积混合后,下列关系式中 正确的是 A.c (Na+)=c(CH3COO-)+c(CH3COOH) B.c(H+)=c(CH3COO-)+c(OH一) C.c (Na+) >c (CH3COO-)>c(OH-)>c(H+) D.c (CH3COO-)>c(Na+)>c(H+)>c(OH-) 注意: CH3COOH有剩余,所得溶液为CH3COOH和 CH3COONa的混合溶液。 将等浓度的NH4Cl 和 NH3·H2O 稀溶液混合, 测得c(NH4+)>c(Cl—)。则下列关系式中正确 的是( ) A.c(H+)>c(OH—) B.c(H+)<c(OH—) C.c(NH4+)>c(NH3·H2O) D.c(NH4+)<c( NH3·H2O) 物质的量浓度相同的下列溶液:①Na2CO3 ②NaHCO3 ③H2CO3 ④(NH4)2CO3 ⑤NH4HCO3 ,按c(CO3 2-)由小到大的顺序 是: A、⑤<④<③<②<① B、③<⑤<②<④<① C、③<②<⑤<④<① D、③<⑤<④<②<① A组是基础巩固,所有同学必须完成。 B组是能力拔高,供同学选择使用。 C组是挑战自我,有兴趣的同学可以 尝试一下。查看更多