- 2021-05-19 发布 |
- 37.5 KB |
- 31页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
全国八省联考辽宁省2021年1月普通高中学业水平选择考适应性测试化学试题含答案解析
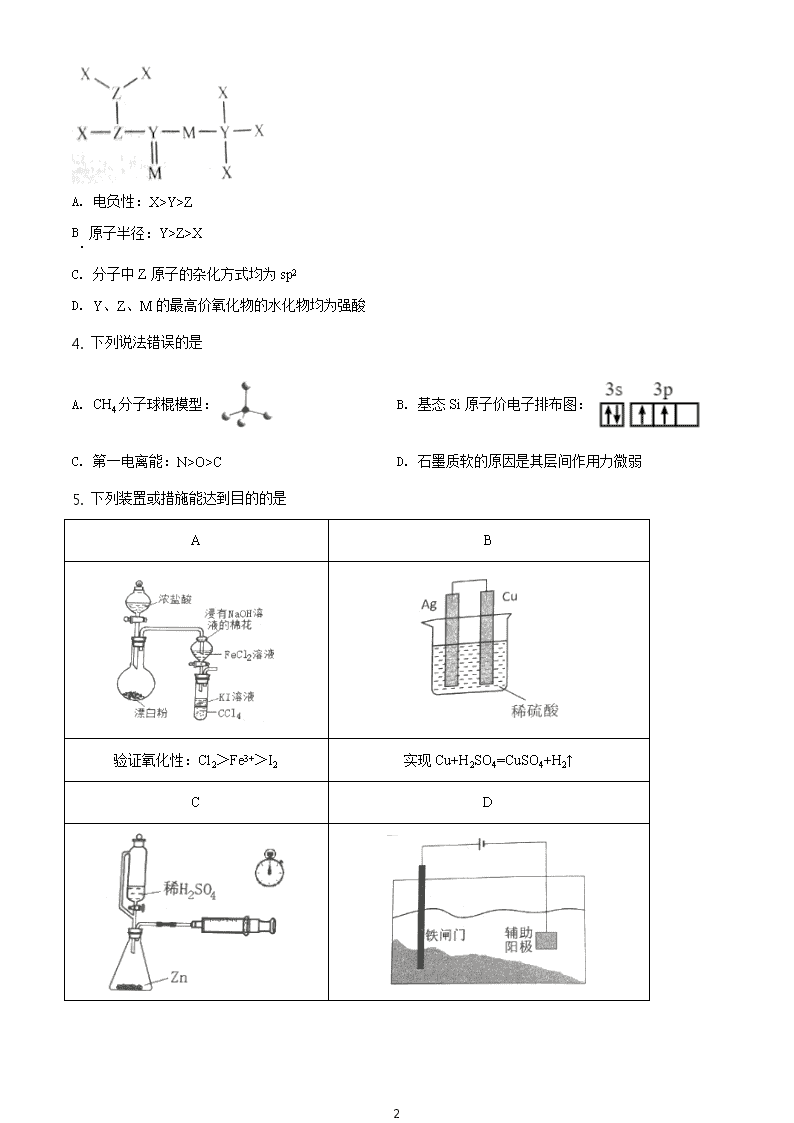
1 2021 年辽宁省普通高等学校招生适应性测试 化学 注意事项: 1. 答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。 2.答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,用 橡皮擦干净后,再选涂其它答案标号。答非选择题时,将答案写在答题卡上。写在本试卷上 无效。 3. 结束后,将本试卷和答题卡一并交回。 可能用到的相对原子质量: H 1 C 12 O 16 Na23 S32 Mn55 一、选择题:本题共 15 小题,每小题 3 分,共 45 分。在每小题给出的四个选项中,只有一 项符合题目要求。 1. 下列说法正确的是 A. 丝绸、宣纸及尼龙的主要成分均为合成纤维 B. 港珠澳大桥使用的超高分子量聚乙烯纤维吊装缆绳,具有质量轻、强度大、耐磨、耐腐蚀的优点 C. “嫦娥五号”使用的太阳能电池阵和锂离子电池组,均可将化学能转变成电能 D. “奋斗者号”潜水器使用的固体浮力材料,由空心玻璃微球填充高强树脂制成,属于无机非金属材料 2. 我国自主设计生产的长征系列运载火箭使用偏二甲肼(C2H8N2)作燃料,N2O4 作氧化剂。下列相关的化学 用语正确的是 A. 该反应的化学方程式:C2H8N2+N2O4=2CO2+N2+4H2O B. 偏二甲肼的结构简式: C. N2 的结构式:N=N D. 甲基的电子式: 3. 短周期元素 X、 Y、Z、M 原子序数依次增大,Z 的基态原子 2p 轨道半充满,M 的最高正价与最低负价 绝对值之差为 4,它们组成的一种分子结构如图。下列说法正确的是 2 A. 电负性:X>Y>Z B. 原子半径:Y>Z>X C. 分子中 Z 原子的杂化方式均为 sp2 D. Y、Z、M 的最高价氧化物的水化物均为强酸 4. 下列说法错误的是 A. CH4 分子球棍模型: B. 基态 Si 原子价电子排布图: C. 第一电离能:N>O>C D. 石墨质软的原因是其层间作用力微弱 5. 下列装置或措施能达到目的的是 A B 验证氧化性:Cl2>Fe3+>I2 实现 Cu+H2SO4=CuSO4+H2↑ C D 3 测定反应速率 保护铁闸门不被腐蚀 A. A B. B C. C D. D 6. 我国科学家合成了富集 11B 的非碳导热材料立方氮化硼晶体,晶胞结构如图。下列说法正确的是 A. 11BN 和 10BN 的性质无差异 B. 该晶体具有良好的导电性 C. 该晶胞中含有 14 个 B 原子,4 个 N 原子 D. N 原子周围等距且最近的 N 原子数为 12 7. 某温度下,在一恒容密闭容器中进行如下两个反应并达到平衡: ①2X(g)+Y(g) Z(s)+ 2Q(g) △H1<0 ②M(g)+N(g) R(g)+Q(g) △H2>0 下列叙述错误的是 A. 加入适量 Z,①和②平衡均不移动 B. 通入稀有气体 Ar,①平衡正向移动 C. 降温时无法判断 Q 浓度的增减 D. 通入 Y,则 N 的浓度增大 8. 中药透骨草中一种抗氧化性活性成分结构如下。下列说法正确的是 A. 在一定条件下能发生氧化反应、取代反应和消去反应 B. 苯环上的一溴代物共 5 种 C. 1 mol 该化合物最多与 4 mol NaOH 反应 D. 该分子中最多有 7 个碳原子共面 9. 在 N-羟基邻苯二甲酰亚胺(NHPI)介质中,可实现醇向醛的转化,原理如图。下列说法错误的是 4 A. 理论上 NHPI 的总量在反应前后不变 B. 海绵 Ni 电极作阳极 C. 总反应为 电解 + H2↑ D. 每消耗 1 mmol 苯甲醇,产生 22.4 mL 氢气 10. 下列各实验的现象及结论都正确的是 选 项 实验 现象 结论 A 浓硫酸滴入蔗糖中,产生的气体导入澄清 石灰水 蔗糖变黑、体积膨胀,澄清石灰 水变浑浊 浓硫酸具有脱水性和 强氧化性 B 铜粉加入稀硫酸中,加热;再加入少量硝 酸钾固体 加热时无明显现象,加入硝酸钾 后溶液变蓝 硝酸钾起催化作用 C 过量铁粉加入稀硝酸中,充分反应后,滴 加 KSCN 溶液 有无色气泡产生, 溶液呈血红 色 稀硝酸能将 Fe 氧化成 Fe3+ D 将 Na 粒投入 MgCl2 溶液 析出银白色固体 固体为 Mg A. A B. B C. C D. D 11. 苯乙烯与溴苯在一定条件下发生 Heck 反应: + 催化剂、反应温度 反应时间、溶剂、碱 溴苯用量(mmol) 100 100 100 100 100 100 100 催化剂用量(mmol) 2 2 2 2 2 2 2 5 反应温度(℃) 100 100 100 100 120 140 160 反应时间(h) 10 12 14 16 14 14 14 产率(%) 81.2 84.4 86.6 86.2 93.5 96.6 89.0 根据上表数据,下列说法正确的是 A. 最佳反应温度为 100 ℃ B. 最佳反应时间为 16h C. 温度过高时催化剂活性可能降低 D. 反应产物是顺式结构 12. 实验室用 TiCl4 水解法制备纳米 TiO2 的简易流程如下,下列说法错误的是 A. TiCl4 发生水解反应,可生成 TiO2·xH2O B. 氨水的作用可用勒夏特列原理解释 C. 可用 AgNO3 溶液检验沉淀是否洗涤干净 D. 制得的 TiO2 纳米颗粒能产生丁达尔现象 13. Hg-Hg2SO4 标准电极常用于测定其它电极的电势,测知 Hg-Hg2SO4 电极的电势高于 Cu 电极的电势。以 下说法正确的是 A. K2SO4 溶液可用 CCl4 代替 B. Hg-Hg2SO4 电极反应为 Hg2SO4 -2e-=2Hg+ 2- 4SO C. 若把 Cu-CuSO4 体系换作 Zn-ZnSO4 体系,电压表的示数变大 D. 微孔瓷片起到阻隔离子通过的作用 14. 下列说法正确的是 6 A. 向 AgCl 浊液中加入 KBr 溶液,沉淀颜色变为浅黄色,即可证明 Ksp(AgCl)>Ksp(AgBr) B. 常温下向 NaOH 溶液中滴入 HCOOH 溶液至 pH=5 时:c(HCOO-)>c(Na+) C. 常温下等物质的量浓度的四种溶液①NH3·H2O ②NH4HSO4③(NH4)2CO3④NH4Cl,c( + 4NH )的关系为 ②>④>③> ① D. 等物质的量浓度的 NaHCO3 与 Na2CO3 混合溶液:3c(Na+)=2[c( 2- 3CO )+c( - 3HCO )+c (H2CO3)] 15. 天然水体中的 H2CO3 与空气中的 CO2 保持平衡。已知 Ksp(CaCO3)=2.8×10-9, 某溶洞水体中 lgc(X) (X 为 H2CO3、 - 3HCO 、 2- 3CO 或 Ca2+)与 pH 的关系如图所示。下列说法正确的是 A. 曲线①代表 2- 3CO B. H2CO3 的一级电离常数为 10-8.3 C. c(Ca2+)随 pH 升高而增大 D. pH=10.3 时,c(Ca2+)=2.8×10-7.9 mol·L-1 二、非选择题:本题共 4 小题,共 55 分。 16. 高锰酸钾生产过程中产生的废锰渣(主要成分为 MnO2、KOH、MgO 和 Fe2O3)可用于制备 MnSO4 晶体,工艺流程如下: 该工艺条件下金属离子开始沉淀和完全沉淀的 pH 如下表所示: 金属离子 Fe3+ Fe2+ Mn2+ Mg2+ 开始沉淀 pH 2.10 7.45 9.27 9.60 7 完全沉淀 pH 3.20 8.95 10.87 11.13 回答以下问题: (1) MnSO4 中阴离子的空间构型为_______。 (2)提高“反应Ⅰ”速率可采取的措施是_______ (除“加热”外,任写一种),滤渣 A 的主要成分为_______(填化 学式)。 (3) “反应Ⅱ”中硫铁矿(FeS2)的作用为_______。 (4)“反应Ⅲ”的离子方程式为_______。 (5)“调 pH”步骤中,应调节 pH 不低于_______。 (6)取 0.1510 g MnSO4 固体,溶于适量水中,加硫酸酸化,用过量 NaBiO3(难溶于水)将其完全氧化为 - 4MnO , 过滤,洗涤,洗涤液并入滤液后,加入 0.5360 g Na2C2O4 固体,充分反应后,用 0.0320 mol/L KMnO4 溶液 滴定,用去 20.00 mL,计算样品中 MnSO4 的质量分数_______(保留三位有效数字)。 17. 已知 CaCrO4 微溶于水,某传统测定 CaCrO4 溶度积的实验如下: ①配制 250 mL 待标定的 K2CrO4 溶液。 ②标定测得 K2CrO4 溶液浓度为 0.6025 mol/L。 ③按下表数据将 0.2000 mol/LCaCl2 溶液、K2CrO4 溶液及蒸馏水混匀,静置(溶液体积变化忽略不计)。 ④取上层清液于锥形瓶中,加入 H2SO4 和 H3PO4 溶液酸化,溶液由黄色转变为橙色,加入指示剂,用 0.2000 mol/L(NH4)2Fe(SO4)2 溶液滴定,数据记入下表。 组别 体积(mL) 物质 1 2 3 4 5 6 CaCl2 25.00 25.00 25.00 25.00 25.00 25.00 K2CrO4 15.00 16.00 17.00 18.00 19.00 20.00 蒸馏水 10.00 9.00 8.00 7.00 6.00 5.00 取上层清液 10.00 10.00 10.00 10.00 10.00 10.00 耗(NH4)2Fe(SO4)2 13.33 15.00 16.78 18.42 20.15 21.89 ⑤滴定测出上层清液中的 c( 2- 4CrO ),进而计算出上层清液中的 c(Ca2+),即得 Ksp(CaCrO4)。 回答下列问题: 8 (1)步骤①中无需使用下列哪些仪器_______(填标号)。 (2)基态 Cr 原子的电子排布式为_______。 (3)步骤④中所得橙色溶液中铬元素的主要存在形式为_______(填化学式);滴定时还原产物为 Cr3+,写出反 应的离子方程式_______。 (4) 根据第 2 组滴定数据,计算得上层清液中 c( 2- 4CrO )=_______mol/L。 (5)滴定时,有一组数据出现了明显异常,所测 c( 2- 4CrO )偏大,原因可能有_______(填标号)。 A.滴定终点读数时仰视刻度线 B.达终点时滴定管尖嘴有标准液悬挂 C.盛装待测液的锥形瓶未润洗 D.摇动锥形瓶时有液体溅出 (6)利用上表数据经计算绘制出如下图点,请根据图点绘出溶度积曲线_________。 (7)请结合图线推测 Ksp(CaCrO4)≈_______(保留两位有效数字)。 18. 环氧乙烷是高效消毒剂,可用于口罩等医用品消毒,工业常用乙烯氧化法生产。 主反应:2CH2=CH2(g) + O2(g) 2 3Ag/α-Al O 2 (g) △H1=-209.8 kJ/mol 副反应:CH2=CH2(g) + 3O2(g)=2CO2(g)+ 2H2O(g) △H2=-1323.0 kJ/mol 回答下列问题: (1) C2H4 的燃烧热△H=-1411.0 kJ/mol,则环氧乙烷(g)的燃烧热△H=_______。 9 (2)以下既能加快反应速率又能提高环氧乙烷产率的方法有的_______ (填标号)。 A.降低温度 B.向容器中充入 N2 使压强增大 C.采用改性的催化剂 D.用空气替代氧气 (3)已知: (g)+HCl(g) Δ (l),合成过程中的温度与氯乙醇的平衡产率关系如 图 a,30℃下原料投料比与氯乙醇的平衡产率关系如图 b。 反应随温度升高平衡产率降低的可能原因为_______;其它条件不变时,降低环氧乙烷与 HCl 的投料比,环 氧乙烷的平衡转化率将_______(填“增大”“减小”或“不变”)。 (4)环氧乙烷经水解可得到乙二醇。乙二醇 易溶于水的原因为_______;写出乙二醇—氧气碱性燃料电池的 负极电极反应式:_______。 19. 化合物 H 是合成一种能治疗头风、 痈肿和皮肤麻痹等疾病药物的重要中间体,其合成路线如下: 已知下列信息: ①RCOOCH3+ Δ 多聚磷酸 +CH3OH 10 ② 3 4 i.Na NH (l) ii.NH Cl, 回答下列问题: (1) A 的分子式为_______;D 中官能团的名称为_______。 (2) C 的结构简式为_______ 。 (3)合成路线中 D 到 E 的反应类型为_______。 (4)鉴别 E 和 F 可选用的试剂为_______ (填标号)。 A.FeCl3 溶液 b.溴水 c.酸性 KMnO4 溶液 d.NaHCO3 溶液 (5) G 到 H 的反应方程式为_______。 (6)有机物 W 是 C 的同系物,且具有以下特征: i.比 C 少 3 个碳原子; ii.含甲基,能发生银镜反应; 符合上述条件的 W 有_______种;其中核磁共振氢谱峰面积之比为 1:2:2:2:3 的 W 的结构简式为_______。 11 2021 年辽宁省普通高等学校招生适应性测试 化学 注意事项: 1. 答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。 2.答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,用 橡皮擦干净后,再选涂其它答案标号。答非选择题时,将答案写在答题卡上。写在本试卷上 无效。 3. 结束后,将本试卷和答题卡一并交回。 可能用到的相对原子质量: H 1 C 12 O 16 Na23 S32 Mn55 一、选择题:本题共 15 小题,每小题 3 分,共 45 分。在每小题给出的四个选项中,只有一 项符合题目要求。 1. 下列说法正确的是 A. 丝绸、宣纸及尼龙的主要成分均为合成纤维 B. 港珠澳大桥使用的超高分子量聚乙烯纤维吊装缆绳,具有质量轻、强度大、耐磨、耐腐蚀的优点 C. “嫦娥五号”使用的太阳能电池阵和锂离子电池组,均可将化学能转变成电能 D. “奋斗者号”潜水器使用的固体浮力材料,由空心玻璃微球填充高强树脂制成,属于无机非金属材料 【答案】B 【解析】 【分析】 【详解】A.丝绸的主要成分是蛋白质,宣纸的主要成分是纤维素,尼龙的主要成分是合成纤维,A 错误; B.聚乙烯纤维属于合成高分子,具有强度大、质量轻、耐腐蚀等特点,B 正确; C.嫦娥五号使用的太阳能电池阵是将太阳能转化为电能,C 错误; D.固体浮力材料,由空心玻璃微球填充高强树脂制成,其中树脂为有机高分子材料,D 错误; 故答案选 B。 2. 我国自主设计生产的长征系列运载火箭使用偏二甲肼(C2H8N2)作燃料,N2O4 作氧化剂。下列相关的化学 用语正确的是 A. 该反应的化学方程式:C2H8N2+N2O4=2CO2+N2+4H2O 12 B. 偏二甲肼的结构简式: C. N2 的结构式:N=N D. 甲基的电子式: 【答案】D 【解析】 【分析】 【详解】A.依题意,偏二甲肼作火箭燃料,N2O4 作氧化剂,故两者发生氧化还原生成无污染的 N2,反应 为化学方程式为 C2H8N2+2N2O4=2CO2+3N2+4H2O,A 错误; B.偏二甲肼中 N 原子形成 3 对共价键,结构简式为 ,B 错误; C. N2 分子间形成氮氮三键,结构简式为 ,C 错误; D.C 原子的最外层有 4 个电子,其中 3 个电子分别于 3 个 H 原子提供的电子形成共用电子对,得到甲基的 电子式,故 D 正确; 故答案选 D。 3. 短周期元素 X、 Y、Z、M 原子序数依次增大,Z 的基态原子 2p 轨道半充满,M 的最高正价与最低负价 绝对值之差为 4,它们组成的一种分子结构如图。下列说法正确的是 A. 电负性:X>Y>Z B. 原子半径:Y>Z>X C. 分子中 Z 原子的杂化方式均为 sp2 D. Y、Z、M 的最高价氧化物的水化物均为强酸 【答案】B 【解析】 【分析】 13 已知 X、Y、Z、M 为原子序数依次增大的短周期元素,Z 的基态原子 2p 轨道半充满,则 Z 为 N 元素,M 的最高正价与最低负价绝对值之差为 4,则 M 为 S 元素,4 种元素组成的一种分子结构如图,根据共价键 数目可推知,则 X 为 H 元素,Y 为 C 元素,据此分析解答问题。 【详解】A.由上述分析可知,X 为 H 元素,Y 为 C 元素,Z 为 N 元素,则电负性:N>C>H,A 错误; B.H 原子核外有 1 个电子层,而 C、N 原子核外均有 2 个电子层,电子层数越多,半径越大,电子层数相 同,核电荷数越大,半径越小,则原子半径:C>N>H,B 正确; C.分子中 N 原子均形成共价单键,为 sp3 杂化,C 错误; D.C 元素的最高价氧化物的水化物为 H2CO3,H2CO3 为弱酸,D 错误; 答案选 B。 4. 下列说法错误的是 A. CH4 分子球棍模型: B. 基态 Si 原子价电子排布图: C. 第一电离能:N>O>C D. 石墨质软的原因是其层间作用力微弱 【答案】A 【解析】 【分析】 【详解】A.C 原子的半径大于 H 原子,因此 CH4 分子的球棍模型为: ,A 错误; B.基态 Si 原子价电子排布式为 3s23p2,排布图为 ,B 正确; C.N 原子的 2p 轨道处于半满状态,因此其第一电离能最大,则第一电离能:N>O>C,C 正确; D.在石墨中,同层的 C 原子以共价键结合,而每层之间以范德华力结合,其层间作用力微弱,层与层之间 可以滑动,因此较为松软,D 正确; 答案选 A。 5. 下列装置或措施能达到目的的是 A B 14 验证氧化性:Cl2>Fe3+>I2 实现 Cu+H2SO4=CuSO4+H2↑ C D 测定反应速率 保护铁闸门不被腐蚀 A. A B. B C. C D. D 【答案】C 【解析】 【分析】 【详解】A.该装置可以验证氧化性:Cl2>Fe2+,但不能够确定 I-是 Cl2 氧化还是被 Fe3+氧化,不能证明氧 化性:Fe3+>I2,A 不能达到实验目的; B.Cu 和 Ag 均为不活泼金属,不能在稀硫酸中发生自发的氧化还原反应,不能实现不 Cu+H2SO4=CuSO4+H2↑ 的发生,B 不能达到实验目的; C.可根据一定时间内产生氢气的量来计算反应的速率,C 可以达到实验目的; D.用外加电流的阴极保护法保护铁闸门不被腐蚀时,应将铁闸门连接电源的负极,D 不能达到实验目的; 答案选 C。 6. 我国科学家合成了富集 11B 的非碳导热材料立方氮化硼晶体,晶胞结构如图。下列说法正确的是 15 A. 11BN 和 10BN 的性质无差异 B. 该晶体具有良好的导电性 C. 该晶胞中含有 14 个 B 原子,4 个 N 原子 D. N 原子周围等距且最近的 N 原子数为 12 【答案】A 【解析】 【分析】 【详解】A. 11B 和 10B 互为同位素,形成的化合物在化学性质上无差异,A 正确; B.该晶体结构中无自由移动的电子,不具有导电性,B 错误; C.由图可知,该晶胞含 4 个 N 原子,B 原子位于晶胞的顶点和面心上,故 B 原子的数量为 8× 1 8 +6× 1 2 =4 个,C 错误; D.由晶胞示意图,1 个 N 原子与 4 个 B 原子成键,1 个 B 原子可以和 3 个 N 原子成键,N 原子周围等距 且最近的 N 原子数为 4 个,D 错误; 故答案选 A。 7. 某温度下,在一恒容密闭容器中进行如下两个反应并达到平衡: ①2X(g)+Y(g) Z(s)+ 2Q(g) △H1<0 ②M(g)+N(g) R(g)+Q(g) △H2>0 下列叙述错误的是 A. 加入适量 Z,①和②平衡均不移动 B. 通入稀有气体 Ar,①平衡正向移动 C. 降温时无法判断 Q 浓度的增减 D. 通入 Y,则 N 的浓度增大 【答案】B 【解析】 【分析】 16 【详解】A.Z 为固体,加入适量 Z 不影响反应①的平衡移动,而反应②与 Z 无关,故加入 Z 也不影响反 应②的平衡移动,A 正确; B.通入稀有气体 Ar,由于容器体积不变,故气体浓度不发生改变,反应①的平衡不移动,B 错误; C.温度降低,反应①逆向进行,反应②正向进行,但两个反应中反应物的起始浓度未知,故无法判断 Q 浓 度的增减,C 正确; D.通入气体 Y,反应①平衡正向移动,Q 的浓度增大,导致反应②平衡逆向进行,则 N 的浓度增大,D 正 确; 答案选 B。 8. 中药透骨草中一种抗氧化性活性成分结构如下。下列说法正确的是 A. 在一定条件下能发生氧化反应、取代反应和消去反应 B. 苯环上的一溴代物共 5 种 C. 1 mol 该化合物最多与 4 mol NaOH 反应 D. 该分子中最多有 7 个碳原子共面 【答案】B 【解析】 【分析】 该有机物中含有碳碳双键、酚羟基、酯基三种官能团,据此分析。 【详解】A.酚羟基能发生氧化、取代反应,碳碳双键能发生氧化反应,酯基能发生取代反应,该有机物不 含能发生消去反应的原子或原子团,A 错误; B.第一个苯环上有 3 种不同环境的 H 原子,第二个苯环上有 2 种不同环境的 H 原子,共有 5 种不同环境 的 H 原子,故一溴代物有 5 种,B 正确; C.酚羟基、酯基能与 NaOH 溶液反应,该有机物含有 2 个酚羟基,2 个酯基,其中一个酯基为苯酚酯的结 构,故 1mol 有机物消耗 5mol NaOH,C 错误; D.苯环是共面型分子,含乙烯结构的碳碳双键也是共面型分子,故该有机物一定处于同一个平面的原子不 止 7 个,D 错误; 故答案选 B。 9. 在 N-羟基邻苯二甲酰亚胺(NHPI)介质中,可实现醇向醛的转化,原理如图。下列说法错误的是 17 A. 理论上 NHPI 的总量在反应前后不变 B. 海绵 Ni 电极作阳极 C. 总反应为 电解 + H2↑ D. 每消耗 1 mmol 苯甲醇,产生 22.4 mL 氢气 【答案】D 【解析】 【分析】 由装置分析可知,该装置为电解池,Ni2+在海绵 Ni 电极失去电子得到 Ni3+,发生氧化反应,则海绵 Ni 为阳 极,电极反应式为:Ni2+-e-=Ni3+,阳极区同时还发生反应:Ni3++NHPI→Ni2++PINO,H+在石墨电极得到电 子生成 H2,发生还原反应,则石墨为阴极,电极反应式为:2H++2e-=H2,阴极区同时还发生反应: +PINO→ ,据此解答。 【详解】A.根据上述分析可知,NHPI 在阳极区参与反应,又在阴极区为生成物,因此理论上 NHPI 的总 量在反应前后不发生改变,A 正确; B.由上述分析,Ni2+在海绵 Ni 电极失去电子得到 Ni3+,发生氧化反应,则海绵 Ni 为阳极,B 正确; C.阳极反应式为:Ni2+-e-=Ni3+,阳极区同时还发生反应:Ni3++NHPI→Ni2++PINO,阴极反应式为:2H++2e-=H2, 阴极区同时还发生反应: +PINO→ ,因此总反应为 电解 + H2↑,C 正确; D.未指明标准状况,不能用 Vm=22.4L/mol 进行计算,D 错误; 答案选 D。 10. 下列各实验的现象及结论都正确的是 18 选 项 实验 现象 结论 A 浓硫酸滴入蔗糖中,产生的气体导入澄清 石灰水 蔗糖变黑、体积膨胀,澄清石灰 水变浑浊 浓硫酸具有脱水性和 强氧化性 B 铜粉加入稀硫酸中,加热;再加入少量硝 酸钾固体 加热时无明显现象,加入硝酸钾 后溶液变蓝 硝酸钾起催化作用 C 过量铁粉加入稀硝酸中,充分反应后,滴 加 KSCN 溶液 有无色气泡产生, 溶液呈血红 色 稀硝酸能将 Fe 氧化成 Fe3+ D 将 Na 粒投入 MgCl2 溶液 析出银白色固体 固体为 Mg A. A B. B C. C D. D 【答案】A 【解析】 【分析】 【详解】A.蔗糖与浓硫酸反应生成蓬松多孔的黑色物质,浓硫酸先使蔗糖脱水生成 C 单质,蔗糖变黑,体 现了浓硫酸的脱水性,C 单质与浓硫酸反应生成 CO2,同时生成刺激性气味的气体 SO2,使体积膨胀,体现 了浓硫酸的强氧化性,气体导入澄清石灰水生成固体变浑浊,故 A 符合题意; B.铜粉不与稀硫酸反应,加入硝酸钾,引入 – 3NO ,发生反应的离子方程式为: 3Cu+2 – 3NO +8H+=3Cu2++2NO↑+4H2O,体现了硝酸根在酸性环境中(HNO3)的强氧化性,结论错误,B 不符 合题意; C.硝酸具有强氧化性,铁先被硝酸氧化生成 Fe3+再被过量铁粉还原生成 Fe2+,滴加 KSCN 溶液不显红色, 现象错误,C 不符合题意; D.Na 粒投入 MgCl2 溶液,由于 Na 的还原性极强,Na 先与水反应生成 NaOH 和 H2,NaOH 与 MgCl2 反应 生成 Mg(OH)2 白色沉淀,现象、结论错误,D 不符合题意; 故答案选 A。 11. 苯乙烯与溴苯在一定条件下发生 Heck 反应: + 催化剂、反应温度 反应时间、溶剂、碱 19 溴苯用量(mmol) 100 100 100 100 100 100 100 催化剂用量(mmol) 2 2 2 2 2 2 2 反应温度(℃) 100 100 100 100 120 140 160 反应时间(h) 10 12 14 16 14 14 14 产率(%) 81.2 84.4 86.6 86.2 93.5 96.6 89.0 根据上表数据,下列说法正确的是 A. 最佳反应温度为 100 ℃ B. 最佳反应时间为 16h C. 温度过高时催化剂活性可能降低 D. 反应产物是顺式结构 【答案】C 【解析】 【分析】 【详解】A.根据表格信息,当反应温度为 140℃,反应时间为 14h 时,生成物的产率最大,因此最佳反应 温度为 140℃,A 错误; B.由 A 的分析可知,最佳反应时间为 14h,B 错误; C.根据表格数据,温度超过 140℃时,生成物的产率降低,可能是温度过高导致了催化剂活性降低,C 正 确; D.反应产物为 ,属于反式结构,D 错误; 答案选 C。 12. 实验室用 TiCl4 水解法制备纳米 TiO2 的简易流程如下,下列说法错误的是 A. TiCl4 发生水解反应,可生成 TiO2·xH2O B. 氨水的作用可用勒夏特列原理解释 C. 可用 AgNO3 溶液检验沉淀是否洗涤干净 D. 制得的 TiO2 纳米颗粒能产生丁达尔现象 20 【答案】D 【解析】 【分析】 根据流程分析可知,TiCl4 和 H2O 在冰水浴下搅拌,发生水解:TiCl4+(x+2)H2O TiO2·xH2O↓+4HCl, 再在 95℃下加入氨水调解 pH 至 6~8,沉淀陈化后经离心、洗涤和煅烧后得到 TiO2,据此解答。 【 详 解 】 A . 根 据 上 述 分 析 可 知 , TiCl4 和 H2O 在 冰 水 浴 下 搅 拌 , 发 生 水 解 反 应 : TiCl4+(x+2)H2O TiO2·xH2O↓+4HCl,A 正确; B.加入氨水,可中和 HCl,使得水解反应正向进行,符合勒夏特列原理,B 正确; C.沉淀上还附着的有 Cl-,因此可以用 AgNO3 溶液来检验沉淀是否洗涤干净,C 正确; D.TiO2 纳米颗粒为固体颗粒,不是胶体,不能产生丁达尔现象,D 错误; 答案选 D。 13. Hg-Hg2SO4 标准电极常用于测定其它电极的电势,测知 Hg-Hg2SO4 电极的电势高于 Cu 电极的电势。以 下说法正确的是 A. K2SO4 溶液可用 CCl4 代替 B. Hg-Hg2SO4 电极反应为 Hg2SO4 -2e-=2Hg+ 2- 4SO C. 若把 Cu-CuSO4 体系换作 Zn-ZnSO4 体系,电压表的示数变大 D. 微孔瓷片起到阻隔离子通过的作用 【答案】C 【解析】 【分析】 根据题干信息,Hg-Hg2SO4 电极的电势高于 Cu 电极的电势,则 Hg-Hg2SO4 电极为正极,得到电子发生还原 反应,则电极反应式为:Hg2SO4+2e-=2Hg+ 2- 4SO ,Cu 电极为负极,失去电子发生氧化反应,电极反应式为: 21 Cu-2e-=Cu2+,据此分析解答。 【详解】A.CCl4 为非电解质,不能导电,因此不能用 CCl4 代替 K2SO4 溶液,A 错误; B.由上述分析可知,Hg-Hg2SO4 电极为正极,其电极反应式为:Hg2SO4+2e-=2Hg+ 2- 4SO ,B 错误; C.由于 Cu-CuSO4 体系是电池的负极,失去电子发生氧化反应,若换成更加活泼的 Zn-ZnSO4 体系,更容 易失去电子,电压表的示数变大,C 正确; D.微孔瓷片是便于离子通过,而阻隔溶液通过的作用,D 错误; 答案选 C。 14. 下列说法正确的是 A. 向 AgCl 浊液中加入 KBr 溶液,沉淀颜色变为浅黄色,即可证明 Ksp(AgCl)>Ksp(AgBr) B. 常温下向 NaOH 溶液中滴入 HCOOH 溶液至 pH=5 时:c(HCOO-)>c(Na+) C. 常温下等物质的量浓度的四种溶液①NH3·H2O ②NH4HSO4③(NH4)2CO3④NH4Cl,c( + 4NH )的关系为 ②>④>③>① D. 等物质的量浓度的 NaHCO3 与 Na2CO3 混合溶液:3c(Na+)=2[c( 2- 3CO )+c( - 3HCO )+c (H2CO3)] 【答案】B 【解析】 【分析】 【详解】A.向 AgCl 浊液中加入 KBr 溶液,沉淀颜色变为浅黄色,则有 AgBr 生成,AgCl 转变为 AgBr, 只要 c spQ AgBr K AgBr 即有 AgBr 沉淀,若溴化钾浓度很大,即使 Ksp(AgBr) >Ksp(AgCl)也可实现, 故不可证明 Ksp(AgCl)>Ksp(AgBr),A 错误; B.常温下向 NaOH 溶液中滴入 HCOOH 溶液至 pH=5 时,溶液呈酸性, c(H c) )(OH ,又因为溶液呈 电中性, c(H c(Na c(O) H) ) c HCOO ,则有 :c(HCOO-)>c(Na+),B 正确; C. 常温下等物质的量浓度的四种溶液①NH3·H2O②NH4HSO4③(NH4)2CO3④NH4Cl,①NH3·H2O 是弱电解 质,其余都是强电解质,因此 c( + 4NH )最小的是①,根据能够电离出的 + 4NH 的个数可分为两类,③(NH4)2CO3 是二元铵盐,虽然碳酸铵溶液中,碳酸根和铵根相互促进水解,但水解不彻底,铵离子浓度较大,②NH4HSO4 和④NH4Cl 一元铵盐,②NH4HSO4 中电离产生的氢离子抑制铵离子水解,故 ②NH4HSO4④NH4Cl 比较, c( + 4NH )较大的是②;则,c( + 4NH )的关系为③>②>④>①,C 错误; D.等物质的量浓度的 NaHCO3 与 Na2CO3 混合溶液:根据物料守恒可知:2c(Na+)=3[c( 2- 3CO )+c( - 3HCO )+c 22 (H2CO3)],D 错误; 答案选 B。 15. 天然水体中的 H2CO3 与空气中的 CO2 保持平衡。已知 Ksp(CaCO3)=2.8×10-9, 某溶洞水体中 lgc(X) (X 为 H2CO3、 - 3HCO 、 2- 3CO 或 Ca2+)与 pH 的关系如图所示。下列说法正确的是 A. 曲线①代表 2- 3CO B. H2CO3 的一级电离常数为 10-8.3 C. c(Ca2+)随 pH 升高而增大 D. pH=10.3 时,c(Ca2+)=2.8×10-7.9 mol·L-1 【答案】D 【解析】 【分析】 根据图像可知,随着 pH 的增大,溶液碱性增强, - 3HCO 、 2- 3CO 浓度都增大,而曲线①在 pH 很小时也产 生,因此曲线①代表 - 3HCO ,②代表 2- 3CO ,③代表 Ca2+,据此分析解答。 【详解】A.由上述分析可知,曲线①代表 - 3HCO ,A 错误; B.曲线①为 - 3HCO ,由点(6.3,-5)可知,H2CO3 的一级电离常数 + - 3 -6.3 a1 2 3 c H c HCO = 1.0 10c H CO K ,B 错误; C.曲线③代表 Ca2+,根据图像可知,c(Ca2+)随 pH 升高而减小,C 错误; D.已知 Ksp(CaCO3)=2.8×10-9,根据图像,pH=10.3 时,c( - 3HCO )=c( 2- 3CO )=10-1.1,则 9 2+ 7 9 1 12- 3 Ksp 2 8 10c Ca = 2 8 1010c CO . . . . ,D 正确; 答案选 D。 23 二、非选择题:本题共 4 小题,共 55 分。 16. 高锰酸钾生产过程中产生的废锰渣(主要成分为 MnO2、KOH、MgO 和 Fe2O3)可用于制备 MnSO4 晶体,工艺流程如下: 该工艺条件下金属离子开始沉淀和完全沉淀的 pH 如下表所示: 金属离子 Fe3+ Fe2+ Mn2+ Mg2+ 开始沉淀 pH 2.10 7.45 9.27 9.60 完全沉淀 pH 3.20 8.95 10.87 11.13 回答以下问题: (1) MnSO4 中阴离子的空间构型为_______。 (2)提高“反应Ⅰ”速率可采取的措施是_______ (除“加热”外,任写一种),滤渣 A 的主要成分为_______(填化 学式)。 (3) “反应Ⅱ”中硫铁矿(FeS2)的作用为_______。 (4)“反应Ⅲ”的离子方程式为_______。 (5)“调 pH”步骤中,应调节 pH 不低于_______。 (6)取 0.1510 g MnSO4 固体,溶于适量水中,加硫酸酸化,用过量 NaBiO3(难溶于水)将其完全氧化为 - 4MnO , 过滤,洗涤,洗涤液并入滤液后,加入 0.5360 g Na2C2O4 固体,充分反应后,用 0.0320 mol/L KMnO4 溶液 滴定,用去 20.00 mL,计算样品中 MnSO4 的质量分数_______(保留三位有效数字)。 【答案】 (1). 正四面体 (2). 适当增加硫酸的浓度 (3). MnO2 (4). 将 MnO2 还原为 Mn2+ (5). 2+ + 3+ 2+ 2 22Fe +MnO +4H =2Fe +Mn +2H O (6). 3.2 (7). 98.0% 【解析】 【分析】 在废锰渣中加入硫酸,其中 MnO2 不反应,过滤后滤渣 A 的主要成分为 MnO2,反应Ⅱ为 MnO2 与硫铁矿在 酸性条件下发生氧化还原反应,其反应为 2 2 2 4 4 2 4 3 23MnO +2FeS +6H SO =3MnSO +4S+Fe (SO ) +6H O ,过滤得 S 和 含 硫 酸 铁 、 硫 酸 锰 等 的 溶 液 反 应 Ⅲ 加 MnO2 是 将 Fe2+ 氧 化 成 Fe3+ , 其 反 应 为 24 2+ + 3+ 2+ 2 22Fe +MnO +4H =2Fe +Mn +2H O 加 CaCO3 是利用 Fe3+与 2- 3CO 双水解除去 Fe3+,最后将溶液经过蒸发浓 缩、冷却结晶、过滤、洗涤、干燥得到硫酸锰产品。 【详解】(1) 2- 4SO 离子中,S 原子采用 sp3 杂化,离子呈正四面体结构,硫原子位于正四面体体心,4 个氧 原子位于正四面体四个顶点,故填正四面体; (2)提高反应速率的措施有适当升温、适当增加酸的浓度,将硫铁矿粉碎,搅拌,根据题意任选一种,废渣 A 为 MnO2,故填适当增加硫酸的浓度、MnO2; (3)根据反应方程式 2 2 2 4 4 2 4 3 23MnO +2FeS +6H SO =3MnSO +4S+Fe (SO ) +6H O ,硫铁矿被氧化,作还原剂,将 MnO2 还原为 Mn2+,故填将 MnO2 还原为 Mn2+; (4)根据题意,反应Ⅲ的离子方程式为 2+ + 3+ 2+ 2 22Fe +MnO +4H =2Fe +Mn +2H O ,故填 2+ + 3+ 2+ 2 22Fe +MnO +4H =2Fe +Mn +2H O ; (5)由表中数据可知,Fe3+完全沉淀的 pH 为 3.2,Mn2+开始沉淀的 pH 为 9.27,要使得 Fe3+完全被除去而不影 响 Mn2+,pH 应不低于 3.2,但不高于 9.27,故填 3.2; (6)此为采用间接测定法测 MnSO4 的含量,根据题意,与由样品产生的 - 4MnO 反应的 2- 2 4C O 物质的量=总的 2- 2 4C O 的物质的量-滴定消耗 2- 2 4C O 的物质的量,由此计算。加入的 Na2C2O4 的物质的量为 m 0.5360g=M 134g/mol =0.004mol,由方程式 +- 2- 2+ 4 2 4 2 2=2MnO +5C O +16H 2Mn +10CO +8H O 可知,剩余的 2- 2 4C O 的物质的量为 0.0016mol,由此得与由样品产生的 - 4MnO 反应的 2- 2 4C O 物质的量为 0.004-0.0016=0.0024mol, 即样品中 MnSO4 的物质的量为 0.0098mol,其质量分数为 0.00098 151 100%0.1510 =98.0%,故填 98.0%。 【点睛】间接法测质量分数时,不能直接建立关系式,样品消耗的量=总量-滴定的量。流程中第一次参与反 应的 MnO2 是来自于废锰渣,需要被还原,第二次加 MnO2 是为了方便除杂。 17. 已知 CaCrO4 微溶于水,某传统测定 CaCrO4 溶度积的实验如下: ①配制 250 mL 待标定的 K2CrO4 溶液。 ②标定测得 K2CrO4 溶液浓度为 0.6025 mol/L。 ③按下表数据将 0.2000 mol/LCaCl2 溶液、K2CrO4 溶液及蒸馏水混匀,静置(溶液体积变化忽略不计)。 ④取上层清液于锥形瓶中,加入 H2SO4 和 H3PO4 溶液酸化,溶液由黄色转变为橙色,加入指示剂,用 0.2000 mol/L(NH4)2Fe(SO4)2 溶液滴定,数据记入下表。 组别 1 2 3 4 5 6 25 体积(mL) 物质 CaCl2 25.00 25.00 25.00 25.00 25.00 25.00 K2CrO4 15.00 16.00 17.00 18.00 19.00 20.00 蒸馏水 10.00 9.00 8.00 7.00 6.00 5.00 取上层清液 10.00 10.00 10.00 10.00 10.00 10.00 耗(NH4)2Fe(SO4)2 13.33 15.00 16.78 18.42 20.15 21.89 ⑤滴定测出上层清液中的 c( 2- 4CrO ),进而计算出上层清液中的 c(Ca2+),即得 Ksp(CaCrO4)。 回答下列问题: (1)步骤①中无需使用下列哪些仪器_______(填标号)。 (2)基态 Cr 原子的电子排布式为_______。 (3)步骤④中所得橙色溶液中铬元素的主要存在形式为_______(填化学式);滴定时还原产物为 Cr3+,写出反 应的离子方程式_______。 (4) 根据第 2 组滴定数据,计算得上层清液中 c( 2- 4CrO )=_______mol/L。 (5)滴定时,有一组数据出现了明显异常,所测 c( 2- 4CrO )偏大,原因可能有_______(填标号)。 A.滴定终点读数时仰视刻度线 B.达终点时滴定管尖嘴有标准液悬挂 C.盛装待测液的锥形瓶未润洗 D.摇动锥形瓶时有液体溅出 (6)利用上表数据经计算绘制出如下图点,请根据图点绘出溶度积曲线_________。 26 (7)请结合图线推测 Ksp(CaCrO4)≈_______(保留两位有效数字)。 【 答 案 】 (1). AC (2). 1s22s22p63s23p63d54s1 (3). Cr2O 2 7 (4). Cr2O 2 7 +6Fe2++14H+=6Fe3++2Cr3++7H2O (5). 0.1000 (6). AB (7). (8). 7.2×10-4 【解析】 【分析】 Cr2O 2 7 +6Fe2++14H+=6Fe3++2Cr3++7H2O,2 2- 4CrO +2H+ Cr2O 2 7 +H2O,得 c( 2- 4CrO ),根据溶解度曲线, 进而计算出上层清液中的 c(Ca2+),即得 Ksp(CaCrO4)。 【详解】(1)①配制 250 mL 待标定的 K2CrO4 溶液,称量一定质量的 K2CrO4 放到 500mL 的烧杯中,用量筒 量取 250mL 的水,加入烧杯中用玻璃搅拌,得体积约为 250mL 的溶液,步骤①中无需使用下列哪些仪器 100mL 的容量瓶、分液漏斗。故答案为:AC; (2)Cr 为 24 号元素,3d、4s 均为半充满结构,基态 Cr 原子的电子排布式为 1s22s22p63s23p63d54s1。故答案为: 1s22s22p63s23p63d54s1; (3)步骤④中加入 H2SO4 和 H3PO4 溶液酸化,2 2- 4CrO +2H+ Cr2O 2 7 +H2O,所得橙色溶液中铬元素的主 要存在形式为 Cr2O 2 7 (填化学式);滴定时还原产物为 Cr3+,反应的离子方程式 Cr2O 2 7 +6Fe2++14H+=6Fe3++2Cr3++7H2O。故答案为: Cr2O 2 7 ;Cr2O 2 7 +6Fe2++14H+=6Fe3++2Cr3++7H2O; 27 (4) 根据第 2 组滴定数据,由 Cr2O 2 7 +6Fe2++14H+=6Fe3++2Cr3++7H2O,2 2- 4CrO +2H+ Cr2O 2 7 +H2O, 得 c( 2- 4CrO )= 115.00mL 0.2000 ·L 3 10.00 mol mL ,计算得上层清液中 c( 2- 4CrO )=0.1000 mol/L。故答案为:0.1000; (5)滴定时,有一组数据出现了明显异常,所测 c( 2- 4CrO )偏大,根据浓度计算式 c( 2- 4CrO )= 1V mL 0.2000 ·L 3 10.00 mol mL 测 , A.滴定终点读数时仰视刻度线,V测偏大,c( 2- 4CrO )偏大,故A选; B.达终点时滴定管尖嘴有标准液悬挂,V测偏大,c( 2- 4CrO )偏大,故B选; C.盛装待测液的锥形瓶未润洗,对结果没有影响,故C不选; D.摇动锥形瓶时有液体溅出,V测偏小,c( 2- 4CrO )偏小,故D不选; 故答案为:AB; (6)利用上表数据经计算绘制出如下图点,注意忽略误差较大的点,根据图点绘出溶度积曲线包括蓝图: 。故答案为: ; (7)结合图线当 c( 2- 4CrO )=0.1000 mol·L-1,c(Ca2+)≈7.2×10-3 mol·L-1,推测 Ksp(CaCrO4)≈0.1000×7.2×10-3=7.2×10-4(保留两位有效数字)。故答案为:7.2×10-4。 18. 环氧乙烷是高效消毒剂,可用于口罩等医用品消毒,工业常用乙烯氧化法生产。 主反应:2CH2=CH2(g) + O2(g) 2 3Ag/α-Al O 2 (g) △H1=-209.8 kJ/mol 副反应:CH2=CH2(g) + 3O2(g)=2CO2(g)+ 2H2O(g) △H2=-1323.0 kJ/mol 回答下列问题: (1) C2H4 的燃烧热△H=-1411.0 kJ/mol,则环氧乙烷(g)的燃烧热△H=_______。 (2)以下既能加快反应速率又能提高环氧乙烷产率的方法有的_______ (填标号)。 A.降低温度 B.向容器中充入 N2 使压强增大 C.采用改性的催化剂 D.用空气替代氧气 28 (3)已知: (g)+HCl(g) Δ (l),合成过程中的温度与氯乙醇的平衡产率关系如 图 a,30℃下原料投料比与氯乙醇的平衡产率关系如图 b。 反应随温度升高平衡产率降低的可能原因为_______;其它条件不变时,降低环氧乙烷与 HCl 的投料比,环 氧乙烷的平衡转化率将_______(填“增大”“减小”或“不变”)。 (4)环氧乙烷经水解可得到乙二醇。乙二醇 易溶于水的原因为_______;写出乙二醇—氧气碱性燃料电池的 负极电极反应式:_______。 【答案】 (1). -1306.1kJ·mol-1 (2). C (3). 反应的△H<0,升高温度,平衡逆向移动,导致平衡产 率 降 低 (4). 增 大 (5). 乙 二 醇 分 子 中 有 2 个 -OH , 与 水 分 子 形 成 氢 键 (6). HOCH2CH2OH-10e-+14OH-=2 2- 3CO +10H2O 【解析】 【分析】 【详解】(1)已知 C2H4 的燃烧热△H=-1411.0 kJ/mol,则有 C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) △H3=-1411.0 kJ/mol , 根 据 盖 斯 定 律 , 该 反 应 ×2- 主 反 应 可 得 : (g)+O2(g)=2CO2(g)+2H2O(l) △H=2△H3-△H1=-1306.1kJ·mol-1; (2)A.降低温度会使得反应速率降低,A 不选; B.向容器中充入 N2 使压强增大,若该容器的体积恒定,则该反应的反应速率不变且环氧乙烷的产率不变, B 不选; C.催化剂可以增大反应速率,提高环氧乙烷的产率,C 选; D.用空气代替氧气,氧气的浓度降低,反应速率降低,D 不选; 答案选 C; 29 (3)已知: (g)+HCl(g) Δ (l),可能因为该反应的△H<0,升高温度,平衡逆 向移动,导致平衡产率降低,若其他条件不变时,降低环氧乙烷与 HCl 的投料比,则 HCl 的投料更多,环 氧乙烷的平衡转化率将增大; (4)乙二醇分子中有 2 个—OH,可与水分子形成氢键,因此乙二醇易溶于水,在乙二醇—氧气的碱性染料电 池中,乙二醇作负极失去电子发生氧化反应,在碱性条件下生成 2- 3CO 和 H2O,则负极的电极反应式为: HOCH2CH2OH-10e-+14OH-=2 2- 3CO +10H2O。 19. 化合物 H 是合成一种能治疗头风、 痈肿和皮肤麻痹等疾病药物的重要中间体,其合成路线如下: 已知下列信息: ①RCOOCH3+ Δ 多聚磷酸 +CH3OH ② 3 4 i.Na NH (l) ii.NH Cl, 回答下列问题: (1) A 的分子式为_______;D 中官能团的名称为_______。 (2) C 的结构简式为_______ 。 (3)合成路线中 D 到 E 的反应类型为_______。 (4)鉴别 E 和 F 可选用的试剂为_______ (填标号)。 A.FeCl3 溶液 b.溴水 c.酸性 KMnO4 溶液 d.NaHCO3 溶液 (5) G 到 H 的反应方程式为_______。 (6)有机物 W 是 C 的同系物,且具有以下特征: 30 i.比 C 少 3 个碳原子; ii.含甲基,能发生银镜反应; 符合上述条件的 W 有_______种;其中核磁共振氢谱峰面积之比为 1:2:2:2:3 的 W 的结构简式为_______。 【答案】 (1). C7H7Br (2). 羰基 (3). (4). 还原反应 (5). d (6). + CH3OH 2 4H SO 浓 + H2O (7). 12 (8). , 【解析】 【分析】 【详解】(1)根据 C 的成键特点,A 的分子式为 C7H7Br;D 中含有的官能团结构是碳氧双键,即官能团为羰 基; (2)根据已知信息的反应机理 ,由 D 的结构简式逆推 C 的结构简式, ,答案 C 的结构简式为 ; (3) D E 反应过程中,D 中的羰基被还原为羟基,所以反应类型为还原反应; (4)E 和 F 的结构上相差一个—COOH,应该利用—COOH 的性质验证 F 和 E 的不同,只有 NaHCO3 可以和 羧基反应,所以答案为 d; (5)根据已知信息,可以推断 G 的结构简式为 ,G 和 CH3OH 在浓硫酸、加热的条件下发生 31 酯化反应,化学方程式为 + CH3OH 2 4H SO 浓 + H2O; (6)由于 W 是 C 的同系物且比 C 少 3 个碳原子,所以 W 的分子式为 C9H10O2,W 的结构中含有一个 和一个 ,又因为 W 可以发生银镜反应,所以可以推断 W 中一定含有醛基,且醛基的存在形式 为 ,符合条件的 W 的结构简式有 , , , , , , , , , , , 共 12 种; 核磁共振氢谱图中有 5 个信号峰,面积比 1:2:2:2:3,符合条件的 W 的结构简式为 , ; 【点睛】注意分析题干中给定的已知信息,利用相似结构进行有机反应过程的推断。查看更多