安徽省蚌埠市教师2020届高三化学“我为高考命题”仿真模拟试题蚌埠二中6 1
安徽省蚌埠市教师2020届高三化学“我为高考命题”仿真模拟试题(蚌埠二中6)
可能用到的相对原子质量:Cr:52 Cl:35.5 H:1 O:16 C:12 N:14 Zn:65
7.“白墙黑瓦青石板,烟雨小巷油纸伞”,是著名诗人戴望舒《雨巷》中描述的景象,下列有关说法中错误的是( )
A.“白墙”的白色源于墙体表层的 Ca(OH)2
B.“做伞骨架的竹纤维的主要成分可表示为(C6H10O5)n
C.黑瓦”与陶瓷的主要成分都是硅酸盐
D.刷在伞面上的熟桐油是天然植物油,具有防水作用
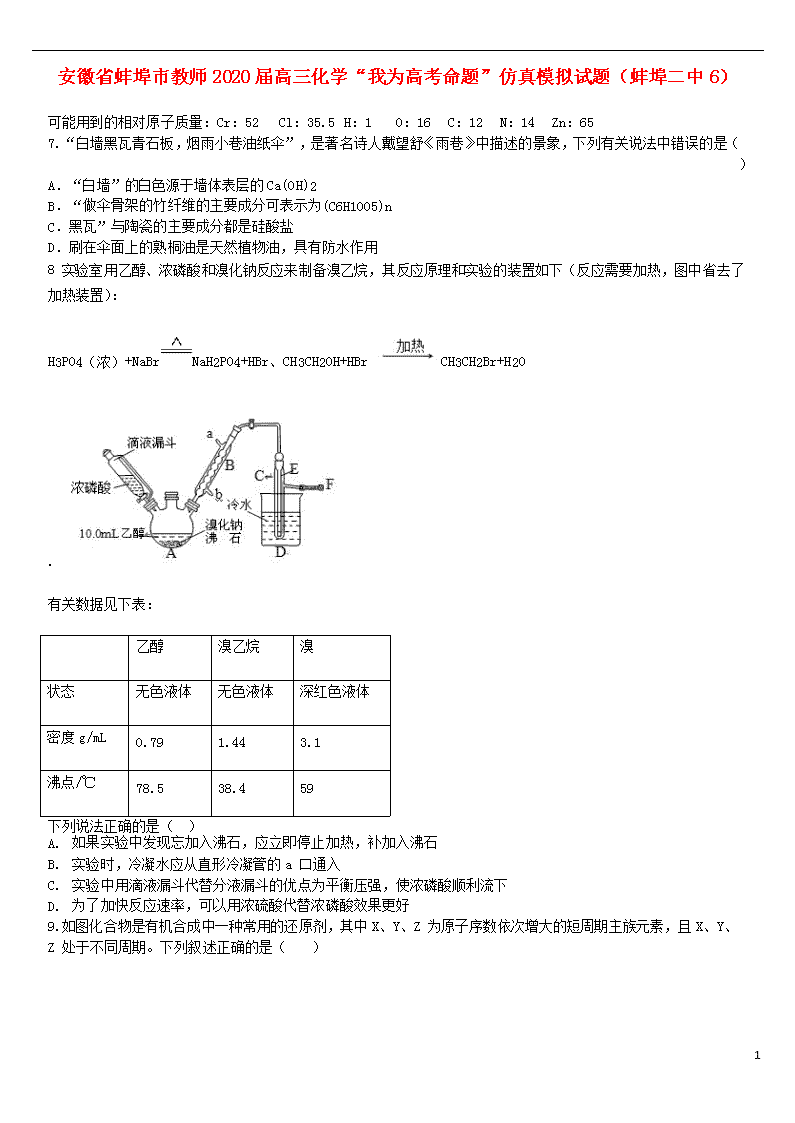
8 实验室用乙醇、浓磷酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了 加热装置):
H3PO4(浓)+NaBrNaH2PO4+HBr、CH3CH2OH+HBr CH3CH2Br+H2O
.
有关数据见下表:
乙醇
溴乙烷
溴
状态
无色液体
无色液体
深红色液体
密度 g/mL
0.79
1.44
3.1
沸点/℃
78.5
38.4
59
下列说法正确的是( )
A. 如果实验中发现忘加入沸石,应立即停止加热,补加入沸石
B. 实验时,冷凝水应从直形冷凝管的 a 口通入
C. 实验中用滴液漏斗代替分液漏斗的优点为平衡压强,使浓磷酸顺利流下
D. 为了加快反应速率,可以用浓硫酸代替浓磷酸效果更好
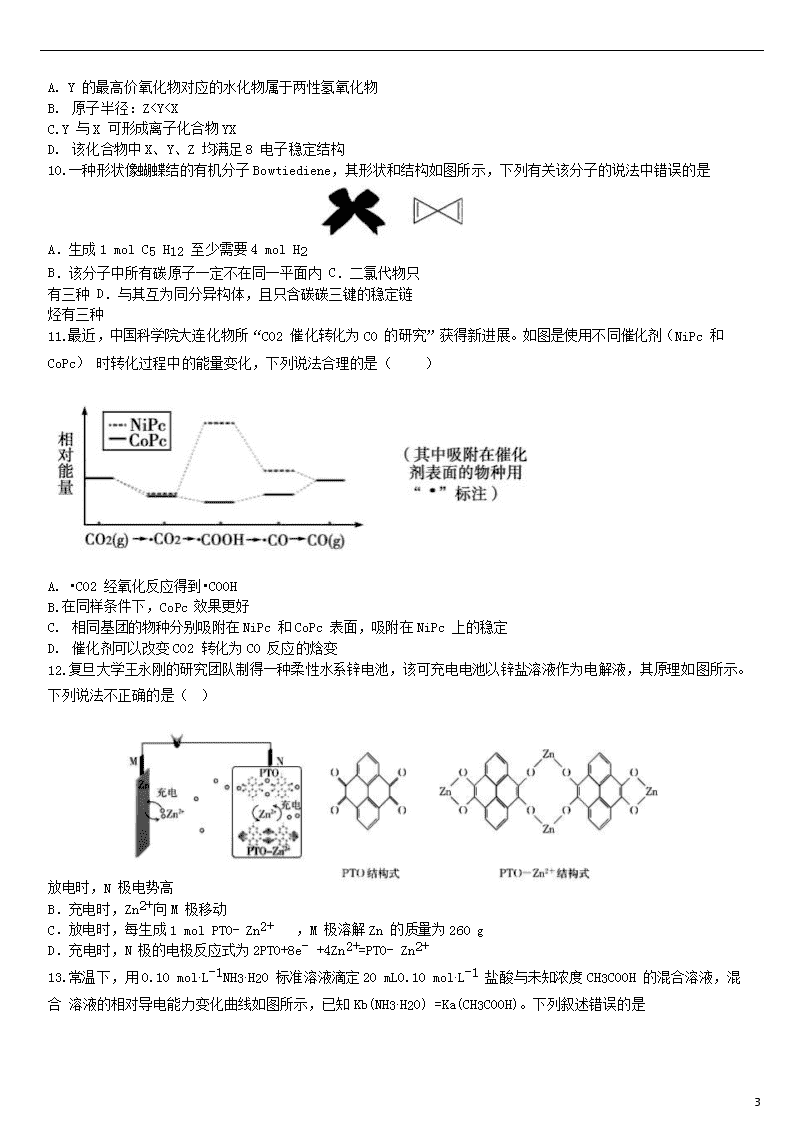
9.如图化合物是有机合成中一种常用的还原剂,其中 X、Y、Z 为原子序数依次增大的短周期主族元素,且 X、Y、
Z 处于不同周期。下列叙述正确的是( )
2
2
A. Y 的最高价氧化物对应的水化物属于两性氢氧化物
B. 原子半径:Z
c( CH3COOH)
D. c 点混合溶液中,c(NH4 ) >c(Cl ) >c(CH3COO ) >c(OH )>c(H )
+ - - - +
26.(15 分)TiO2 和 CaTiO3 都是光电转化材料。某研究小组利用钛铁矿(主要成分为 FeTiO3,还含有少量 SiO2 等杂 质)来制备 TiO2 和 CaTiO3,并利用黄钾铁矾 KFe3(SO4)2(OH)6),回收铁的工艺流程如图 1 所示:
回答下列问题:
(1)“氧化酸解”的实验中,控制反应温度为 150 ℃,不同氧化剂对钛铁矿酸解率的影响如图 2 所示。50 min 时, 要求酸解率大于 85%,所选氧化剂应为 ;采用 H2O2 作氧化剂时,其效率低的原 因可能是 。
(2 )向“ 氧化酸解” 的滤液①中加入尿素 CO(NH2)2 ,TiO2 + 转化为 TiO2 ,写出相应反应的离子方程式:
, 使用尿素而不直接通入 NH3 的原因是 。
(3)写出“高温煅烧”中由 TiO2 制备 CaTiO3 的化学方程式: 。
(4)Fe3+恰好沉淀完全时,溶液中 c(Fe3+)=1.0×10-5 mol∙L-1,计算此时溶液的 pH= 。
[Fe(OH)3 的 Ksp=1.0×10-39、水的 Kw=1.0×10-14]
(5)黄钾铁矾沉淀为晶体,含水量很少。回收 Fe3+时,不采用加入氨水调节 pH 的方法制取 Fe(OH)3 的原因是
。
27.(14 分)无水三氯化铬(CrCl3)为紫色晶体,在工业上主要用作媒染剂和催化剂,某化学小组用 Cr2O3 和 CCl4
在高温下制备无水三氯化铬,部分实验装置如图所示。
2
已知:①CrCl3 熔点为 83℃,易潮解,易升华,易溶于水但不易水解,高温下易被氧气氧化;②Cr2O3 和 CCl4
在高温下反应的产物为 CrCl3 和光气(COCl2)。请回答下列问题:
(1)装置 A 是氮气制备装置,氮气的作用是 。
(2)装置 B 的作用为 。装置 C 和装置 E 的水槽中应分别盛有 、 。
(3)装置 D 中生成 CrCl3 和光气(COCl2)的化学方程式为 。
(4)该实验装置有设计不合理的地方,请写出改进方法: (写一点即可)。
(5)产品中 CrCl3 质量分数的测定:
(i)称取 0.3000g 得到的 CrCl3 样品溶于水并于 250mL 容量瓶中定容。
7
(ii)取 25.00mL 样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的 Na2O2,稀释并加热煮沸,再加入 过量的 H2SO4 酸化,将 Cr3+氧化为 Cr2O2−;再加入过量的 KI 固体,加塞摇匀,使铬完全以 Cr3+形式存在
(iii)加入 1mL 指示剂,用 0.0250mol∙L−1 标准 Na2S2O3 溶液滴定至终点,平行测定三次,平均消耗标准 Na2S2O3
溶液 21.00mL(已知 2Na2S2O3+I2=Na2S4O6+2NaI)
①ii 中加入稍过量的 Na2O2 后要加热煮沸,其主要原因是 ;加入 KI 发生反应的离子方程式为
②滴定实验可选用的指示剂为 ,产品中 CrCl3 质量分数为 %(结果保留两位有效数字)
28.(14 分)合成氨技术的创立开辟了人工固氮的重要途径,解决了亿万人口生存问题。 回答下列问题:
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。
由图可知合成氨反应 N2(g)+3H2(g) 2NH3(g)的∆H= kJ∙mol-1。该历程中速率最快的一步的活化能(E)为
kJ∙mol-1。
(2)工业合成氨反应为:N2(g)+3H2(g) 2NH3(g),当进料体积比 V(N2)∶V(H2)=1∶3 时,平衡气体中 NH3 的物质 的量分数随温度和压强变化的关系如图所示:
2
①500℃时,反应的平衡常数 Kp(100MPa) Kp(30MPa)。(填“<”、“=”、“>”)
②500℃、30MPa 时,氢气的平衡转化率为 (保留 3 位有效数字),Kp= (MPa)-2(列出计算式)。
[Kp 为平衡分压代替平衡浓度计算求得的平衡常数(分压=总压×物质的量分数)]
(3)科学家利用电解法在常温常压下合成氨,工作时阴极区的微观示意图如图,其中电解液为溶解有三氟甲磺酸 锂和乙醇的惰性有机溶剂。
①阴极区生成 NH3 的电极反应式为 。
②下列说法正确的是 (填标号)。 A.该装置用金(Au)作催化剂,目的是降低 N2 的键能 B.三氟甲磺酸锂的作用是增强导电性
C.选择性透过膜可允许 N2 和 NH3 通过,防止 H2O 进入装置
35.(15 分)我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,直到近年来人们才研究出来其成分为
BaCuSi4O10,BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均具有 Cun+离子,n= ,基态时该阳离子的价电子排布式为 。
(2)“中国蓝”的发色中心是以 Cun+为中心离子的配位化合物,其中提供孤对电子的是 元素。
(3)合成“中国蓝”、“中国紫”的原料有 BaCO3,孔雀石 Cu2(OH)2CO3 和砂子(SiO2)。SiO2 晶体中 Si 原子的杂化轨道 是由 轨道(填轨道的名称和数目)和 轨道杂化而成的。
(4)现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源一种阴离子是正四面体的天然钡矿中,则 最可能的钡矿化学式是 。
(5)在 5500 年前,古代埃及人就己经知道如何合成蓝色颜料—“埃及蓝”CaCuSi4O10,其合成原料中用 CaCO3 代替 了 BaCO3,其它和“中国蓝”一致。CO32 一中键角∠OCO 为 。根据所学,从原料分解的角度判断“埃及蓝”的合成
温度比“中国蓝”更 (填“高”或“低”)。
2
(6)自然界中的 SiO2,硬度较大,主要原因是 。下图为 SiO2 晶胞中 Si 原子沿
2
z 轴方向在 xy 平面的投影图(即俯视投影图),其中 O 原子略去,Si 原子旁标注的数字表示每个 Si 原子位于 z 轴的
高度,则 SiA 与 SiB 的距离是 。
36.(15 分)麻黄素 M 是拟交感神经药。合成 M 的一种路线如图所示:
2
H+
已知:I.R—CH2OH
�¾C¾rO3¾® RCHO
2
+
II.R1-CHO+R-C≡CNa ¾H¾®
IV.
V.
请回答下列问题:
(1)D 的名称是 ;G 中含氧官能团的名称是 。
(2)反应②的反应类型为 ;A 的结构简式为 。
(3)写出反应⑦的化学方程式: 。
(4)X 分子中最多有 个碳原子共平面。
(5)在 H 的同分异构体中,同时能发生水解反应和银镜反应的芳香族化合物中,核磁共振氢谱上有 4 组峰,且峰 面积之比为 1∶1∶2∶6 的有机物的结构简式为 。
(6)已知:仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体 的路线 。
2
我为高考命题——理综化学部分
参考答案
题号
7
8
9
10
11
12
13
答案
A
C
C
D
B
D
D
26.(每空 2 分,共 14 分)
(1)KClO3 在温度较高时 H2O2 易分解[或产物中的 Fe3+可以催化 H2O2 的分解(其他合理答案也可,如 H2O2 氧化 能力弱)]
2
△
4
(2)TiO2++CO(NH2)2+2H2O=====TiO2+CO2↑+2NH+
�避免将溶液中 Fe3+沉淀
2
高温
(3)TiO2+CaCl2·2H2O=====CaTiO3+2HCl↑+H2O↑
(4)2.7
(5)Fe(OH)3 为絮状沉淀,不容易分离
27.(除标注外,每空 2 分,共 15 分)
(1)排出空气、吹出 CCl4 蒸汽、吹出产物及尾气(3 分)
(2)除去氮气中水蒸气 (1 分) 热水(1 分) 冷水 (1 分)
△
(3)Cr2O3+3CCl4====2CrCl3+3COCl2
(4)将连接装置 D、E 的细导管改成粗导管 (1 分)
7
(5)除去溶解的氧气,防止将 I−氧化 (1 分) Cr2O2−+6I−+14H+=2Cr3++3I2+7H2O 淀粉溶液 (1 分) 92.5
2
28.(每空 2 分,共 14 分) (1). -92 (2). 17 (3). = (4). 33 3% (5).
�(30 ´ 20%)2
(30 ´ 20%)(30 ´ 60%)3
�
(6).
2
N2+6e-+6C2H5OH=2NH3+6C2H5O- (7). BC
35.(除标注外,每空 2 分,共 15 分)
2
(1)2 (1 分)
�3d9
�(1 分)
2
(2)O 或氧
(3)1 个 3s (1 分) 3 个 3p (1 分)
(4) BaSO4
(5)120o (1 分) 低 (1 分)
2
(6) SiO2 是一种空间网状的共价晶体,共价键结合较为牢固
�2 d (3 分)
2
2
36.(除标注外,每空 2 分,共 15 分)
(1)苯甲醛(1 分)
羟基 (1 分) (2)取代反应 (1 分)
(3)
(4)10
+CH3NH2 ¾H¾2O¾®
+H2O
(5) (每个结构 1 分,共 2 分)
(6) (4 分)
2