- 2021-05-13 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版铝及其重要化合物学案
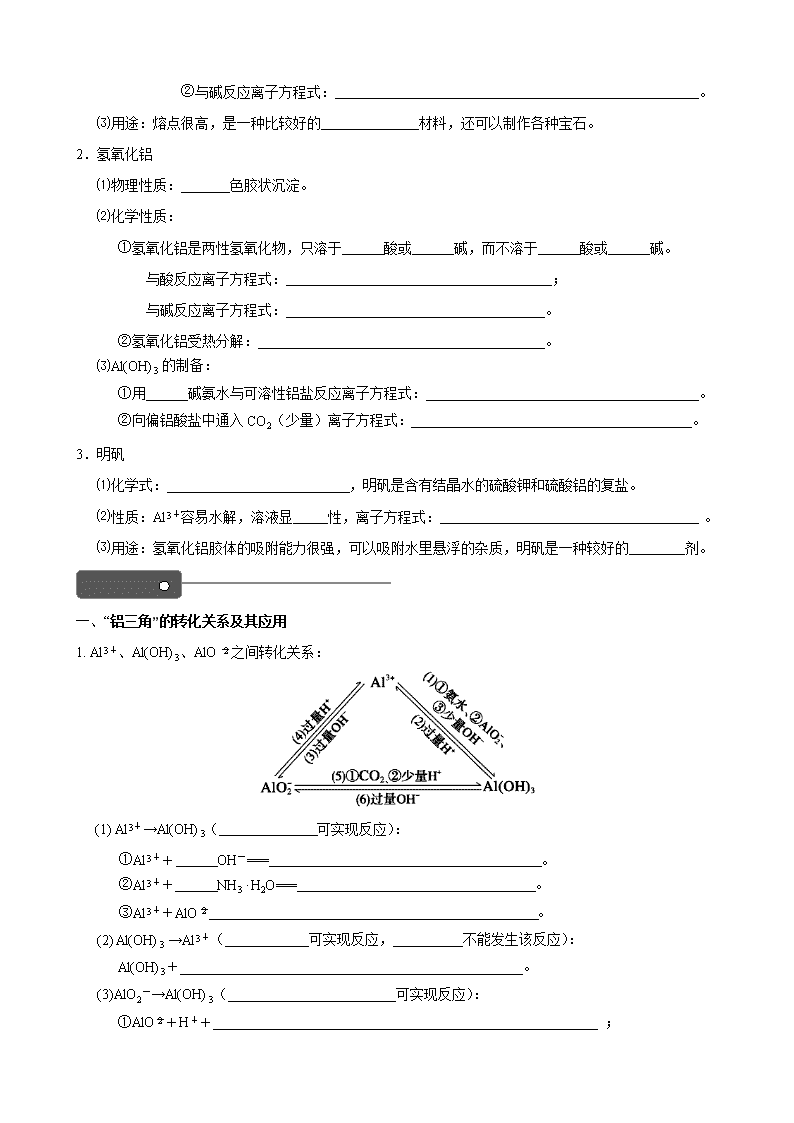
第三章 金属及其化合物 第二节 铝及其重要化合物 一、铝的主要性质及应用 1.存在及物理性质 ⑴铝位于元素周期表 。铝元素在地壳中含量丰富,仅次于硅排第三位,在金属当中是含量占 位。自然界中的铝全部以 态存在。 ⑵铝为 色固态,金属,特别的是铝的粉末是白色,工业称为“银粉”一般金属的汾末是黑色的。 ⑶铝熔点为660.40C,沸点为24670C密度为2.7g·cm-3,导电性仅次于银、铜和金。 2.化学性质:结构分析——铝原子最外层有3个电子,表现 价,易失去表现 性。 ⑴跟非金属单质反应 ①与氧气常温时反应方程式: 。 现象:在表面生成一层 ,保护内部金属。使Al 尽管很活泼,但很耐腐蚀。 ②与氧气点燃时反应:4 Al+3 O22Al2O3 现象: 。原因 。 ③和卤素反应,2 Al+3 X2 = 2AlX3(X2可以是Cl2、Br2)。此外,也能生成Al2S3、AlN、Al4C3。 ⑵铝与酸反应 ①与非氧化性强酸(稀硫酸、盐酸)反应,离子方程式: 。 ②与氧化性酸 常温下,铝、铁遇 、 发生钝化,加热时能反应。 与热浓硫酸: ; 与稀硝酸反应: ; ⑶铝与强碱溶液反应: ; 离子方程式: ; ⑷铝热反应:2 Al+Fe2O3 。 铝热剂: 与活泼性在铝以后的 的混合物称为铝热剂。 铝热反应用途:野外焊接钢轨,可用于冶炼Ni、Mn、V、W、Cr等难熔金属。 二、铝的重要化合物 1.氧化铝 ⑴物理性质: 色 态,熔点 (2045℃), 溶于水。 ⑵化学性质:是 氧化物,①与酸反应离子方程式: 。 ②与碱反应离子方程式: 。 ⑶用途:熔点很高,是一种比较好的 材料,还可以制作各种宝石。 2.氢氧化铝 ⑴物理性质: 色胶状沉淀。 ⑵化学性质: ①氢氧化铝是两性氢氧化物,只溶于 酸或 碱,而不溶于 酸或 碱。 与酸反应离子方程式: ; 与碱反应离子方程式: 。 ②氢氧化铝受热分解: 。 ⑶Al(OH)3的制备: ①用 碱氨水与可溶性铝盐反应离子方程式: 。 ②向偏铝酸盐中通入CO2(少量)离子方程式: 。 3.明矾 ⑴化学式: ,明矾是含有结晶水的硫酸钾和硫酸铝的复盐。 ⑵性质:Al3+容易水解,溶液显 性,离子方程式: 。 ⑶用途:氢氧化铝胶体的吸附能力很强,可以吸附水里悬浮的杂质,明矾是一种较好的 剂。 一、“铝三角”的转化关系及其应用 1. Al3+、Al(OH)3、AlO之间转化关系: (1) Al3+→Al(OH)3( 可实现反应): ①Al3++ OH-=== 。 ②Al3++ NH3·H2O=== 。 ③Al3++AlO 。 (2) Al(OH)3 →Al3+( 可实现反应, 不能发生该反应): Al(OH)3+ 。 (3)AlO2-→Al(OH)3( 可实现反应): ①AlO+H++ ; ②AlO+CO2 。 (4) Al(OH)3→AlO2-( 可实现反应, 不能发生该反应): Al(OH)3+; (5) Al3+→AlO2-( 可实现反应,): Al3++ ; (6) AlO2-→Al3+( 可实现反应): AlO+ 。 2.常见解题应用: ⑴离子共存问题: ①Al3+因双水解程度较大,与OH-,及S2-、HS-、AlO、CO32-、HCO3-等弱酸根均不能大量共存。 ②AlO和OH-相同,只与强碱阳离子如Na+、K+、Ba2+大量共存,与其它弱碱阳离子都不共存。 ⑵鉴别AlCl3和NaOH(利用滴加顺序不同,现象不同) ①AlCl3溶液中滴加NaOH溶液现象为: 。 ②NaOH溶液中滴加AlCl3溶液现象为: 。 ⑶分离提纯:分离Al与其他金属的混合物、分离Al2O3与其他金属氧化物、分离Al3+与其他金属阳离子时。都用 溶液。 ⑷不同形式铝的化合物之间转化关系,可以参照图示分析,隔位物质间能发生反应,生成中间产物;若有两种中间产物,则与反应物用量有关:HCl——AlCl3——Al(OH)3——NaAlO2——NaOH。例NaOH与AlCl3反应,可能生成Al(OH)3,也可能生成NaAlO2;AlCl3与NaAlO2反应,只能生成Al(OH)3。 二、氢氧化铝沉淀的图象分析 操作 现象 图像 离子方程式 向一定量的AlCl3 溶液中逐滴加入NaOH 溶液至过量。 向一定量的NaAlO 2 溶液中逐滴加入稀盐酸溶液至过量。 向一定量的NaOH 溶液中逐滴加入AlCl3 溶液至过量。 向一定量的盐酸 溶液中逐滴加入NaAlO 2溶液至过量。 向一定量的AlCl3 溶液中逐滴加氨水溶液至过量。 向一定量的NaAlO 2 溶液中缓慢通入CO2至过量。 三、铝与酸、碱反应生成H2的量的关系 1.等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气体积比= 。 2.足量的铝分别与等物质的量的盐酸和氢氧化钠反应,产生氢气的体积比为=。 3.一定量的铝分别与一定量的盐酸和氢氧化钠反应,产生氢气的体积比为 ≤≤ ,则必定是:①铝与盐酸反应时,铝过量而盐酸不足;②铝与氢氧化钠反应时,铝不足而氢氧化钠过量。解题时应充分利用上述过量关系。 1.向30 mL 1 mol·L-1的AlCl3溶液中逐渐加入浓度为4 mol·L-1的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为 ( ) A.3 mL B.7.5 mL C.15 mL D.17.5 mL 2.甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为 ( ) A.5.4 g B.3.6 g C.2.7 g D.1.8 g 参考答案 【基础落实】 一、铝的主要性质及应用 1. ⑴第三周期ⅢA族 第一 化合 ⑵银白 2. +3 还原 ⑴①4 Al+3 O2===2Al2O3 致密的氧化膜 ②铝表面熔化但不滴落 生成的Al2O3熔点很高,把已经熔化的铝兜住了 ⑵①2 Al+6 H+ =2Al3++3H2↑ ②浓硫酸 浓硝酸 2Al+6H2SO4(浓)Al2(SO4)3+3SO2↑+6H2O 1 Al+4 HNO3(稀) === Al(NO3)3+NO↑+2H2O ⑶2Al+2NaOH+2H2O===2NaAlO2+3H2↑ 2Al+2OH-+2H2O = 2 AlO2-+3H2↑ ⑷Al2O3+2Fe 铝粉 金属氧化物 二、铝的重要化合物 1.⑴白 固 高 难 两性 ⑵Al2O3+6H+=2Al3++3H2O Al2O3+2OH- ===2AlO2-+H2O ⑶耐火 2.⑴白 ⑵强 强 弱 弱 Al(OH)3+3H+=Al3++3H2O Al(OH)3+OH-=AlO2-+H2O 2 Al(OH)3Al2O3+3H2O ⑶弱 Al3++3NH3·H2OAl(OH)3↓+3NH4+ 2 AlO2-+ CO2+3H2O2 Al(OH)3↓+ CO32- 3.⑴KAl(SO4)2·12H2O ⑵酸 Al3++3H2OAl(OH)3 +3H+ ⑶净水 【规律总结】 一、“铝三角”的转化关系及其应用 1. (1)强碱弱碱均 3 Al(OH)3↓ 3 Al(OH)3↓+3NH4+ 3 +6H2O===4Al(OH)3↓ (2) 强酸 弱酸 3 H+===Al3++3H2O (3) 强酸弱酸均 H2O===Al(OH)3↓ +2H2O===Al(OH)3↓+HCO3- (4) 强碱 弱碱 OH-===AlO2-+2H2O (5) 只有强碱且过量 4OH-=== AlO2-+2H2O (6) 只有强酸且过量 4H+===Al3++2H2O 2.⑵先产生白色沉淀,后沉淀溶解 开始无明显现象,后产生白色沉淀,沉淀不溶解。⑶强碱或NaOH 二、氢氧化铝沉淀的图象分析 操作 现象 图像 离子方程式 立即产生白色沉淀→渐多→最多→减少→消失 Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O 立即产生白色沉淀→渐多→最多→减少→消失 AlO2-+H++H2O= Al(OH)3↓ Al(OH)3+3H+=Al3++3H2O 无沉淀→出现沉淀→渐多→最多→沉淀不消失 Al3++4OH-= AlO2-+2H2O Al3++3AlO2-+6H2O=4Al(OH)3↓ 无沉淀→出现沉淀→渐多→最多→沉淀不消失 AlO2-+4H+= Al3++2H2O Al3++3AlO2-+6H2O=4Al(OH)3 立即产生白色沉淀→渐多→最多→沉淀不消失 Al3++3NH3·H2O=Al(OH)3↓+3NH4+ Al(OH)3与NH3·H2O不 反应 立即产生白色沉淀→渐多→最多→沉淀不消失 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- CO32-+ CO2+H2O=2HCO3- 三、铝与酸、碱反应生成H2的量的关系 1. 1∶1 2. 1∶3 3. 1/3 1/1 【对点训练】 1. B 2. A查看更多