- 2021-05-12 发布 |
- 37.5 KB |
- 15页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
备战2018高考题和高考模拟题化学分项版汇编专题08电化学及其应用
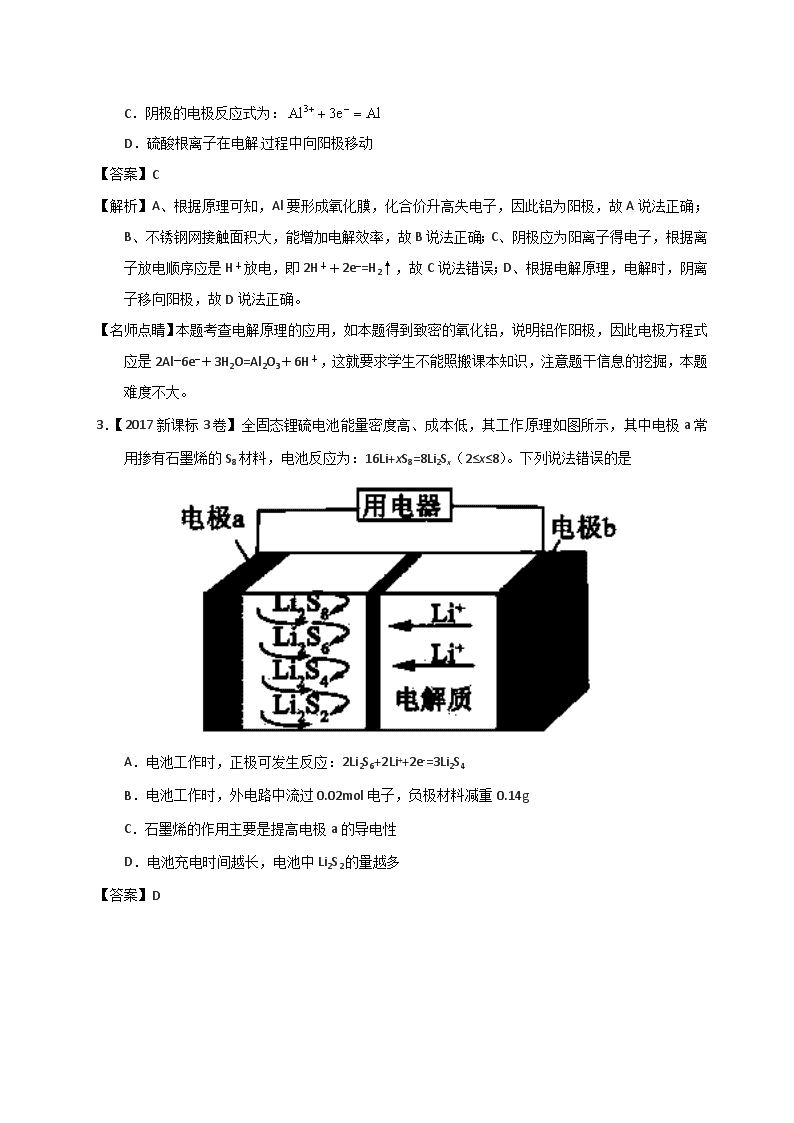
2017年高考试题, 1.【2017新课标1卷】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是 A.通入保护电流使钢管桩表面腐蚀电流接近于零 B.通电后外电路电子被强制从高硅铸铁流向钢管桩 C.高硅铸铁的作用是作为损耗阳极材料和传递电流 D.通入的保护电流应该根据环境条件变化进行调整 【答案】C 【名师点睛】该题难度较大,明确电化学原理是以及金属的防腐蚀原理是解答的关键,钢管桩表面腐蚀电流的理解是难点,注意题干信息的挖掘,即高硅铸铁为惰性辅助阳极,性质不活泼,不会被损耗。 2.【2017新课标2卷】用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为混合溶液。下列叙述错误的是 A.待加工铝质工件为阳极 B.可选用不锈钢网作为阴极 C.阴极的电极反应式为: D.硫酸根离子在电解过程中向阳极移动 【答案】C 【解析】A、根据原理可知,Al要形成氧化膜,化合价升高失电子,因此铝为阳极,故A说法正确;B、不锈钢网接触面积大,能增加电解效率,故B说法正确;C、阴极应为阳离子得电子,根据离子放电顺序应是H+放电,即2H++2e−=H2↑,故C说法错误;D、根据电解原理,电解时,阴离子移向阳极,故D说法正确。 【名师点睛】本题考查电解原理的应用,如本题得到致密的氧化铝,说明铝作阳极,因此电极方程式应是2Al−6e−+3H2O=Al2O3+6H+,这就要求学生不能照搬课本知识,注意题干信息的挖掘,本题难度不大。 3.【2017新课标3卷】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是 A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4 B.电池工作时,外电路中流过0.02mol电子,负极材料减重0.14g C.石墨烯的作用主要是提高电极a的导电性 D.电池充电时间越长,电池中Li2S2的量越多 【答案】D 【名师点睛】考查二次电池的使用,涉及原电池工作原理,原电池工作时负极发生氧化反应,正极发生还原反应,而电池充电时,原来的负极连接电源的负极为电解池的阴极,发生还原反应,而原来的正极连接电源的正极为电解池的阳极发生氧化反应,解题是通过结合反应原理,根据元素化合价的变化,判断放电时正负极发生的反应,再结合电解质书写电极反应方程式。 4.【2017江苏卷】下列说法正确的是 A.反应N2(g)+3H2(g)2NH3(g)的ΔH<0,ΔS>0 B.地下钢铁管道用导线连接锌块可以减缓管道的腐蚀 C.常温下,Ksp=5.6×10−12,pH=10的含Mg2+溶液中,c(Mg2+)≤5.6×10−4mol·L−1 D.常温常压下,锌与稀H2SO4反应生成11.2LH2,反应中转移的电子数为6.02×1023 【答案】BC 【名师点睛】本题考查了对熵变、金属的电化学防腐措施、难溶电解质的沉淀溶解平衡、氧化还原反应中的电子转移、气体摩尔体积以及阿伏加德罗常数的掌握情况。要求学生会判断一些常见反应的熵变,能合理运用熵判据和焓判据来判断一个反应能否自发进行;搞懂牺牲阳极的阴极保护法和外接电流的阴极保护法的原理及其区别;会进行有关溶度积的简单计算;会判断氧化还原反应中电子转移的方向和数目;弄清气体摩尔体积的使用条件及阿伏加德罗常数的含义和近似值。 2017届高考模拟试题, 5.【河南省2017届高考诊断卷(A)】含氯苯()的废水可通过加入适量乙酸钠,设计成微生物电池将氯苯转化为苯而除去,其除去原理如图所示,下列叙述正确的是 A.A极为负极,发生氧化反应 B.H+由A极穿过质子交换膜到达B极 C.A 极电极反应式为+2e-+H+=Cl-+ D.反应后电解液的pH升高 【答案】C 点睛:本题考查新型电池,为高频考点,注意把握原电池的工作原理以及电极反应式的书写,解答本题的关键是根据物质的性质判断原电池的正负极,另外注意离子的移动方向,D选项是解答的易错点,注意结合电极反应式或总反应式判断。 6.【葫芦岛协作体2017届下学期模拟考试(6月)】金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n。己知:电池的 “理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是( ) A.采用多孔电极的目的是提髙电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面 B.比较Mg、Al、Zn三种金属一空气电池,Al -空气电池的理论比能量最高 C.M-空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne-=4M(OH)n D.在M-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 【答案】C 【解析】A.反应物接触面积越大,反应速率越快,所以采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面,从而提高反应速率,故A正确;B.电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,则单位质量的电极材料失去电子的物质的量越多则得到的电能越多,假设质量都是1g时,这三种金属转移电子物质的量分别为×2=mol、×3=mol、×2=mol,所以Al-空气电池的理论比能量最高,故B正确;C.正极上氧气得电子和水反应生成OH-,因为是不阴离子交换膜,所以阳离子不能进入正极区域,则正极反应式为O2+2H2O+4e-=4OH-,故C错误;D.负极上Mg失电子生成Mg2+,为防止负极区沉积Mg(OH)2,则阴极区溶液不能含有大量OH-,所以宜采用中性电解质及阳离子交换膜,故D正确;故选C。 点睛:本题考查原电池原理,为高频考点,侧重考查学生分析判断、获取信息解答问题及计算能力,明确各个电极上发生的反应、离子交换膜作用、反应速率影响因素、氧化还原反应计算是解本题关键。本题的易错选项是C,要注意阴离子交换膜使得阳离子Mn+不能进入正极区域。 7.【湖南省2017年冲刺预测卷(六)】浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。下列有关该电池的说法错误的是 A.电池工作时,Li+通过离子电子导体移向b区 B.电流由X极通过外电路移向Y极 C.正极发生的反应为:2H++2e-=H2↑ D.Y极每生成1molCl2,a区得到2molLiCl 【答案】A 点睛:本题考查原电池的工作原理,为高频考点,把握总反应式结合物质所含元素化合价的变化判断原电池的正负极、电极方程式的书写方法为解答的关键,侧重分析与应用能力的考查选项D是解答的难点,注意电荷守恒的应用。 8.【徐州市2017届考前模拟冲刺打靶卷】一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示,下列说法正确的是 A.该电池能在高温下工作 B.该电池工作时,中间室中的Cl-移向右室 C.正极上发生的电极反应:2NO3-+ 6H2O + 10e-═ N2↑+ 12OH- D.若有机废水中有机物用C6H12O6表示,每消耗1molC6H12O6转移4mol电子 【答案】C 9.【虎林市2017届摸底考试(最后冲刺)】新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4 +4H2O2=NaBO2 +6H2O,有关的说法不正确的是 A.纳米MnO2层的作用是提高原电池的工作效率 B.放电过程中,Na+从B极区移向A极区 C.电池负极的电极反应为:BH4 +8OH- - 8e一 =BO2-+6H2O D.在电池反应中,每消耗1L1mol/LH2O2溶液,理论上流过电路中的电子为2mol 【答案】B 点睛:本题考查了原电池原理,根据微粒中化合价变化确定正负极是解答本题的思维方法。本题的难点是电极反应式书写。由工作原理装置图可知,负极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极反应式为H2O2+2e-=2OH-。 10.【淄博市2017届仿真模拟(打靶卷)】电池式氧传感器原理构造如图,可测定O2的含量。工作时铅极表面会逐渐附着Pb(OH)2。下列说法不正确的是 A.Pt电极上发生还原反应 B.随着使用,电解液的pH逐渐减小 C.ammolO2反应,理论上可使Pb电极增重68amg D.Pb电极上的反应式为Pb+2OH--2e-=Pb(OH)2 【答案】B 【解析】A、铅做负极失电子产生铅离子与氢氧根离子反应生成氢氧化铅,则铂电极做正极,发生还原反应,选项A正确;B、负极反应式:2Pb+4OH--4e-=2Pb(OH)2,正极反应式:O2+4e-+2H2O=4OH-,总反应式为:2Pb+O2+2H2O=2Pb(OH)2,反应过程溶液PH不变,选项B不正确;C、根据反应2Pb+O2+2H2O=2Pb(OH)2,ammolO2反应,理论上可使Pb电极增重4ammol×17g/mol=68amg,选项C正确;D、Pb电极为负极,反应式为Pb+2OH--2e-=Pb(OH)2,选项D正确。答案选B。 点睛:本题综合性较强,考查的是原电池与电解池工作原理、盐类水解、平衡常数等。 11.【镇江市2017届三模(最后一卷)】以熔融Na2CO3为电解质,H2和CO混合气为燃料的电池原理如下图所示。 下列说法正确的是 A.b是电池的负极 B.a电极的反应为:CO+CO32ˉ-2eˉ== 2CO2;H2+CO32ˉ-2eˉ== H2O+CO2 C.a电极上每消耗22.4L原料气,电池中转移电子数约为2╳6.02╳1023 D.a、b两极消耗的气体的物质的量之比是1︰1 【答案】B 12.【沈阳市2017届第三次模拟】下图是用于航天飞行器中的一种全天候太阳能电化学电池在光照时的工作原理。下列说法正确的是 A.该电池与硅太阳能电池供电原理相同 B.光照时,H+由a极室通过质子膜进入b极室 C.夜间无光照时,a电极流出电子 D.光照时,b极反应式是VO2++2OH--e-=VO2++H2O 【答案】C 点睛:本题考查原电池知识,侧重于原电池的工作原理的考查,注意把握电极反应的判断,把握电极方程式的书写,为解答该类题目的关键。 13.【潍坊市2017届第三次模拟】用惰性电极电解FeSO4溶液制备高纯铁的原理如下图所示。下列说法错误的是 A.阳极主要发生反应:Fe2+-e-=Fe3+ B.可用高纯铁电极作阴扱 C.电解液中的SO42-由右向左通过阴离子交换膜 D.电解法制备髙纯铁总反应:3Fe2+Fe+2Fe3+ 【答案】C 【解析】A、根据图中信息可知,阳极亚铁离子失电子产生铁离子,发生的电极反应为:Fe2+-e-=Fe3+,选项A正确;B、可用高纯铁电极作阴极,阴极上亚铁离子得电子产生铁单质析出在高纯铁电极上,选项B正确;C、电解池中阴离子SO42-,定向移动到阳极,故由左向右通过阴离子交换膜,选项C错误;D、电解法制备高纯铁阳极电极反应式为:2Fe2+-2e-=2Fe3+,阴极电极反应式为:Fe2++2e-=Fe,总反应为:3Fe2+Fe+2Fe3+,选项D正确。答案选C。 14.【石家庄市2017届冲刺模考】丙烷(C3H8)熔融盐燃料电池和锌蓄电池均为用途广泛的直流电源,放电时二者的总反应分别为C3H8+5O2=3CO2+4H2O,2Zn+O2=2ZnO。用丙烷(C3H8)燃料电池为锌蓄电池充电的装置如图所示,下列说法不正确的是 A.物质M为CO2 B.燃料电池消耗1mo1O2时,理论上有4molOH-透过b膜向P电极移动 C.a膜、b膜均适宜选择阴离子交换膜 D.该装置中,锌蓄电池的负极反应式为Zn+2OH--2e-=ZnO+H2O 【答案】D 15.【宁德市2017届第三次质量检查】一种钌(Ru)配合物光敏太阳能电池工作原理及电池中发生的反应如下所示: 下列说法正确的是 A.电极X为电池的正极 B.电池工作时,电能转变为光能 C.电池工作时,电极Y上发生还原反应 D.电池的电解质溶液中I-和I3-的浓度不断减少 【答案】C 点睛:原电池正负极的判断方法:1、根据电极材料的活泼性判断:负极:活泼性相对强的一极;正极:活泼性相对弱的一极。2、根据电子流向或电流的流向判断:负极:电子流出或电流流入的一极;正极:电子流入或电流流出的一极。3 、根据溶液中离子移动的方向判断:负极:阴离子移向的一极;正极:阳离子移向的一极。4、根据两极的反应类型判断:负极:发生氧化反应的一极;正极:发生还原反应的一极。5、根据电极反应的现象判断:负极:溶解或减轻的一极;正极:增重或放出气泡的一极。 16.【聊城市2017届第三次模拟】用石墨作电极电解KCl和CuSO4(等体积混合)混合溶液,电解过程中溶液pH随时间t的变化如图所示,下列说法正确的是 A.ab段H+被还原,溶液的pH增大 B.cd段相当于电解水 C.c点时加人适量CuCl2固体,电解液可恢复原来浓度 D.原溶液中KCl和CuSO4的物质的量浓度之比为2:1 【答案】B 【解析】用惰性电极电解等体积的KCl和CuSO4混合溶液,阴极离子放电顺序是Cu2+>H+,阳极上离子放电顺序是Cl->OH-,电解过程中分三段:第一阶段:阳极上电极反应式为2Cl--2e-=Cl2↑、阴极电极反应式为Cu2++2e-=Cu,铜离子浓度减小,水解得到氢离子浓度减小,溶液pH上升;第二阶段:阳极上电极反应式为4OH--4e-=2H2O+O2↑,阴极反应先发生Cu2++2e-=Cu,反应中生成硫酸,溶液pH降低;第三阶段:阳极电极反应式为4OH--4e-=2H2O+O2↑、阴极电极反应式为2H++2e-=H2↑,实质是电解水,溶液中硫酸浓度增大,pH继续降低。A.ab段由于铜离子浓度减小,水解得到氢离子浓度减小,溶液pH上升,铜离子为被还原,A错误;B.由上述分析可知,cd段相当于电解水,B正确;C.电解至c点时,溶液中溶质为硫酸、硫酸钾,往电解液中加入适量CuCl2固体,不能使电解液恢复至原来的浓度,C错误;D.图象中具体数量关系未知,不能计算原混合溶液中KCl和CuSO4的浓度之比,D错误,答案选B。 点睛:本题考查电解原理,明确电解过程中溶液中离子放电顺序是解答本题的关键,注意根据电解过程中溶液中氢离子浓度变化判断发生的反应,选项D是易错点。 17.【南昌市2017届第三次模拟】Al—Ag2O 电池可用作水下动力电源,其原理如图所示。电池工作时,下列说法错误的是 A.电子由Al电极通过外电路流向Ag2O/Ag电极 B.电池负极附近溶液pH升高 C.正极反应式为Ag2O+2e-+H2O=2Ag+2OH- D.负极会发生副反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 【答案】B 点睛:本题考查化学电源新型电池,为高频考点,侧重考查学生的分析能力,解答本题的关键是能正确书写电极方程式,做题时注意体会书写方法。本题中原电池工作时Al被氧化,为负极,电极反应为Al-3e-+4OH-=AlO2-+2H2O,Ag2O被还原,为正极,电极反应式为Ag2O+2e-+H2O=2Ag+2OH-。 18.【太原市2017届第三次模拟】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。该电池工作时的总反应为: NH3·BH3+ 3H2O2= NH4BO2+ 4H2O.下列说法正确的是( ) A.负极附近溶液的PH增大 B.正极的反应式为:H2O2+ 2H++2e-=2H2O C.电池工作时,BO2-通过质子交换膜向正极移动 D.消耗3.lg氨硼烷,理论上转移0.2mol电子 【答案】B 19.【广西2017届5月份考前模拟】在微生物作用下电解有机废水(含CH3COOH ),可获得清洁能源H2。其原理如图所示。不正确的是 A.通电后,H+通过质子交换膜向右移动,最终右侧溶液pH减小 B.电源B极为负极 C.与电源A极相连的惰性电极上发生的反应为CH3COOH-8e-+2H2O=2CO2↑+8H+ D.通电后,若有0 .1molH2生成,则转移0.2mol 电子 【答案】A 【解析】A、在阴极上氢离子得电子生成氢气,但是阳离子氢离子会经过交换膜进入阴极室,阴极室的pH几乎保持不变,A错误;B、右侧产生氢气,说明是阴极,右侧B电极是电源的负极,B正确;C、在阳极上CH3COOH失电子生成二氧化碳,电极反应式为CH3COOH-8e-+2H2O=2CO2↑+8H+,C正确;D、在阴极上氢离子得电子生成氢气,即2H++2e-=H2↑,因此若有0.1molH2生成,则转移0.2mol电子,D正确,答案选A。 20.【江西省重点中学协作体2017届第二次联考】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料。下列说法一定正确的是( ) A.该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路 B.电极B附近的HNO3浓度增大 C.A电极的反应为:NO2-e-+H2O==NO3-+2H+ NO-3e-+2H2O===NO3-+4H+ D.该电池工作时,每消耗11.2LO2(标准状况下),可以除去含1molNO和NO2的混合尾气 【答案】C 点睛:本题考查了原电池原理,涉及电极反应式的书写、离子的移动方向判断等知识点,易错选项是CD,物质得失电子与电极的关系,氮的氧化物失电子数目不同,为易错点。 查看更多