- 2021-05-12 发布 |
- 37.5 KB |
- 15页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学第一轮复习课件学案二 氧化还原反应规律在配平及在定量测定中的应用-考点指导3 氧化还原滴定
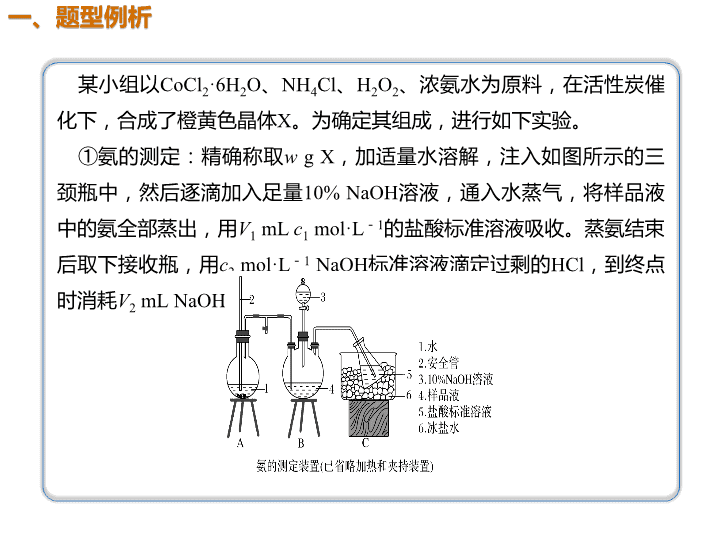
01 02 03 04 解题模板 题型例析 方法指导 典例剖析 某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催 化下,合成了橙黄色晶体X。为确定其组成,进行如下实验。 ①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三 颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品液 中的氨全部蒸出,用V1 mL c1 mol·L-1的盐酸标准溶液吸收。蒸氨结束 后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点 时消耗V2 mL NaOH溶液。 ②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定, K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为 砖红色)。 回答下列问题: (1)用NaOH标准溶液滴定过剩的HCl时,应使用________式滴定管, 可使用的指示剂为____________。 (2)测定氨前应该对装置进行气密性检验,若气密性不好,测定结果 将________(填“偏高”或“偏低”)。 ( 3 ) 样 品 中 氨 的 质 量 分 数 表 达 式 为 _________________________________________________。 ( 4 ) 测 定 氯 的 过 程 中 , 使 用 棕 色 滴 定 管 的 原 因 是 ____________________________。 (5)经测定,样品X中钴、氨和氯的物质的量之比为1∶ 6∶ 3,钴的 化 合 价 为 _ _ _ _ _ _ _ _ 。 制 备 X 的 化 学 方 程 式 为 ____________________________________________________________ _ _ _ _ ; X 的 制 备 过 程 中 温 度 不 能 过 高 的 原 因 是 _________________________________。 碱 酚酞或甲基橙 偏低 防止硝酸银见光分解 +3 2CoCl2+2NH4Cl+10NH3+H2O2===2[Co(NH3)6]Cl3+2H2O 温度过高过氧化氢分解、氨气逸出 消耗的盐酸量减小 解析 第一步:审读题干信息有什么 某小组用CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料合成橙黄色晶 体X,第(6)问中确定X中钴、氨、氯的物质的量之比为1∶ 6∶ 3,则X 的化学式为[Co(NH3)6]Cl3;制备X的化学方程式为:2CoCl2+2NH4Cl+ 10NH3+H2O2===2[Co(NH3)6]Cl3+2H2O,制取X的反应物中有H2O2, 而H2O2具有热不稳定性,故制取X的过程中温度不能过高。 第二步:审读图示信息有什么 装置B三颈瓶中加入足量NaOH溶液并加热,产生的NH3用C装置中盐 酸标准溶液吸收,过量的盐酸再用c2 mol·L-1 NaOH溶液滴定,依据装 置C锥形瓶中发生的反应:NH3+HCl===NH4Cl、NaOH+HCl===NaCl +H2O。 第三步:审读设问信息有什么 第(3)问中盐酸的总物质的量为c 1 V 1 ×10 - 3 mol,参与NH 3 + HCl===NH4Cl反应后,剩余的盐酸的物质的量为c2V2×10-3 mol,则样 品X中n(NH3)=(c1V1-c2V2)×10-3 mol。氨的质量分数为 ×100%。第(4)问中若装置漏气,造成 氨的测定实验中氨气外逸损失,消耗的盐酸量减小,结果偏低。 1.氧化还原滴定法是以氧化还原反应为基础的滴 定分析方法。利用氧化还原滴定法可以直接或间接 测定许多具有氧化性或还原性的物质,也可以用氧 化还原滴定法间接测定。因此,它的应用非常广泛。 2.氧化还原反应有的反应速率比较慢,也有的因 不同的反应条件而产生副反应或生成不同的产物。 因此,在氧化还原滴定中,必须创造和控制适当的 反应条件,加快反应速率,防止副反应发生,以利 于分析反应的定量进行。 3.在氧化还原滴定中,要使分析反应定量地进行 完全,常常用强氧化剂和较强的还原剂作为标准溶 液。根据所用标准溶液的不同,氧化还原滴定法可 分为高锰酸钾法、重铬酸钾法等。 3.(2015·课标全国Ⅱ,28)二氧化氯(ClO2,黄绿色易溶于水 的气体)是高效、低毒的消毒剂。回答下列问题: (1)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该 反应氧化剂与还原剂物质的量之比为________。 (2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过 以下过程制备ClO2: ①电解时发生反应的化学方程式为 ____________________________________ ②溶液X中大量存在的阴离子有____________。 ③除去ClO2中的NH3可选用的试剂是________(填标号)。 a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水 2∶1 Cl-、OH- c 得失电子 守恒 瞻前 顾后 (3)用右图装置可以测定混合气中ClO2的含量: Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加 入3 mL稀硫酸 Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口 Ⅲ.将一定量的混合气体通入锥形瓶中吸收 Ⅳ.将玻璃液封装置中的水倒入锥形瓶中 Ⅴ.用0.100 0 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶 液(I2+2S2O32-===2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中: ① 锥 形 瓶 内 C l O 2 与 碘 化 钾 反 应 的 离 子 方 程 式 为 ______________________________________________________ __________________ ②玻璃液封装置的作用是______________________________。 ③Ⅴ中加入的指示剂通常为_____________,滴定至终点的 现象是_________________________________________。 ④测得混合气中ClO2的质量为________g。 2ClO2+10I-+8H+===2Cl-+5I2+4H2O 吸收残余的二氧化氯气体 淀粉溶液 溶液由蓝色变为无色且30 s内不恢复原色 0.027 00 ClO2易溶 于水 2ClO2~5I2~10S2O32- 试 题 备 选 化合价升降守 恒配平 【试题备选】 2.测定步骤: a.安装装置,检验气密性,充N2排尽空气后,停止充N2。 b.向烧瓶中加入200 mL水样。 c.向烧瓶中依次迅速加入1 mL MnSO4无氧溶液(过量)2 mL碱性KI 无氧溶液(过量),开启搅拌器,至反应①完全。 d.搅拌并向烧瓶中加入2 mLH2SO4无氧溶液,至反应②完全,溶 液为中性或弱酸性。 e.从烧瓶中取出40.00 mL溶液,以淀粉作指示剂,用0.010 00 mol·L-1 Na2S2O3溶液进行滴定,记录数据。 f.…… g.处理数据(忽略氧气从水样中的溢出量和加入试剂后水样体积的 变化)。 解题提示 根据氧化还原反应反应物和生成物特点→选 择合适的指示剂 根据得失电子守恒→完成定量计算 为了减少实验误差,需重复e操作2-3次 若PH过低,溶液中I-或S2O32-离子在H+氛围中会 各自发生反应 回答下列问题: (1)配制以上无氧溶液时,除去所用溶剂水中氧的简单操作为 ________________________。 (2)在橡胶塞处加入水样及有关试剂应选择的仪器为________。 ①滴定管 ②注射器 ③量筒 (3)搅拌的作用是________________________________。 ( 4 ) 配 平 反 应 ② 的 方 程 式 , 其 化 学 计 量 数 依 次 为 ________________________ 。 ( 5 ) 步 骤 f 为 ___________________________________________________________________ _____。 ( 6 ) 步 骤 e 中 达 到 滴 定 终 点 的 标 志 为 ____________________________________________。若某次滴定消耗 Na2S2O3溶液4.50 mL,水样的DO=________mg·L-1(保留一位小数)。 作为饮用水源,此次测得DO是否达标:________(填“是”或“否”)。 (7)步骤d中加入H2SO4溶液反应后,若溶液pH过低,滴定时会产 生明显的误差,写出产生此误差的原因(用离子方程式表示,至少写 出2个)_________________________________________ ________________________________________________________________ ________。 将溶剂水煮沸后冷却 ② 使溶液混合均匀,快速完成反应 1,2,4,1,1,3 重复步骤e的操作2~3次 溶液蓝色褪去(半分钟内不恢复原色) 是 9.0 4H++4I-+O2===2I2+2H2O O2~2MnO(OH)2~ 2I2~4S2O32- 解析 (1)气体在水中的溶解度随着温度升高而减小, 将溶剂水煮沸可以除去所用溶剂水中氧气。(2)在橡胶 塞处加入水样及有关试剂,应选择注射器。(3)搅拌可 以使溶液混合均匀,加快反应速率。(4)由Mn元素的化 合价由+4价降低到+2价,碘元素的化合价由-1价升 高到0价,根据化合价升降总数相等,反应②配平后化 学方程式为MnO(OH)2+2I-+4H+===Mn2++I2+3H2O, 故其化学计量数依次为1,2,4,1,1,3。 (5)为了减小实验的误差,滴定操作一般需要重复滴定 操作2~3次,因此步骤f为重复步骤e的操作2~3次。 1.自身指示剂:有些标准溶液或被滴定物质本身有颜 色,而滴定产物为无色,则滴定时就无需另加指示剂, 自身颜色变化可以起指示剂的作用,此类指示剂称为自 身指示剂。如MnO本身在溶液中显紫红色,还原后的产 物Mn2+为无色,所以用高锰酸钾溶液滴定时,不需要另 加指示剂。 2.显色指示剂:有些物质本身并没有颜色,但它能与 滴定剂或被测物质反应产生特殊的颜色,或开始有特殊 颜色,滴定后变为无色,因而可指示滴定终点。如滴定 前溶液中无单质碘,滴定后有单质碘生成等,可用淀粉 等作为指示剂。 氧化还原反应滴定指示剂的选择查看更多