- 2021-05-12 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考历年真题化学大题汇总
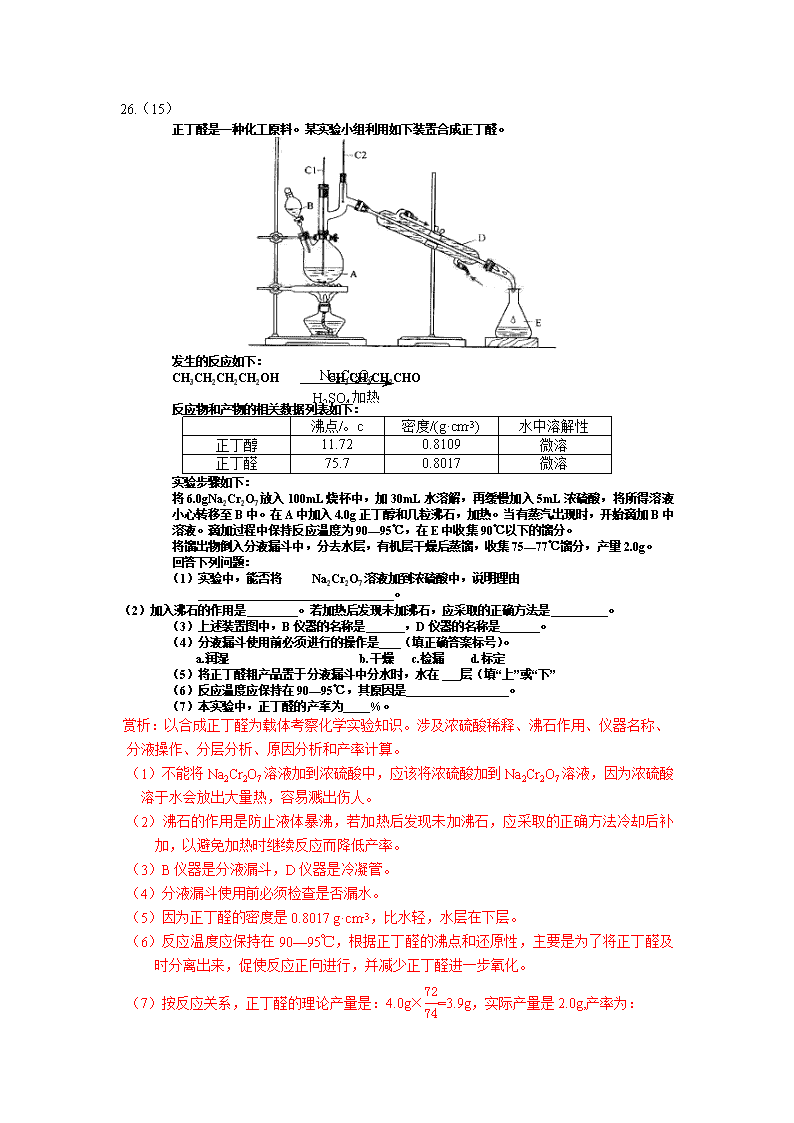
26.(15) 正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。 发生的反应如下: CH3CH2CH2CH2OH CH3CH2CH2CHO 反应物和产物的相关数据列表如下: 沸点/。c 密度/(g·cm-3) 水中溶解性 正丁醇 11.72 0.8109 微溶 正丁醛 75.7 0.8017 微溶 实验步骤如下: 将 6.0gNa2Cr2O7 放入 100mL 烧杯中,加 30mL 水溶解,再缓慢加入 5mL 浓硫酸,将所得溶液 小心转移至 B 中。在 A 中加入 4.0g 正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加 B 中 溶液。滴加过程中保持反应温度为 90—95℃,在 E 中收集 90℃以下的馏分。 将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集 75—77℃馏分,产量 2.0g。 回答下列问题: (1)实验中,能否将 Na2Cr2O7 溶液加到浓硫酸中,说明理由 。 (2)加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法是 。 (3)上述装置图中,B 仪器的名称是 ,D 仪器的名称是 。 (4)分液漏斗使用前必须进行的操作是 (填正确答案标号)。 a.润湿 b.干燥 c.检漏 d.标定 (5)将正丁醛粗产品置于分液漏斗中分水时,水在 层(填“上”或“下” (6)反应温度应保持在 90—95℃,其原因是 。 (7)本实验中,正丁醛的产率为 %。 赏析:以合成正丁醛为载体考察化学实验知识。涉及浓硫酸稀释、沸石作用、仪器名称、 分液操作、分层分析、原因分析和产率计算。 (1)不能将 Na2Cr2O7 溶液加到浓硫酸中,应该将浓硫酸加到 Na2Cr2O7 溶液,因为浓硫酸 溶于水会放出大量热,容易溅出伤人。 (2)沸石的作用是防止液体暴沸,若加热后发现未加沸石,应采取的正确方法冷却后补 加,以避免加热时继续反应而降低产率。 (3)B 仪器是分液漏斗,D 仪器是冷凝管。 (4)分液漏斗使用前必须检查是否漏水。 (5)因为正丁醛的密度是 0.8017 g·cm-3,比水轻,水层在下层。 (6)反应温度应保持在 90—95℃,根据正丁醛的沸点和还原性,主要是为了将正丁醛及 时分离出来,促使反应正向进行,并减少正丁醛进一步氧化。 (7)按反应关系,正丁醛的理论产量是:4.0g× 72 74=3.9g,实际产量是 2.0g,产率为: Na2Cr2O7 H2SO4 加热 2.0 3.9×100%=51.3%。 参考答案: (1)不能,浓硫酸溶于水会放出大量热,容易溅出伤人。 (2)防止液体暴沸;冷却后补加; (3)分液漏斗;冷凝管。 (4)c (5)下 (6)为了将正丁醛及时分离出来,促使反应正向进行,并减少正丁醛进一步氧化。 (7)51% 28.(14 号) 在 1.0 L 密闭容器中放入 0.10molA(g),在一定温度进行如下反应应: A(g) B(g)+C(g) △H=+85.1kJ·mol-1 反应时间(t)与容器内气体总压强(p)的数据见下表: 时间 t/h 0 1 2 4 8 16 20 25 30 总压强 p/100kPa 4.91 5.58 6.32 7.31 8.54 9.50 9.52 9.53 9.53 回答下列问题: (1)欲提高 A 的平衡转化率,应采取的措施为 。 (2)由总压强 P 和起始压强 P0 计算反应物 A 的转化率 α(A)的表达式为 。 平衡时 A 的转化率为_ ,列式并计算反应的平衡常数 K 。 (3)①由总压强 p 和起始压强 p0 表示反应体系的总物质的量 n 总和反应物 A 的物质的量 n (A),n 总= mol,n(A)= mol。 ②下表为反应物 A 浓度与反应时间的数据,计算 a= 反应时间 t/h 0 4 8 16 C(A)/ (mol·L-1) 0.10 a 0.026 0.0065 分析该反应中反应反应物的浓度 c(A)变化与时间间隔(△t)的规律,得出的结论 是 , 由此规律推出反应在 12h 时反应物的浓度 c(A)为 mol·L-1 赏析:考察化学平衡知识,涉及平衡移动,转化率、平衡常数、平衡计算、反应速率、表 格 数据分析。 (1)根据反应是放热反应特征和是气体分子数增大的特征,要使 A 的转化率增大,平衡 要正向移动,可以采用升高温度、降低压强的方法。 (2)反应前气体总物质的量为 0.10mol,令 A 的转化率为 α(A),改变量为 0.10α(A) mol,根 据差量法,气体增加 0.10α(A)mol,由阿伏加德罗定律列出关系: 0.10 0.10 + 0.10α(A)= pO p α(A)=( p po-1)×100%;α(A)=( 9.53 4.91-1)×100%=94.1% 平衡浓度 C(C)=C(B)=0.1×94.1%=0.0941mol/L,C(A)=0.1-0.0941=0.0059mol/L, K= 0.09412 0.0059 =1.5 (3)① 0.10 n = pO p n=0.1× p po ;其中,n(A)=0.1-(0.1× p po-0.1)=0.1×(2- p po) ②n(A)=0.1×(2- 7.31 4.91)=0.051 C(A)=0.051/1=0.051mol/L 每间隔 4 小时,A 的浓度为原来的一半。 当反应 12 小时时,C(A)=0.026/2=0.013mol/L 参考答案: (1)升高温度、降低压强 (2)α(A)=( p po-1)×100%;94.1%;K= 0.09412 0.0059 =1.5; (3)①0.1× p po;0.1×(2- p po); ②0.051;每间隔 4 小时,A 的浓度为原来的一半。0.013 37.[化学——选修 3:物质结构与性质](15 分) 前四周期原子序数依次增大的元素 A,B,C,D 中, A 和 B 的价电子层中未成对电子均只有 1 个,平且 A-和 B+ 的电子相差为 8;与 B 位于同一周期的 C 和 D,它们价 电子层中的未成对电子数分别为 4 和 2,且原子序数 相差为 2。 回答下列问题: (1)D2+的价层电子排布图为_______。 (2)四种元素中第一电离最小的是________, 电负性最大的是________。(填元素符号) (3)A、B 和 D 三种元素组成的一个化合物的晶胞如图所示。 ①该化合物的化学式为_________;D 的配位数为_______; ②列式计算该晶体的密度_______g·cm-3。 (4)A-、B+和 C3+三种离子组成的化合物 B3CA6,其中化学键的类型有_____;该化合物 中存在一个复杂离子,该离子的化学式为_______,配位体是____。 参考答案: (1) (2)K F (3)①K2NiF4; 6 ② 39 × 4 + 59 × 2 + 19 × 8 6.02 × 1023 × 4002 × 1307 × 10—18=3.4 27.(14 分) 某研究小组为了探究一种无机矿物质 X(仅含四种元素)的组成和性质,设计并 完成如下实验: 另取 10.80gX 在惰性气流中加热至完全分解,得到 6.40g 固体 1.请回答如下问题: (1)画出白色沉淀 1 中金属元素的原子结构示意图_______,写出气体甲的电子式_______。 (2)X 的化学式是______,在惰性气流中加热 X 至完全分解的化学反应方程式为_______。 (3)白色沉淀 2 在空气中变成红褐色沉淀的原因是_______(用化学反应方程式表示)。 (4)一定条件下,气体甲与固体 1 中的某种成分可能发生氧化还原反应,写出一个可能的 化学反应方程式_______,并设计实验方案验证该反应的产物_______。 【答案解析】(1) (2)CaFe(CO3)2 CaFe(CO3)2 CaO+FeO+2CO2↑ (3)4Fe(OH)2+O2+2H2O=4Fe(OH)3 (4)2FeO+CO2 Fe2O3+CO 检验方法:将固体用盐酸溶解,加入 KSCN 溶液,若溶液呈 红色,证明有 Fe(III);检测 CO:将气体通入灼烧 CuO,黑色固体变成红色。 28.(14 分)在全球一致倡导低碳经济的大背景下,对碳及其氧化物的化学热力学、动力 学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响. (1)以 CO 和 O2 为电极燃料,以 KOH 溶液为电解质组成燃料电池,请写出该电池的负极 反应式 . (2)25℃时,1mol 石墨和 1mol CO 完全燃烧放出热量分别为 393.5kJ、283.0kJ.请写出石 墨不完全燃烧时的热化学方程式 . (3)25℃时,反应 2CO2(g)⇌2CO(g)+O2(g)的平衡常数 K=1.72×10﹣46.在一个体 积可变的密闭容器中充入一定量 CO2、CO、O2 的混合气体,以下说法正确的是 . A.要使容器中的反应开始时向 CO2 分解的方向进行,起始时三种气体的物质的量浓度应 满足的关系是 <1.72×10﹣46 B.达平衡后,其他条件不变时,升高温度或增加容器的压强,平衡均逆向移动 C.平衡常数 K 随温度的升高而增大 D.平衡常数 K 随压强的增大而减小 (4)25℃时,在一个保持恒温恒容的密闭容器中充入一定量 CO2、CO、O2 的混合气体, 从起始到 t1 时刻达到平衡状态,速率变化如图所示.在 t2 时刻再加入一定量的 CO2 后于 t3 时刻达到新的平衡,请画出 t2~t3 的速率变化图(需标出 v 正,v 逆). 【答案与解析】:(1)碱性条件下,燃料电池的负极上 CO 失电子生成 CO32﹣,负极反应 式为 CO﹣2e﹣+4OH﹣═CO32﹣+2H2O,故答案为:CO﹣2e﹣+4OH﹣═CO32﹣+2H2O; (2)25℃时,1mol 石墨和 1mol CO 完全燃烧放出热量分别为 393.5kJ、283.0kJ, 则①C(石墨,s)+O2(g)=CO2(g)△H=﹣393.5kJ/mol, ②CO(g)+O2(g)=CO2(g)△H=﹣283.0kJ/mol 根据盖斯定律①﹣②得:C(石墨,s)+O2(g)═CO(g)△H=﹣110.5 kJ/mol; 故答案为:C(石墨,s)+O2(g)═CO(g)△H=﹣110.5 kJ/mol; (3)A.当 >1.72×10﹣46,平衡正移,所以要使容器中的反应开始时 向 CO2 分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是 >1.72×10﹣46,故 A 错误; B.该反应为分解反应正方向为吸热反应,所以升高温度平衡正移,该反应正方向为体积 增大的方向,所以增大压强平衡逆移,故 B 错误; C.该反应为分解反应正方向为吸热反应,所以升高温度平衡正移,K 增大,故 C 正确; D.平衡常数 K 只随温度的变化而变化,所以增大压强平衡常数不变,故 D 错误; 故答案为:C; (4)25℃时,在一个保持恒温恒容的密闭容器中充入一定量 CO2、CO、O2 的混合气体, 从起始到 t1 时刻达到平衡状态,速率变化如图所示.在 t2 时刻再加入一定量的 CO2 后正反 应速率瞬间增大,然后逐渐减小,逆反应速率逐渐增大,于 t3 时刻达到新的平衡,依此作 图为 , 故答案为: . 37.【化学——选修三:物质结构与性质】(15 分) 黄血盐(亚铁氰化钾,K4[Fe(CN)6])易溶于水,广泛用做食盐添加剂(抗结剂),食盐中 黄血盐的最大使用量为 10mg•kg﹣1.黄血盐经长时间火炒,超过 400℃时会分解生成剧毒 的氰化钾. 回答下列问题: (1)写出基态 Fe2+的核外电子排布式 .K4[Fe(CN)6]中 Fe2+与 CN﹣之间的 作用力是 . (2)CN﹣中碳原子的杂化方式为 ;1molCN﹣中含有 π 键的数目为 . (3)金属钾、铁的晶体的晶胞结构如图,钾、铁两种晶体晶胞中金属原子的配位数之比为 2:3 . (4)黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与 CN﹣是等电 子体的气态化合物,反应化学方程式为 .查看更多