- 2021-05-11 发布 |
- 37.5 KB |
- 39页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学 元素周期律 (2)
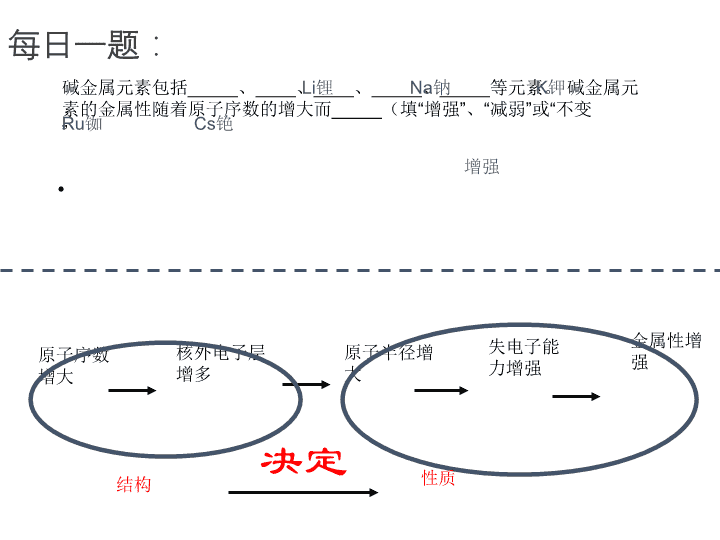
第二节 元素周期律 元素周期律的发现者 ——门捷列夫 每日一题: • 碱金属元素包括_____、____、____、_____、_____等元素。 碱金属元 素的金属性随着原子序数的增大而_____(填“增强”、“减弱”或“不变” 原子序数 增大 核外电子层 增多 原子半径增 大 失电子能 力增强 金属性增 强 结构 性质决定 Li锂 Na钠 K钾 Ru铷 Cs铯 增强 “从积累的事实得出结论就 是理论,而理论使我们能够 预见未知的事实。” ——门捷列夫 韦宜含 最 高 正 价 和 最 低 负 价 许倩 原子半径 周宏健 郝汉 随着原子序数的递增,元素原子 的电子层排布、化合价和原子半径都 呈周期性变化! AlNa Mg Si P S Cl Li K F Br 同周期:序大径小 同主族:层多径大 练习 方法总结: 半径比较 第三周期金属元素原子 失电子能力递变规律的探究 猜想: Na Mg Al Si P S Cl 电子层数相同,核电荷数增大,半径减小 失电子能力减弱、得电子能力增强 金属性减弱、非金属性增强 (2)最高价氧化物水化物的碱性强弱 如何设计实验证明元素的金属性强弱? [现有药品] Mg条、Al条、 蒸馏水、 稀盐酸、酚酞 Na Mg Al Si P S Cl (1)单质与水或酸反应产生 H2 的难易程度 (3)金属单质之间的置换反应。 取一段镁带,用砂 纸磨去表面的氧化 膜,放入一支试管中。 向试管中加入2mL 水,并滴入酚酞溶液。 再加热至水沸腾。 观察现象。 实验一 取铝片和镁带, 用砂纸擦去氧化 膜,分别和2mL 1mol/L盐酸反应。 实 验 二 实验二 Na Mg Al 单质与水 (或酸) 反应 与冷水反 应: 与酸反应: 最高价氧 化物对应 水化物碱 性强弱 NaOH 强碱 Mg(OH)2 中强碱 Al(OH)3 两性 氢氧化物 剧烈 比镁与酸 反应慢 与酸反 应剧烈,放 出氢气。 与冷水反应缓 慢,与沸水反 应迅速 金属性:Na>Mg>Al 小结:金属性强弱判断依据 (1)单质与水或酸反应产生 H2 的难易程度 (2)最高价氧化物水化物的碱性强弱 (3)金属单质之间的置换反应。 非金属性强弱的方法有: (1)单质与氢气化合的难易及氢化物的稳定性.化合 越容易,气态氢化物越稳定,元素的非金属性越强。 (2)非金属单质之间的置换反应。 (3)元素最高价氧化物的水化物——的酸性越强,元 素的非金属性越强。 实验三 向Na2S溶液中 滴加氯水 现象 化学方程式 产生淡黄色混浊 Na2S+ Cl2 == S +2NaCl Na Mg Al Si P S Cl 性质 Si P S Cl 与氢气 反应难 易及稳 定 性 最高价 含氧酸 的酸性 高温 蒸气 加热 点燃爆炸 稳定不很稳定不稳定不稳定 HClO4最强酸H2SO4强酸H3PO4中强 酸 H2SiO3弱酸 第三周期元素金属性的递变规律: Na Mg Al Si P S Cl 金属性逐渐减弱、非金属性 逐渐增强 元素的金属性和非金属性递变小结 H Li Be B C N O F Na Mg Al Si P S Cl K Ca Ga Ge As Se Br Rb Sr In Sn Sb Te I Cs Ba Tl Pb Bi Po At 非金属性逐渐增强 金属性逐渐增强 金 属 性 逐 渐 增 强 非 金 属 性 逐 渐 增 强 对其他周期元素性质进行研究,也可以得到类似的 结论。 元素的性质随着原子序数的递增而呈周期性的变化。 实质:元素性质周期性变化是由于 _______________周期性变化的必然结果。 元素周期律 原子的核外电子排布 Na 11钠 H 1氢 He 2氦 Li 3锂 Be 4铍 B 5硼 C 6碳 N 7氮 O 8氧 F 9氟 Ne 10氖 Mg 12镁 Al 13铝 Si 14硅 P 15磷 S 16硫 Cl 17氯 Ar 18氩 K 19钾 Ca 20钙 IA IIA IIIA IVA VA VIA VIIA 0 1 2 3 4 元素周期表 作业:1、完成堂堂清 2、小论文:通过本节课的学习你对结构和性质、量 变和质变的关系又有了那些新认识,与你的同学交流 【例3】 下列叙述能证明金属A的金属性 比金属B强的是( ) A A原子的最外层电子数比B原子最外层 电子数少 B A原子的电子层数比B原子电子层数多 C 等物质的量A和B与足量稀硫酸反应, 产生氢气的量A比B多 D 常温下,A能从冷水中置换出氢气,而 B不能 【例4】 用“>”、”<”回答下列问题: ⑴酸性:H2CO3 H2SiO3 H2SiO3 H3PO4 ⑵碱性:Ca(OH)2 Mg(OH)2 Mg(OH)2 Al(OH)3 ⑶气态氢化物的稳定性:H2O H2S H2S HCl ⑷酸性:H2SO4 H2SO3 HClO4 HClO 逆向思维 取两段镁带, 用砂纸磨去表 面的氧化膜, 放入两支试管 中。分别向试 管中加入2mL 水,并滴入酚 酞溶液。将其 中一支试管加 热至水沸腾。 对比观察现 象。 实验一 现象 化学方程式 镁与冷水反应缓慢,滴入酚酞试液粉红色。而镁 与沸水反应加快,产生气泡,溶液红色加深。 Mg + 2H2O == Mg(OH)2+H2 △ 与金属钠对比 取铝片和镁 带,用砂纸擦 去氧化膜,分 别和2mL 1mol/L盐酸 反应。 实 验 二 镁与铝均能与盐酸反应产生气泡。但镁反应比铝 剧烈。 Mg + 2HCl = MgCl2 + H2 2Al + 6HCl = 2AlCl3+ 3H2 现象 化学方程式 Ru Li Cs 现象剧烈 (浮熔响游红) 现象比Na剧烈 金 属 性 逐 渐 增 强 失 电 子 能 力 递 增 原 子 半 径 递 增 现 象 越 来 越 剧 烈 1~54号元素的原子半径 1 2 3 4 5 6 7 8 9 101112131415161718 原子的最外层电子数 原子的核外电子排布 半径增大,失电子能力____, 金属性____ 半 径 增 大 , 失 电 子 能 力 _ _ _ _ , 金 属 性 _ _ _ _ 增 强 增 强 增强 增强 实验三:Al(OH)3 的性质 向两支盛有少量AlCl3溶液的试管中,加入氨水至产生大量白色絮状沉淀。向沉淀中分 别加入 2mol/L NaOH 溶液和 2mol/L 盐酸,观察现象。 结论 现象 加入稀盐酸加入NaOH溶液 沉淀溶解 沉淀溶解 既能跟酸反应,又能跟碱反应生成盐和水 Al(OH)3 是两性氢氧化物 现象和结论: 例1:⑴、不同种元素的微粒半径比较: 同周期元素,最外层电子数越多,微粒半径 , r( Na ) r( Mg ) r( Al ) r( F ) r( Cl ) r( Br ) r(I ) 同族元素电子层数越多,微粒半径 , 大 小 序大径小 < < < > > 层多径大 原子半径周期性变化 0.05 0、1 0、15 0、2 0、25 原子序数1 2 3 4 5 6 7 8 9 10111213141516 • 元素的主要化合价呈周期性变化 总结: 随着__________的递增,原子的_______、 _________、_________呈__________变化。 原子序数 原子的核外 电子排布 原子半径 主要化合价 周期性变化 第二节元素周期律 原子半径周期性变化 0.05 0、1 0、15 0、2 0、25 1 2 3 4 5 6 7 8 9 101112131415161718 最外层电子数周期性变化 原子序数 • 元素的主要化合价呈周期性变化 例1 :某元素的气态氢化物化学式为H2R,此元素最高价氧 化物对应水化物的化学式可能为 ( ) A.H2RO3 B.H2RO4 C.HRO3 D.H3RO4 总结: 同种元素的最高正价和最低负价的关系: ________________查看更多