- 2021-05-11 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2009年初中学生化学素质和实验能力竞赛(湖南省)初赛试题
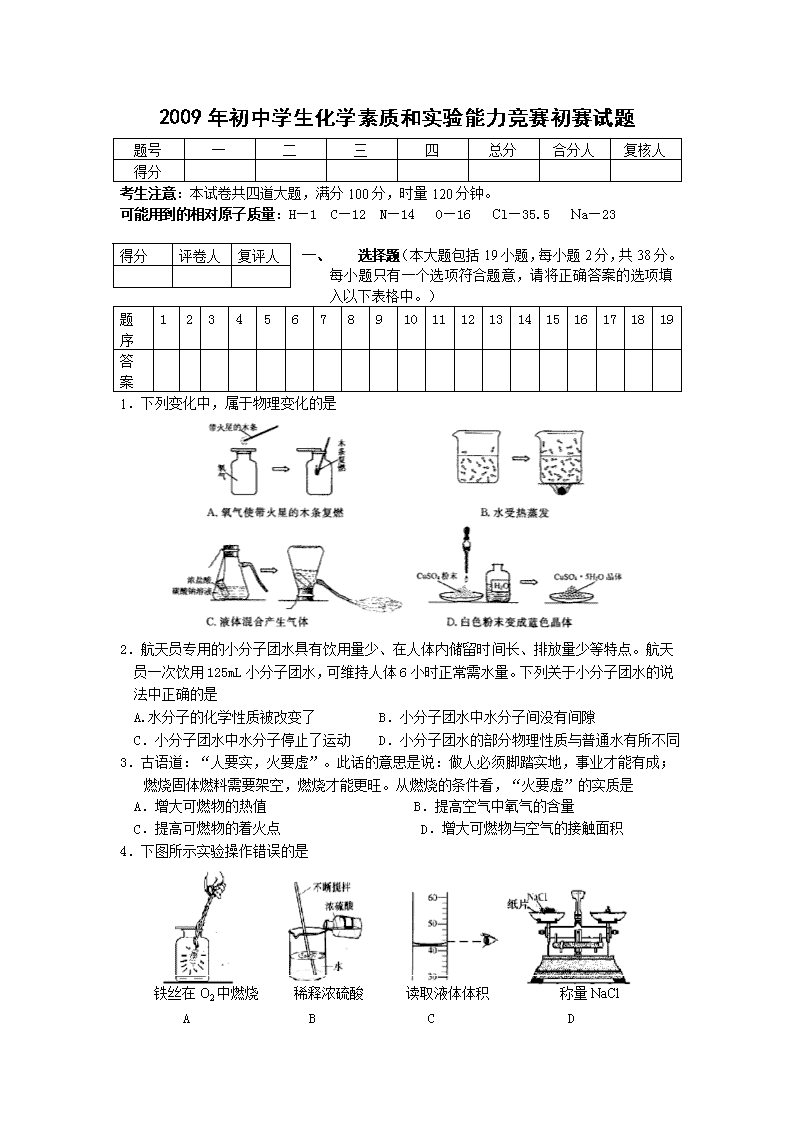
2009年初中学生化学素质和实验能力竞赛初赛试题 题号 一 二 三 四 总分 合分人 复核人 得分 考生注意:本试卷共四道大题,满分100分,时量120分钟。 可能用到的相对原子质量:H—1 C—12 N—14 O—16 Cl—35.5 Na—23 得分 评卷人 复评人 一、 选择题(本大题包括19小题,每小题2分,共38分。每小题只有一个选项符合题意,请将正确答案的选项填入以下表格中。) 题序 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 答案 1.下列变化中,属于物理变化的是 2.航天员专用的小分子团水具有饮用量少、在人体内储留时间长、排放量少等特点。航天员一次饮用125mL小分子团水,可维持人体6小时正常需水量。下列关于小分子团水的说法中正确的是 A.水分子的化学性质被改变了 B.小分子团水中水分子间没有间隙 C.小分子团水中水分子停止了运动 D.小分子团水的部分物理性质与普通水有所不同 3.古语道:“人要实,火要虚”。此话的意思是说:做人必须脚踏实地,事业才能有成;燃烧固体燃料需要架空,燃烧才能更旺。从燃烧的条件看,“火要虚”的实质是 A.增大可燃物的热值 B.提高空气中氧气的含量 C.提高可燃物的着火点 D.增大可燃物与空气的接触面积 4.下图所示实验操作错误的是 铁丝在O2中燃烧 稀释浓硫酸 读取液体体积 称量NaCl A B C D 5.在一只密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表: 物质 X Y Z Q 反应前质量/g 8 2 40 5 反应后质量/g 待测 24 8 23 下列说法正确的是 A.该反应一定是置换反应 B.Y、Q的相对分子质量比一定为11:9 C.参加反应的X、Z的质量比为1:4 D.反应后X的质量为0 6.工业酒精中常含有甲醇,甲醇有剧毒,不能食用,其分子结构可能如图所示的模型表示。下列有关甲醇的叙述中,错误的是 A.甲醇的化学式为CH4O B.甲醇的相对分子质量为32 C.甲醇中C、H、O三种元素的质量比为1:4:1 D.甲醇中氧元素的质量分数为50% 7.向一定量的铁粉中逐滴加入稀硫酸至过量,下图是某反应过程中 某种物质的质量Y随加入稀硫酸的质量变化的关系,则Y不可能表示 A.消耗铁粉的质量 B.生成硫酸亚铁的质量 C.溶液的总质量 D生成氢气的质量 8.右图所示微观变化的化学反应类型,与下列反应的反应类型一致的是 9.为判断某化合物是否含碳、氢、氧三种元素,取一定质量该化合物在氧气中充分燃烧,接下来还需进行的实验有 ①用无水硫酸铜检验是否有水生成; ②用澄清石灰水检验是否有二氧化碳生成; ③用带火星的木条检验氧气; ④测定水和二氧化碳的质量 A.①②③ B.①②④ C.②③④ D.①②③④ 10.物质X可发生下列所示的两个反应,则X是 ①X+酸→盐+水 ②X+水→碱 A.CaO B.Fe2O3 C.CO2 D.NaOH 11.类推是化学学习中常用的思维方法。现有以下类推结果,其中正确的是 A.酸碱中和反应生成盐和水,则生成盐和水的反应一定是中和反应 B.氧化物中都含有氧元素,则含有氧元素的化合物一定是氧化物 C.碱的溶液pH>7,则pH>7的溶液一定是碱的溶液 D.点燃H2和O2的混合气体可能发生爆炸,则点燃CH4与O2的混合气体也可能爆炸 12.下列装置能达到对应实验目的的是 13.下列除去杂质的方法中,正确的是 选项 物质(括号内为杂质) 去除杂质的方法 A NaCl(Na2CO3) 加入适量的Ca(OH)2溶液、过滤 B CaO(CaCO3) 加水、过滤 C Fe(Zn) 加过量FeSO4溶液、过滤 D H2SO4(HNO3) 加Ba(NO3)2溶液、过滤 14.下列各组离子在水溶液中能大量共存的是 A.Fe2+、Ca2+、CO32—、OH- B.Na+、SO42—、Cl—、OH- C.Ba2+、H+、Cl—、OH— D.Ag+、NH4+、NO3-、OH— 15. 20℃时,NaCl溶解于水的实验数据如右表。 则下列叙述正确的是 A.②中所得溶液是饱和溶液 B.20℃时10g水最多能溶解4g NaCl C.③④溶液的溶质质量分数相等 D.① 所得溶液的溶质质量分数为20% 16.右下图中连线两端的物质在通常情况下可以相互反应。下列四组选项中,符合该图要求的是 17.为解决日益加剧的温室效应等问题,科学家正在研究建立如下图所示的二氧化碳新循环体系: 上述关系图能反映的化学观点或化学思想有: ①化学变化中元素种类是守恒的;②燃烧时化学能可以转化为热能和光能;③化学能可以转化为机械能;④光能或电能可以转化为化学能;⑤无机物和有机物可以相互转化;⑥二氧化碳也是一种重要的资源。 A.①②③ B.①②③④⑤ C.①④⑤⑥ D.①②③④⑤⑥ 18.下列关于化学实验的“目的—操作—现象—结论”的描述正确的是 实 验 过 程 组 别 实验目的 所加试剂 (或操作、图示) 实验现象 实验结论 A 检验稀盐酸和氢氧化钠溶液是否恰好完全反应 在反应后的溶液中滴加无色酚酞试液 无明显现象 恰好完全反应 B 判断海水和蒸馏水 蒸发结晶 液体消失,无残留物 该液体为蒸馏水 C 检验溶液中是否含硫酸根离子 加入氯化钡溶液,再加入稀硝酸 有白色沉淀产生 溶液中一定含硫酸根离子 D 测定空气中氧气的体积分数 完全燃烧后,冷却至室温,打开弹簧夹,进入水的体积约为集气瓶总体积的五分之一 氧气约占空气体积的五分之一 19.已知某固体粉末是由NaCl、Ba(NO3)2、CuSO4、Na2SO4、Na2CO3中的一种或几种组成,取这种粉末加足量的水,振荡后呈浑浊,再加稀盐酸,沉淀不溶解,过滤后得无色滤液,取滤液并滴加AgNO3溶液,产生白色沉淀,对原固体粉末的判断正确的是 A.可能含CuSO4和Na2CO3 B.一定含NaCl,可能含Ba(NO3)2、Na2SO4,一定不含Na2CO3、CuSO4 C.一定含NaCl、Ba(NO3)2、Na2SO4,一定不含Na2CO3,可能含CuSO4 D.可能含NaCl,一定含Ba(NO3)2、Na2SO4,一定不含Na2CO3、CuSO4 得分 评卷人 复评人 二、填空题(本大题包括7小题,每空1分,共37分) 20.联合国气候变化框架公约《京都议定书》要求发达国家限制CO2 等温室气体排的放量,以控制日趋严重的温室效应。 (1)绿色植物通过 作用吸收CO2,通过 作用将CO2释放到大气中。 (2)科学家采取“组合转化”技术,将CO2 和H2 以一定比例混合,在一定条件下反应,生成一种重要的化工原料和水。请在括号中填写该化工原料的化学式: 2CO2 +6H2 ==1( )+ 4H2O (3)为了减慢大气中CO2 含量的增加,以下建议可行的是(填序号) 。 ①开发太阳能、水能、风能、地热等新能源; ②禁止使用煤、石油、天然气等矿物燃料;③大量植树造林,禁止乱砍滥伐。 21. M元素的单质可用于原子反应堆的导热剂,其原子结构示意图如右: (1) 该原子有 个电子层,X的值是 , .M元素属于 (填“金属”或“非金属”)元素; (2) M元素的化学性质与下列 (填序号)元素的化学性质相似。 (3) M元素的离子符号是 ;(用元素符号填空,下同) (4) M元素和第(2)小题的D元素形成化合物的化学式是 。 22.某镇硫酸厂排出的尾气中含有SO2,废水中含有H2SO4 。请回答: (1)该镇经常下酸雨,酸雨的pH 5.6(填:>、<、=)。 (2)请举一例酸雨的危害: 。 (3)用熟石灰处理该厂废水的化学方程式为: 。 (4)该厂的下列整治措施不妥的是 (填序号): A.废气循环利用 B.将废气点燃后排放 C.废水用碱中和后排放 D.改进工艺,减少废气废水的产生 HCl Zn B A C 23.构建知识网络是一种重要的学习方法。下图是关于盐酸化学性质的知识网络,“——”表示相连的两种物质能发生反应,“ ”表示一种物质转化成另一种物质,A、C属于不同类别的化合物。完善这个知识网络: (1) 写出A、B、C的化学式: A ;B ;C 。 (2) 根据自己得出的知识网络写出一个复分解反应化学方程式: 24.2008年全球出现“无声海啸”——粮食危机,而我国粮食储备充足,市场价格稳定。化肥为保持粮食丰产起到了重要作用。常用化肥有:①尿素[CO(NH2)2]、②氯化钾KCl、③硝酸铵NH4NO3、④磷矿粉 [Ca3(PO4)2] ⑴以上化肥中属于钾肥的是 (填序号) ⑵硝酸铵是一种含氮量较高的化肥。硝酸铵中含氮的质量分数为 。硝酸铵溶于水可以解离出NH4+和 (写离子符号),供植物吸收。 ⑶尿素因含有 元素,所以是一种有机物。尿素分子中所含C、O、N、H的原子个数比为 。 25.如图:“奥运在我心中” 。A、B、C、D、E各代表铁、水、二氧化碳、硫酸铜溶液、氢氧化钡溶液中的一种物质。常温下,相连环物质间能发生反应,不相连环物质间不能发生反应,且B的相对分子质量大于D。请填空: (1)写出下列物质的化学式:A ,B ,D 。 (2)相连环物质间发生的反应,没有涉及的基本反应类型是____________。 26.颗粒达到纳米级的单质铁具有很强的反应活性,俗称“纳米铁”。实验室制备的方法是:以高纯氮气作保护气,在高温条件下用H2和FeCl2发生置换反应,生成“纳米铁”。请回答以下问题: (1)写出生成“纳米铁”的化学方程式 。 (2)反应中需要保护气的原因是 。 (3)某化学探究小组为了验证铁、铜、镁、汞的金属活动性顺序,设计了如下实验方案:①将大小一样的铁片和镁片分别加入到溶质质量分数相同的稀盐酸中;②将铜片加入到硝酸汞溶液中,铜片上出现银白色物质;③将金属片A加入到溶液B中。根据实验①判断出镁的金属活动性比铁强,依据的现象是 ;根据实验②的现象得出的结论是 ;要通过实验③得出铁和铜的金属活动性顺序,那么,如果B是硫酸铜溶液,则金属A是 ,如果A是铜,则溶液B是 。 得分 评卷人 复评人 三、实验探究题(本大题包括3小题,每空1分,共21分) 27.下图是小梅配制100g溶质质量分数为12%的NaCl溶液的实验操作示意图: (1)上图中的玻璃仪器分别是广口瓶、量筒、烧杯和_______________。 (2)指出图中的一处错误操作______________________________________________。 (3)配制时应选择________mL(10mL或50mL或100mL)的量筒量取所需要的水。 (4)用上述图示的序号表示配制溶液的操作顺序___________________。 28. 化学兴趣小组为了探究化学实验室的一种黑色粉末和一瓶标签破损的无色溶液(如右图所示)可能是什么物质,大胆猜想并设计实验进行验证。 [发现问题]当把黑色粉末与无色溶液混合时即产生气泡。 [查阅资料]初中化学实验室常见的黑色粉末有CuO、MnO:、Fe304、铁粉、炭粉等。 [提出假设]黑色粉末是 ,无色溶液是 。(只写一种假设) [设计实验]①向盛有少许黑色粉末的试管中加入适量的无色溶液;②检验试管中产生的气体(写出操作方法) 。 [实验现象] 。 [实验结论]①该反应的化学方程式是 。 ②此气体是 ,原假设成立。 29.复习时,常用专题探究的方法学习常见物质的组成、性质与制取,课堂上老师引导我们回顾了几个探究实验。 探究1:研究常见物质组成 A.测定空气里氧气含量 B.水电解实验 C.检验甲烷成分 A、B、C都是研究物质组成的实验。从研究方法得知,A实验是利用可燃物消耗瓶内的 ,使瓶内压强减小来推测空气里氧气含量的。B实验是通过证明生成物的 来推断水的组成的。而C实验与 (填实验代号)实验的方法相同。 探究2:研究常见物质性质——氢氧化钠与硫酸是否刚好完全中和 (1) 探索:用玻璃棒蘸取反应后的溶液滴在pH试纸上,发现该溶液的pH<7,说明硫酸过量。 (2) 验证: 实验内容 实验现象 解释与结论 取反应后少量溶液于试管中, 证明研究结论正确 写出(2)出中涉及的化学方程式 。 探究3:研究常见物质制取——制取氢氧化钠溶液 小京同学向盛有澄清石灰水的烧杯中加入过量的碳酸钠溶液,生成白色沉淀,过滤后得到无色溶液,他说:“我制得了氢氧化钠溶液!” 小欢同学却说:“这种无色溶液中不一定含有氢氧化钠。”他提出了如下实验: 实验步骤 实验现象 实验结论 用试管取无色溶液少许,滴入2滴无色酚酞试液 无色酚酞试液变红 无色溶液中有 氢氧化钠 小妮认为小欢的实验方案也不严密,不能证实无色溶液中一定含有氢氧化钠,理由是 。 小妮设计了另一个实验: 实验步骤 实验现象 实验结论 无色溶液中确实含有氢氧化钠 我认为:小欢和小妮的实验是为了证实小京结论的可靠性,小京的结论不可靠,原因是 。显然小妮的实验可靠性比小欢的实验好,原因是 。 得分 评卷人 复评人 四、计算题(本大题包括1小题,共8分) 30.某化工厂生产的纯碱产品中常含有少量氯化钠,工厂的化验员对每批产品进行检测,标出各种成份后才能投放市场。某厂化验员取取样品44g于烧杯中加水将其溶解,然后分几次逐滴加入溶质质量分数为20%的稀盐酸,并不断搅拌,称量,将得到的有关数据记录如下(注:加盐酸时首先发生反应是:Na2CO3 + HCl = NaHCO3 + NaCl ,然后是NaHCO3 + HCl = NaCl + CO2↑+ H2O) 加入稀盐酸质量/g 0 73 74 146 147 烧杯中溶液质量/g 200 273 273.76 328.4 329.4 请你根据题给信息和表中数据,回答下列问题: (1)加入 g稀盐酸开始产生二氧化碳,最多产生二氧化碳 g。 (2)在下列图中标出产生二氧化碳质量随滴加盐酸质量的变化曲线。(要在图上注明二氧化碳、盐酸的相关质量) (3)计算出44g样品中各成份的质量。查看更多