- 2021-05-11 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
选修4第一章 第一节 化学反应与能量变化
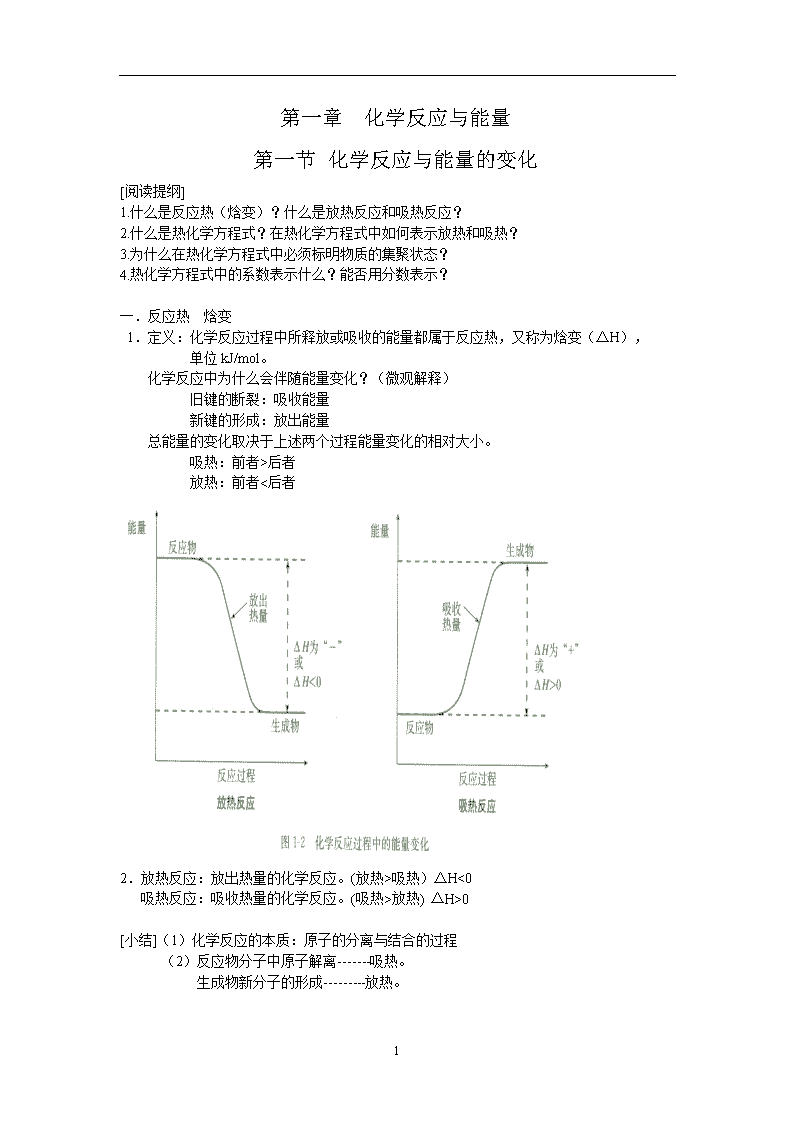
第一章 化学反应与能量 第一节 化学反应与能量的变化 [阅读提纲] 1.什么是反应热(焓变)?什么是放热反应和吸热反应? 2.什么是热化学方程式?在热化学方程式中如何表示放热和吸热? 3.为什么在热化学方程式中必须标明物质的集聚状态? 4.热化学方程式中的系数表示什么?能否用分数表示? 一.反应热 焓变 1.定义:化学反应过程中所释放或吸收的能量都属于反应热,又称为焓变(ΔH), 单位kJ/mol。 化学反应中为什么会伴随能量变化?(微观解释) 旧键的断裂:吸收能量 新键的形成:放出能量 总能量的变化取决于上述两个过程能量变化的相对大小。 吸热:前者>后者 放热:前者<后者 2.放热反应:放出热量的化学反应。(放热>吸热)ΔH<0 吸热反应:吸收热量的化学反应。(吸热>放热) ΔH>0 [小结](1)化学反应的本质:原子的分离与结合的过程 (2)反应物分子中原子解离-------吸热。 生成物新分子的形成---------放热。 3 二.热化学方程式 1. 定义:能表示参加反应物质的量和反应热的关系的化学方程式 例如:H2 (气) + 1/2 O2 (气) = H2O (气) ΔH= -241.8kJ/mol H2(气) + 1/2 O2(气) = H2O (液) ΔH= -285.8 kJ/mol [讨论] 1.为什么集聚状态不同,热量值不同? 答:液态水变成水蒸气要吸收热量 2.若反应物状态不同,而生成物状态相同,那么热量值相同吗? 答:不同 [思考与交流] 2.书写要点: C(固) + H2O(气) = CO(气) + H2(气) ΔH= +131.3 kJ/mol ①标集聚状态(固、液、气) ②右端标热量数值和符号: 吸热用“+”,放热用:“-”。 ③系数单位是“摩”,而不是“个”;也不能表示物质的量之比。 ④系数可用分数,但热量值要相应变化。 如:2H2(气) + O2(气) = 2H2O(液) ΔH= -571.6 kJ/mol H2(气) + 1/2 O2(气) = H2O(液) ΔH= -285.8 kJ/mol ⑤不注明条件,即指250C 、1.01×105Pa 例: 1克甲烷在空气中燃烧,恢复常温下测得放出热量55.625KJ,试写出热化学方程式。 CH4(气) + 2O2(气) = CO2(气) + 2H2O(液) ΔH= -890 kJ/mol [练习1]同温、同压下,比较Q1与Q2的大小: S(气) + O2(气) == SO2(气) + Q1 S(固) + O2(气) == SO2(气) + Q2 Q1 < Q2 , |Q1 | > |Q2| [练习2] 已知:C(固) + O2(气) == CO2(气) ΔH= -393.5 kJ/mol,要获得1000千焦热量,需燃烧多少克碳? 30.5克 [练习3] 已知:S(固) + O2(气) = SO2(气) ΔH= -290.6 kJ/mol,求1.6克硫燃烧成为SO2气体放出多少热量? 14.53kJ 3 [自我检测] 1. 3mol CH4燃烧时,生成液态水和CO2 同时放出2670.9KJ的热。请写出热化学方程式。 2. 常温下14克CO在足量氧气中充分燃烧,放出141.3KJ热量,写出该热化学方程式。 3. 1836年,俄国化学家盖斯指出:化学反应的热效应仅与反应物的最初状态和生成物的最终状态有关,而与中间步骤无关。按此规律,结合下列热化学方程式: C(固、金刚石) + O2(气) == CO2(气) ΔH= -395.41 kJ/mol C(固、石墨) + O2(气) == CO2(气) ΔH= -393.51 kJ/mol 回答有关问题: (1)石墨转化为金刚石的热化学方程式是: (2)石墨和金刚石相比较,__________的稳定性更大。 自我检测题答案: 1. CH4(气) + 2O2(气) = CO2(气) + 2H2O(液) ΔH= -890.3 kJ/mol 2. 2CO(气) + O2(气) = 2CO2(气) ΔH= -565.2 kJ/mol 3.(1) C(固、石墨) == C(固、金刚石) ΔH= +1.90 kJ/mol (2)石墨 3查看更多