- 2021-05-11 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020_2021学年新教材高中化学第二章海水中的中盐元素__钠和氯2_1氯气的性质课时作业含解析新人教版必修第一册
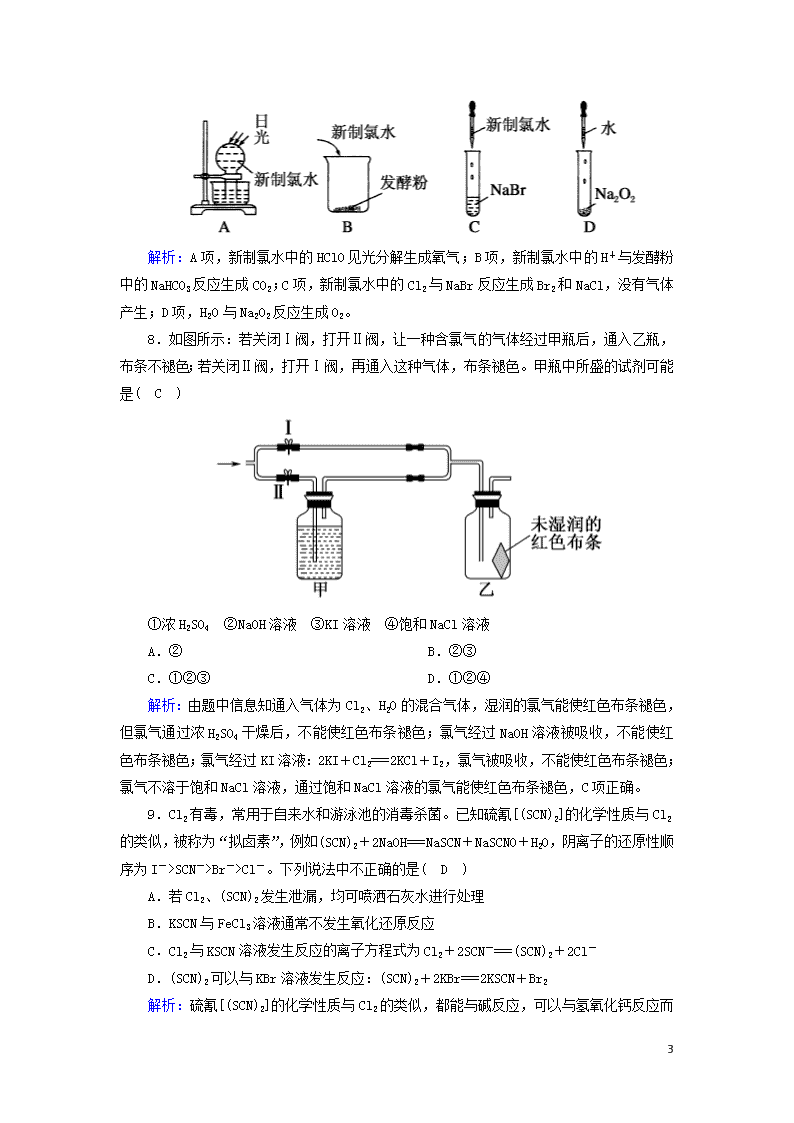
氯气的性质 时间:45分钟 1.下列有关Cl2的叙述中不正确的是( C ) A.氯水能够使石蕊溶液先变红后褪色,说明氯水中存在H+和漂白性物质 B.在加压条件下,氯气转化为液氯,可贮存于钢瓶中,便于运输和使用 C.舍勒在实验中意外地发现了一种黄绿色气体,并将该气体的组成元素命名为氯 D.氯气常用于自来水的消毒、农药的生产、药物的合成等领域 解析:Cl2与H2O反应生成HCl和HClO,前者电离出H+,使石蕊溶液先变红,后者具有强氧化性和漂白性,所以石蕊溶液先变红后褪色,A正确;氯气易液化,在加压条件下可以转化为液氯,液氯在常温下不与铁反应,故可贮存于钢瓶中,便于运输和使用,B正确;舍勒在实验中意外地发现了一种黄绿色气体,当时他并未确认该气体的组成成分,后经化学家戴维确认该气体只含有一种元素并将该元素命名为氯,C错误;Cl2的用途广泛,可用于自来水的消毒、农药的生产、药物的合成等领域,D正确。 2.下列叙述中能证明次氯酸是一种弱酸的是( A ) A.次氯酸钙能与碳酸作用生成碳酸钙和次氯酸 B.次氯酸是一种强氧化剂 C.次氯酸能使染料和有机色质褪色 D.次氯酸不稳定,易分解 解析:根据强酸制弱酸原理可知,碳酸能制取次氯酸,说明碳酸的酸性强于次氯酸,而碳酸是弱酸,所以次氯酸也是弱酸,A符合题意。B、C中说明的是次氯酸的氧化性,D中说明的是次氯酸的不稳定性,B、C、D不符合题意。 3.下列关于消毒剂(主要成分是NaClO)的使用和保存不正确的是( D ) A.将消毒液放在阴凉、避光的地方 B.盛混合液的容器盖上可留一个透气小孔 C.在使用时,要适当稀释,消毒液不是越浓越好 D.可与洁厕剂(含有浓盐酸)混合使用 解析:NaClO水解产生HClO,受光照会分解出O2,故应放在阴凉避光的地方,容器盖上可留一个透气小孔,使用时适当稀释消毒效果好且对环境无污染。 4.下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( C ) ①氯气 ②液氯 ③新制的氯水 ④氯气的酒精溶液 ⑤盐酸 ⑥盐酸酸化的漂白粉溶液 A.①②③ B.①②③⑥ C.③⑥ D.②③⑥ 8 解析:能使干燥的蓝色石蕊试纸变红说明溶液显酸性,而后褪色,说明溶液中有表现漂白性的物质。Cl2溶于水后得到氯水,既表现酸性又表现漂白性。盐酸酸化的漂白粉溶液既表现酸性又表现漂白性。 5.在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是( B ) A.向氯水中加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在 B.溶液呈浅黄绿色,且有强烈刺激性气味,说明有Cl2分子存在 C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明溶液中有Cl-存在 D.加入NaOH溶液,氯水浅黄绿色消失,说明有HClO分子存在 解析:氯水中使有色布条褪色的是HClO分子;呈浅黄绿色的是Cl2分子;能与AgNO3反应生成白色沉淀的是Cl-,但前提是不能加入盐酸酸化(引入了Cl-);加入NaOH溶液,NaOH与Cl2、HCl、HClO都发生反应,最终使Cl2消耗完而失去浅黄绿色。 6.实验表明:将氯水滴加到一张蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是( D ) A.此实验表明氯水具有酸性、漂白性 B.内环呈白色外环呈红色或浅红色 C.内外环上颜色的差异表明此变化过程中,中和反应比氧化还原反应快 D.氯水中形成次氯酸的反应中还原产物是HClO 解析:内外两环颜色不同,说明两种物质起作用,氯水表现出酸性和漂白性,A正确;内环HClO表现强氧化性,起漂白作用,外环H+表现酸性而呈红色或浅红色,B正确;由现象可知外环呈红色或浅红色是H+表现酸性的结果,说明中和反应快些,内环呈白色体现了HClO的强氧化性,氧化还原反应慢些,C正确;Cl2+H2O===HCl+HClO,HClO是Cl元素化合价升高的产物,为氧化产物,D错误。 7.下列实验过程中,不会产生气体的是( C ) 8 解析:A项,新制氯水中的HClO见光分解生成氧气;B项,新制氯水中的H+与发酵粉中的NaHCO3反应生成CO2;C项,新制氯水中的Cl2与NaBr反应生成Br2和NaCl,没有气体产生;D项,H2O与Na2O2反应生成O2。 8.如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂可能是( C ) ①浓H2SO4 ②NaOH溶液 ③KI溶液 ④饱和NaCl溶液 A.② B.②③ C.①②③ D.①②④ 解析:由题中信息知通入气体为Cl2、H2O的混合气体,湿润的氯气能使红色布条褪色,但氯气通过浓H2SO4干燥后,不能使红色布条褪色;氯气经过NaOH溶液被吸收,不能使红色布条褪色;氯气经过KI溶液:2KI+Cl2===2KCl+I2,氯气被吸收,不能使红色布条褪色;氯气不溶于饱和NaCl溶液,通过饱和NaCl溶液的氯气能使红色布条褪色,C项正确。 9.Cl2有毒,常用于自来水和游泳池的消毒杀菌。已知硫氰[(SCN)2]的化学性质与Cl2的类似,被称为“拟卤素”,例如(SCN)2+2NaOH===NaSCN+NaSCNO+H2O,阴离子的还原性顺序为I->SCN->Br->Cl-。下列说法中不正确的是( D ) A.若Cl2、(SCN)2发生泄漏,均可喷洒石灰水进行处理 B.KSCN与FeCl3溶液通常不发生氧化还原反应 C.Cl2与KSCN溶液发生反应的离子方程式为Cl2+2SCN-===(SCN)2+2Cl- D.(SCN)2可以与KBr溶液发生反应:(SCN)2+2KBr===2KSCN+Br2 解析:硫氰[(SCN)2]的化学性质与Cl2 8 的类似,都能与碱反应,可以与氢氧化钙反应而被吸收,故A正确;氯化铁和硫氰化钾溶液发生络合反应生成络合物,而使溶液呈血红色,故B正确;因为还原性:SCN->Cl-,所以氯气能将SCN-氧化为(SCN)2,反应的离子方程式为Cl2+2SCN-===(SCN)2+2Cl-,故C正确;因为还原性:SCN->Br-,所以(SCN)2不能将Br-氧化为Br2,即硫氰和溴化钾不能发生反应,故D错误。 10.用氯气消毒的自来水配制下列溶液时,会使配得的溶液变质的是( D ) ①NaOH ②AgNO3 ③Na2CO3 ④NaBr ⑤FeCl2 A.只有②④ B.只有④⑤ C.只有②④⑤ D.全部 解析:氯气消毒的自来水相当于新制氯水,因此配制溶液时,可能会使配得的溶液变质。 ①Cl2+2NaOH===NaCl+NaClO+H2O ②Cl-+Ag+===AgCl↓ ③Na2CO3+2HCl===2NaCl+H2O+CO2↑ ④2NaBr+Cl2===2NaCl+Br2 ⑤2FeCl2+Cl2===2FeCl3 11.已知氧化性顺序:Cl2>Br2>Fe3+>I2,在FeI2和FeBr2混合溶液中,通入一定量氯气,溶液中存在的离子组不合理的是( D ) A.Fe3+、Br-、Cl- B.Fe2+、Br-、Cl- C.Fe2+、Br-、Cl-、I- D.Fe2+、Cl-、I- 解析:氧化性顺序:Cl2>Br2>Fe3+>I2,故还原性顺序:I->Fe2+>Br->Cl-,氧化剂先与还原性强的物质反应,发生反应的先后顺序为Cl2+2I-===I2+2Cl-、2Fe2++Cl2===2Fe3++2Cl-、Cl2+2Br-===Br2+2Cl-,即被氧化的顺序为I-、Fe2+、Br-。I-最先被氧化,在I-还存在的时候,一定同时存在Fe2+、Br-,D不合理。 12.根据氯水分别与如图四种物质发生的反应选择正确的表述( A ) A.a反应的离子方程式可能是2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl- B.b反应中产生无色无味气体,说明HClO的酸性强于H2CO3 8 C.由c反应的现象知可以直接利用硝酸银溶液检验Cl- D.d反应的最终现象是紫色石蕊溶液褪色,因为Cl2具有漂白性 解析:亚铁离子、溴离子均可以被氯气氧化,则a反应的离子方程式可能是2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-,A正确;氯水中的盐酸与碳酸钠反应产生二氧化碳气体,HClO的酸性弱于H2CO3,B错误;与硝酸银溶液反应产生白色沉淀的不一定为氯离子,不能直接用硝酸银溶液检验Cl-,C错误;d反应的最终现象是紫色石蕊溶液褪色,是因为次氯酸具有漂白性,氯气没有漂白性,D错误。 13.工业上用Cl2和碱制漂白粉、漂粉精及漂白液。请回答下面的问题: (1)工业上将氯气制成漂粉精的主要目的是漂粉精比HClO(或Cl2)稳定,且便于贮存和运输,制漂粉精的主要反应的化学方程式是2Ca(OH)2+2Cl2===Ca(ClO)2+CaCl2+2H2O。 (2)下列物质露置在空气中会变质,在变化过程中既有非氧化还原反应发生,又有氧化还原反应发生的是B。 A.生石灰 B.漂白粉 C.NaOH D.Na2SO3 (3)写出下列两个化学方程式,并注明反应类型。 漂白粉+稀盐酸:Ca(ClO)2+2HCl===CaCl2+2HClO,属复分解反应。 漂白粉+浓盐酸:Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O,属氧化还原反应。 (4)用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是①③④(填序号)。 ①HCl ②O2 ③CO2 ④H2O(g) 解析:(1)工业上常利用Cl2和消石灰反应,将氯气制成漂粉精,其主要是因为漂粉精比HClO(或Cl2)稳定,且便于贮存和运输。(2)生石灰Ca(OH)2CaCO3;NaOHNa2CO3,上述过程中只发生了非氧化还原反应;Na2SO3Na2SO4,只发生了氧化还原反应;Ca(ClO)2HClOHCl+O2↑,既有非氧化还原反应,也有氧化还原反应。(4)贮存很久的漂白粉会变质生成CaCO3,与浓盐酸反应会生成CO2,同时含有挥发出来的HCl和H2O。 14.Cl2是一种重要的化工原料,如图是一些含氯产品: 8 (1)①中钢瓶上应贴的标签为C。 A.腐蚀品 B.爆炸品 C.有毒品 D.易燃品 (2)84消毒液是一种无色、有漂白作用的液体,它的有效成分是B。 A.NaOH B.NaClO C.KMnO4 D.Na2O2 (3)Cl2可用于制盐酸,其化学方程式为H2+Cl22HCl。 (4)工业上制漂白粉的化学方程式为2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。 解析:(1)氯气是一种有毒的气体,不易燃、易爆,本身不具有腐蚀性,则①中钢瓶上应贴的标签为有毒品,故选C。(2)84消毒液是由氯气和NaOH反应后得到的消毒剂,主要成分为NaCl和NaClO,其中有效成分为NaClO,故选B。(3)氢气与氯气反应生成HCl,溶于水得到盐酸,发生的反应为H2+Cl22HCl。(4)工业上利用氯气与消石灰反应制备漂白粉,反应生成氯化钙、次氯酸钙与水,化学方程式为2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。 15.已知钠、氯及其化合物间有如下转化关系,请按要求填空: (1)实验室中金属钠通常保存在煤油中,一小块金属钠投入水中反应的化学方程式是2Na+2H2O===2NaOH+H2↑。 (2)Na2O2常用于呼吸面具中,有关反应的化学方程式为2Na2O2+2CO2===2Na2CO3+O2,2Na2O2+2H2O===4NaOH+O2↑。 (3)新制的氯水滴入紫色石蕊溶液中,观察到的现象是先变红后褪色 8 ,请写出氯气与水反应的化学方程式:Cl2+H2O===HCl+HClO。 (4)工业上用氯气和石灰乳反应制漂白粉,其化学方程式为2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。 解析:(1)钠在空气中易被氧气氧化,钠易与水反应,金属钠的密度大于煤油,所以通常保存在煤油中。钠和水反应生成氢氧化钠和氢气,化学方程式是2Na+2H2O===2NaOH+H2↑。(2)人呼出的气体中含有CO2和水蒸气,过氧化钠与二氧化碳、水反应放出氧气,反应的化学方程式是2Na2O2+2CO2===2Na2CO3+O2、2Na2O2+2H2O===4NaOH+O2↑。(3)氯气与水反应生成氯化氢和次氯酸,化学方程式为Cl2+H2O===HCl+HClO;新制的氯水中含有H+、HClO,H+能使紫色石蕊溶液变红,HClO具有漂白性,能使石蕊溶液褪色,则新制的氯水滴入紫色石蕊溶液中的现象是先变红后褪色。(4)工业上用氯气和石灰乳反应制取漂白粉,化学方程式为2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。 16.从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。以下是氯元素形成物质的二维图的部分信息。 (1)根据图中信息,写出任意两种氯的氧化物的化学式:Cl2O、Cl2O3、ClO2、Cl2O5、Cl2O7等中任意两种。 (2)写出高氯酸(HClO4)与NaOH反应的化学方程式: HClO4+NaOH===NaClO4+H2O。 (3)HCl既具有氧化性,又具有还原性。 ①请任意写出一个体现HCl氧化性的离子方程式:Zn+2H+===Zn2++H2↑(或Fe+2H+===Fe2++H2↑)。 ②浓HCl可作为还原剂在加热条件下与MnO2发生反应制备Cl2,写出该反应的化学方程式:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O。 (4)Cl2既具有氧化性,又具有还原性,请结合二维图说明原因:Cl2 8 中Cl元素化合价为0价,氯元素还有-1价以及+1价等价态,因此氯元素化合价可以升高,氯气体现还原性;氯元素化合价可以降低,氯气体现氧化性。潮湿的Cl2与Na2CO3混合制取少量Cl2O的反应中,Cl2既体现了氧化性,又体现了还原性。写出反应的化学方程式:2Cl2+2Na2CO3+H2O===2NaHCO3+2NaCl+Cl2O。 解析:(1)根据图中信息可知氯元素的常见正化合价有+1、+3、+4、+5、+7价等,因此氯的氧化物的化学式有Cl2O、Cl2O3、ClO2、Cl2O5、Cl2O7等。(2)高氯酸(HClO4)是一元强酸,与NaOH反应的化学方程式为HClO4+NaOH===NaClO4+H2O。(3)①金属与盐酸反应生成氢气体现氯化氢的氧化性,例如Zn+2H+===Zn2++H2↑、Fe+2H+===Fe2++H2↑等。②浓HCl可作为还原剂在加热条件下与MnO2发生反应制备Cl2,该反应的化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O。(4)Cl2中Cl元素化合价为0价,氯元素还有-1价以及+1价等价态,因此氯元素化合价可以升高,氯气体现还原性;氯元素化合价可以降低,氯气体现氧化性,即Cl2既具有氧化性,又具有还原性。潮湿的Cl2与Na2CO3混合制取少量Cl2O的反应中,Cl2既体现了氧化性(还原产物是氯化钠),又体现了还原性(氧化产物是Cl2O),因此根据原子守恒以及电子得失守恒可知反应的化学方程式为2Cl2+2Na2CO3+H2O===2NaHCO3+2NaCl+Cl2O。 8查看更多