- 2021-05-10 发布 |
- 37.5 KB |
- 48页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
河北专版2020中考化学复习方案主题一身边的化学物质第05课时金属和金属材料课件
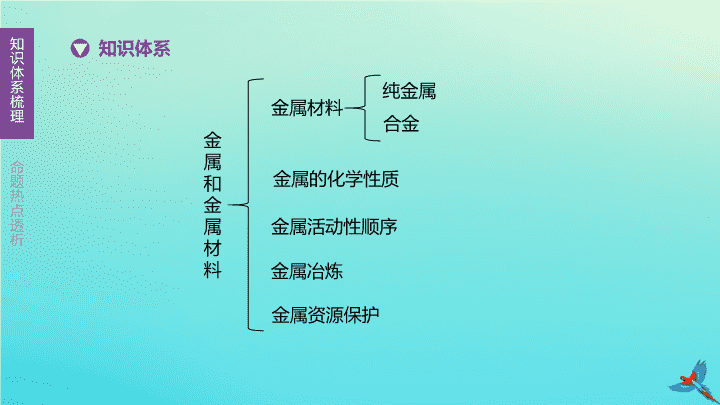
第 5 课时 金属和金属材料 主题一 身边的化学物质 【 考试要求 】 1. 了解金属的物理特征。 (B) 2. 认识金属材料在生产、生活和社会发展中的重要作用。 (B) 3. 知道在金属中加入其他元素可以改变金属材料的性能。 (A) 4. 知道生铁和钢等重要的合金。 (A) 5. 认识常见金属的主要化学性质。 (B) 6. 认识金属生锈的条件 , 了解防止金属锈蚀的简单方法。 (B) 7. 知道一些常见金属 ( 铁、铝等 ) 矿物。 (A) 8. 知道可用铁矿石炼铁。 (A) 9. 认识废弃金属对环境的影响和回收金属的重要性。 (B) 金属和金属材料 知识体系 金属的化学性质 金属活动性顺序 金属冶炼 纯金属 合金 金属材料 金属资源保护 导电 导热 延展 银白色 铜 固态 汞 Cu Fe Al Ca 混合物 大 低 好 Mg Cu 强 Fe 2 O 3 提供热量 , 制取还原剂 CO 3CO+Fe 2 O 3 2Fe+3CO 2 O 2 H 2 O Fe 2 O 3 · x H 2 O 疏松 稀盐酸 清洁和干燥 刷漆 不锈钢 防止金属锈蚀 寻找金属的替代品 重点梳理 1. 水的电解实验 化学性质 条件及通式 化学方程式 现象及解释 注意 金属与氧 气反应 条件 : 多数金属能与氧气反应 , 但反应的难易和剧烈程度不同 通式 : 金属 + 氧气→金属氧化物 ( 属于 ① 反应 ) Al: ② ________________ ___________ 铝在常温下与氧气反应 , 银白色表面逐渐变暗 铝的抗腐蚀性能好不是因为其化学性质稳定 , 而是因为铝在常温下与氧气反应生成了致密的 ⑤ Cu:③ _______________ _________ 铜在空气中不能燃烧 , 加热时 , 生成 ④ 色固体 化合 4Al+3O 2 2Cu+O 2 黑 氧化铝薄膜 2Al 2 O 3 2CuO (续表) 化学性质 条件及通式 化学方程式 现象及解释 注意 活泼金属与稀 酸反应 条件 : 氢前金属 (K 、 Ca 、 Na 除外 ) 通式 : 金属 + 酸→盐 + 氢气 ( 属于 ⑥ 反应 ) 镁与稀盐酸、稀硫酸 : ⑦ _______________________________ ⑧ _______________________________ 剧烈 反应 , 产生大量 ⑨ , 放出大量热 铁与酸反应生成的盐为亚铁盐 ( 即铁的化合价为 +2) 金属与酸反应后 , 溶液的质量均增加 铁与稀盐酸、稀硫酸 : ⑩ _______________________________ ⑪______________________________ 反应 缓慢 , 产生气泡 , 溶液由无色 变为 ⑫ 色 置换 Mg+2HCl MgCl 2 +H 2 ↑ Mg+H 2 SO 4 MgSO 4 +H 2 ↑ 气泡 Fe+2HCl FeCl 2 +H 2 ↑ 浅绿 Fe+H 2 SO 4 FeSO 4 +H 2 ↑ (续表) 化学性质 条件及通式 化学方程式 现象及 解释 注意 金属与某些可 溶性盐溶液反应 条件 : 前置换后 (K 、 Ca 、 Na 除外 ), 盐可溶 通式 : 金属 + 盐→新盐 + 新金属 ( 属于 ⑬ 反应 ) Fe 与 CuSO 4 溶液 : ⑭______________ _________________ 铁表面 有 ⑮ 色的固体生成 , 溶液 由 ⑯ _____ 色 变为浅绿色 铁与硫酸铜溶液的反应是我国古代湿法冶金术的先驱 若金属表面有“锈”即“氧化膜” , 应先用砂纸打磨干净 , 再做实验 置换 Fe+CuSO 4 红 蓝 FeSO 4 +Cu (续表) 化学性质 条件及通式 化学方程式 现象及 解释 注意 金属与某些可 溶性盐溶液反应 条件 : 前置换后 (K 、 Ca 、 Na 除外 ), 盐可溶 通式 : 金属 + 盐→新盐 + 新金属 ( 属于 ⑬ 反应 ) Cu 与 AgNO 3 溶液 : ⑰ _______________ __________________ ________ 铜表面 有 ⑱ 色的物质生成 , 溶液由无色 变为 ⑲ 色 铁与硫酸铜溶液的反应是我国古代湿法冶金术的先驱 若金属表面有“锈”即“氧化膜” , 应先用砂纸打磨干净 , 再做实验 置换 Cu+2AgNO 3 银白 蓝 Cu(NO 3 ) 2 + 2Ag (续表) 化学性质 条件及通式 化学方程式 现象及 解释 注意 金属与某些可 溶性盐溶液反应 条件 : 前置换后 (K 、 Ca 、 Na 除外 ), 盐可溶 通式 : 金属 + 盐→新盐 + 新金属 ( 属于 ⑬ 反应 ) Al 与 CuSO 4 溶液 : ⑳ _______________ _________________ _______ 铝表面 有 ㉑ 色的物质生成 , 溶液由蓝色 变为 ㉒ 色 铁与硫酸铜溶液的反应是我国古代湿法冶金术的先驱 若金属表面有“锈”即“氧化膜” , 应先用砂纸打磨干净 , 再做实验 置换 2Al+3CuSO 4 红 无 Al 2 (SO 4 ) 3 + 3Cu 2. 实验室模拟炼铁 实验装置 实验原理 ㉓__________________________________ 3CO+Fe 2 O 3 2Fe+3CO 2 (续表) 实验步骤 (1) 先通纯净的 CO 一段时间——原因 : ㉔____________________________________ (2) 再点燃酒精喷灯 , 给 Fe 2 O 3 加热——目的 : 使氧化铁和一氧化碳发生反应 (3) 实验结束 , 先停止加热再停止通入 CO(CO 早出晚归 , 酒精喷灯迟到早退 ) ——原因 : 一是 ㉕ 二是 ㉖ 排尽玻璃管内的空气 , 防止加热时发生爆炸 防止液体倒吸 防止新生成的铁在较高温度下被 空气中的氧气再次氧化 (续表) 实验现象 玻璃管内 : ㉘ 试管中 :㉙ 最右端导管口 : 有 ㉚ 色火焰产生 实验反思 一氧化碳是有毒气体 , 本实验尾气处理方法 是 ㉛ , 还可以用气囊收集 该实验可验证 CO 的 ㉗ 、 ㉜ 的化学性质 红色粉末变为黑色 澄清石灰水变浑浊 蓝 点燃 还原性 可燃性 3. 铁制品锈蚀条件探究 编号 Ⅰ Ⅱ Ⅲ 实验图示 生锈程度 ㉝_____________ ㉞_____________ ㉟__________ 不生锈 不生锈 生锈 (续表) 编号 Ⅰ Ⅱ Ⅲ 对比分析 实验 Ⅰ 、 Ⅲ 说明铁生锈一定 与 ㊱ 有关 ; 实验 Ⅱ 、 Ⅲ 说明铁生锈一定与 ㊲ 有关 ; 实验 Ⅰ 蒸馏水煮沸后使用的原因是 ㊳ 结论 分析对比实验 Ⅰ 、 Ⅱ 、 Ⅲ 可知 , 铁生锈的条件 是 ㊴ O 2 H 2 O 除去水中溶解的氧气 Fe 与 O 2 、 H 2 O 同时接触 易错判断 1. 合金一定是由两种或多种金属熔合而成 ( ) 2. 合金都是混合物 , 属于合成材料 ( ) 3. 金刚石、生铁、氧化铁、磁铁矿都是合金 ( ) 4. “真金不怕火炼”说明金的化学性质稳定 ( ) 5. 铝具有良好的抗腐蚀性是因为铝很难与氧气发生反应 ( ) 6. 铁丝在氧气中燃烧生成黑色的氧化铁 ( ) 7. 铁与稀盐酸反应 :2Fe+6HCl 2FeCl 3 +3H 2 ↑ ( ) 8. 经常用钢丝球擦洗铝锅表面保持洁净 ( ) 9. 高炉炼铁得到的产物是纯铁 ( ) × × × √ × × × × × 化学方程式网络构建 图 5-1 考向一 金属材料 ( 6 年 6 考) 1. [2019 · 河北 ] 下列有关金属及合金的说法错误的是 ( ) A. 常温下所有的金属都是固体 B. 铁制品在潮湿的空气中易生锈 C. 生铁和不锈钢都是金属材料 D. 铝片表面易生成致密的氧化膜 [ 答案 ]A [ 解析 ] 汞是金属 , 但是常温下是液体。 2. [2018 · 河北节选 ] 理化知识在生产、生活中有着广泛的应用。保险丝 ( 铅锑合金 ) 比组成它的纯金属的熔点 。 3. [2017 · 河北 ] 锰钢比组成它的纯金属硬度 , 可用于制作钢轨。 低 大 4. 拓展 下列有关铜和铜的合金说法不正确的是 ( ) A. 黄铜是混合物 B. 黄铜和纯铜互相刻画 , 黄铜上会有划痕 C. 黄铜比纯铜耐腐蚀 D. 银的导电性比铜好 , 但经常用铜作导线 [ 答案 ] B [ 解析 ] 所有合金都是混合物 ; 合金的硬度比组成它的纯金属要大 , 所以纯铜上有划痕 ; 合金的抗腐蚀性比纯金属要好 ; 性质并不是决定用途的唯一因素 , 价格、资源等都会影响物质的用途 , 银的导电性虽然很好 , 但价格昂贵 , 所以不用银作导线。 考向二 金属的化学性质 ( 6 年 6 考) 5. [2019 · 河北 ] 将一定量的铁粉加入到含有 Cu(NO 3 ) 2 和 AgNO 3 的废液中 , 充分反应后过滤 , 向滤渣中加入稀盐酸 , 无气泡产生。下列判断正确的是 ( ) A. 滤渣中一定含有 Ag 和 Cu, 滤液中一定含有 Fe(NO 3 ) 2 B. 滤渣中一定不含 Fe, 滤液中一定含有 Fe(NO 3 ) 2 和 Cu(NO 3 ) 2 C. 滤渣中一定含有 Ag, 滤液中可能含有 Cu(NO 3 ) 2 和 AgNO 3 D. 滤渣中一定含有 Ag 和 Cu, 滤液中可能含有 Cu(NO 3 ) 2 和 AgNO 3 [ 答案 ] C [ 解析 ] 将一定量的铁粉加入到含有 Cu(NO 3 ) 2 和 AgNO 3 的废液中 , 铁先和硝酸银反应 , 硝酸银反应完之后铁再和硝酸铜发生反应。向滤渣中加入稀盐酸 , 无气泡产生 , 因此滤渣中一定不含铁 , 一定含有银 , 可能含有铜 ; 滤液中一定含有硝酸亚铁 , 可能含有硝酸铜和硝酸银。 6. [2015 · 河北 ] 金属 M 与 AgNO 3 溶液发生反应 :M+2AgNO 3 M(NO 3 ) 2 +2Ag 。下列说法正确的是 ( ) A.M 可能是铝 B.Ag 的金属活动性比 M 强 C. 反应前后 M 的化合价发生了改变 D. 在金属活动性顺序里 ,M 一定排在氢前 C 7. [2014 · 河北 ] 等质量的 X 、 Y 两种金属分别和足量同体积、同浓度的盐酸反应 , 产生气体的质量与时间的关系如图 5-2 所示。下列说法错误的是 ( ) A. t 1 时 , 产生气体的质量 :X>Y B. t 2 时 , 消耗金属的质量 :X>Y C. t 3 时 , 消耗金属的质量 :X=Y D. t 3 时 , 消耗盐酸的质量 :X=Y 图 5-2 [ 答案 ] D [ 解析 ] 从图像分析可知 : t 1 时 ,X 、 Y 两种金属都没有消耗完 ,X 产生氢气的质量大于 Y; 依题意可知 ,X 、 Y 两金属质量相等 , t 2 时 ,X 恰好反应完 ,Y 还未反应完 , 故消耗 X 的质量大于 Y; t 3 时 , 两反应都已结束 , 故消耗 X 的质量等于 Y; 当消耗等质量的金属 X 、 Y 时 , 生成氢气质量多的 X 消耗的盐酸质量也多。 8. [2016 · 河北 ] 下列验证 Zn 、 Fe 、 Ag 三种金属活动性顺序的实验方案中 ( “ - ”表示未进行金属与盐溶液之间的实验 ), 不能达到实验目的的是 ( ) [ 答案 ]C [ 解析 ] 银不能与硫酸锌反应 , 说明锌的金属活动性比银强 ; 锌能与硫酸亚铁溶液反应 , 说明锌的金属活动性比铁强 ,C 中组合不能验证 Fe 、 Ag 两种金属的活动性顺序。 选项金属盐溶液 A B C D ZnSO 4 溶液 - Fe Ag Fe FeSO 4 溶液 Zn Ag Zn - AgNO 3 溶液 Fe - - Fe 9. [2018 · 河北 ] 如图 5-3 所示的四个图像 , 分别对应四种过程 , 其中正确的是 ( ) A.① 分别向等质量 Mg 和 Cu 中加入足量等质量、等浓度的稀硫酸 B.② 分别向等质量且足量的 Zn 中加入等质量、不同浓度的稀硫酸 C.③ 分别向等质量且足量的 Mg 和 Zn 中 , 加入等质量、等浓度的稀硫酸 D.④ 分别向等质量的 Mg 和 Zn 中加入等质量、等浓度且足量的稀硫酸 图 5-3 [ 答案 ] C [ 解析 ] 铜不能和稀硫酸反应生成氢气 , 故 A 选项错误 ; 金属过量 , 酸完全反应 , 所以浓度大的稀硫酸产生的氢气多 , 故 B 选项错误 ; 等质量、足量的镁和锌与等质量、等浓度的稀硫酸反应 , 产生氢气的质量相同 , 并且镁比锌活泼 , 所以镁反应速率较快 ,C 选项正确 ; 等质量的镁和锌与足量的等质量、等浓度的稀硫酸反应 , 镁产生的氢气较多 , 并且镁反应的速率较快 , 故 D 选项错误。 10. 拓展 [2019 · 黄石 ] 用盐酸与金属单质反应 , 探究锌、镁、铜的金属活动性 ( 如图 5-4) 。下列有关现象、分析或结论正确的是 ( ) A. 铜片表面可以观察到气泡 B. 锌片的试管比镁片的试管更热 C. 金属活动性由强到弱顺序为 : 镁 > 锌 > 铜 D. 三支试管中盐酸溶液的质量分数可以不同 图 5-4 [ 答案 ] C [ 解析 ] 由于铜位于金属活动性顺序表中氢之后 , 不能与酸反应 , 无气泡产生 ; 镁与盐酸反应速率比锌快 , 则镁片的试管比锌片的试管更热 ; 镁与盐酸反应的速率比锌快 , 铜与盐酸不反应 , 则金属活动性由强到弱的顺序为镁 > 锌 > 铜 ; 在探究金属活动性顺序时需控制变量 , 则盐酸应等质量、等质量分数。 11. 拓展 向硫酸亚铁和硫酸铜的混合物中加入一些锌粉 , 充分反应后过滤 , 得到固体不溶物 A 和滤液 , 向 A 中放入少量的稀硫酸 , 有气体生成。则 A 中一定含有 , 可能含有 , 滤液中一定含有的溶质是 , 一定没有的溶质是 , 可能含有的溶质是 。 [ 答案 ] 铜和铁 锌 硫酸锌 硫酸铜 硫酸亚铁 [ 解析 ] 在金属活动顺序表中锌和铜的距离比锌和铁的距离远 , 所以锌先和硫酸铜反应。若锌很少 , 就只和硫酸铜反应 , 没有将硫酸铜反应完 , 则滤渣中只有铜 , 滤液中有生成的硫酸锌和剩余的硫酸铜以及未反应的硫酸亚铁 ; 若锌刚好把硫酸铜反应完 , 则滤渣中有铜 , 滤液中有硫酸锌和硫酸亚铁 ; 若锌把硫酸铜反应完 , 还有剩余 , 再和硫酸亚铁反应 , 但锌的量不足以把硫酸亚铁反应完 , 则滤渣中有铜和铁 , 滤液中有硫酸锌和剩余的硫酸亚铁 ; 若锌刚好把硫酸亚铁也反应完 , 则滤渣中有铜和铁 , 滤液中只有硫酸锌 ; 若锌把硫酸亚铁也反应完 , 锌还有剩余 , 则滤渣中有铜、铁和锌 , 滤液中只有硫酸锌。 A 中加入稀硫酸有气体生成 , 说明滤渣中有铜和铁 , 或者是滤渣中有铜、铁和锌 ; 滤液中一定有硫酸锌 , 因为固体中已经有铁被置换出来 , 说明硫酸铜已经反应完 , 所以滤液中一定没有硫酸铜 , 但可能硫酸亚铁没被完全反应 , 所以可能有硫酸亚铁。 【 方法点拨 】 金属与酸反应涉及三个量 : 反应物质量、生成物质量、反应速率。金属与酸反应图像类型 : 气体 - 时间图、气体 - 金属图、气体 - 稀酸图。其中只有气体 - 时间图可以反映反应的速率 , 从而判断金属的活动性顺序。 足量金属 与等量酸反应 ① 如图甲 , 金属活动性 :Mg>Zn>Fe ② 生成氢气质量 ( 由酸质量决定 ):Mg=Fe=Zn ③ 如图乙 , 消耗金属质量 ( 由相对原子质量与化合价的比值决定 , 比值越小消耗金属质量越少 ):Mg查看更多