- 2021-05-10 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广东省仲元中学高三三模化学试题 Word含答案高考
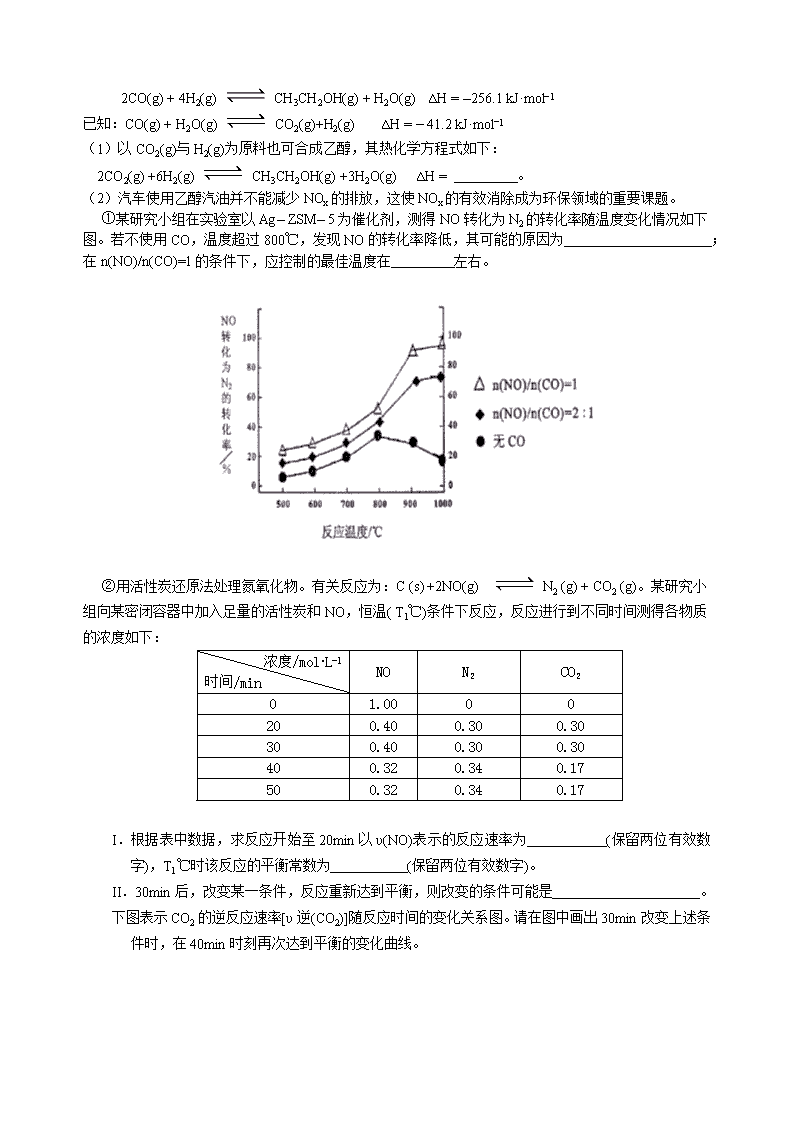
仲元中学2013年三模化学试题 三模化学试题 可能用到的相对原子质量:H 1 C 12 N 14 O l6 Mg 24 S 32 Ba 137 7.下列说法正确的是 A.淀粉和蛋白质均可作为生产葡萄糖的原料 B.实验室可用酸性高锰酸钾溶液鉴别甲苯和己烯 C.石油裂化和油脂皂化都是高分子生成小分子的过程 D.装饰材料中的甲醛和芳香烃会造成居室污染 8.能在透明溶液中大量共存的一组离子是 A.Na+、NH4+、OH–、HCO3– B.Ca2+、Ag+、NO3–、SiO32– C.K +、Cu2+、Cl–、SO42– D.H+、Fe3+、I–、ClO– 9.下列实验操作正确且能达到目的是 A.向苯中滴加溴水制备溴苯 B.用碱式滴定管量取20.00mL KMnO4溶液 C.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH) 3胶体 D.向含有I–的溶液中滴加氯水和CCl4,振荡、静置检验I–的存在 10.NA表示阿伏加德罗常数,下列叙述正确的是 A.常温下,9g H2O中含NA个O–H键 B.1 molFe2+与足量稀硝酸反应,转移3 NA个电子 C.常温常压下,22. 4L SO2和O2的混合气体中含2NA个氧原子 D.1 L 0. 1 mol·L–1,KAl(SO4)2溶液含0.1NA个Al3+ 11.下列有关物质性质和应用叙述正确并且有因果关系的是 A.烧碱具有碱性,能用于治疗胃酸过多 B.焦炭具有还原性,一定条件下能将二氧化硅还原为硅 C.浓硝酸具有强氧化性,能和浓氨水反应产生白烟 D.二氧化硫具有漂白性,与氯水混合使用漂白效果更好 12.某小组为研究电化学原理,设计如右图装置。下列叙述不正确的是 A.a、b不连接时,只有锌片上有气泡逸出 B. a和b用导线连接时,铜片上发生的反应为:2H+ + 2e– =H2 ↑ C.a和b是否用导线连接,装置中所涉及的化学反应都相同 D.a和b用导线连接或接直流电源,锌片都能溶解 Z W X Y 22.短周期元素X、Y、Z、W在周期表的位置如右图所示,其中X元素所处的周期序数与族序数相等。下列判断正确的是 A.气态氢化物的稳定性:Y>Z B.一定条件下,Z单质与W的常见单质直接反应生成ZW2 C.原子半径:X>Y>Z>W D.Y、Z的最高价氧化物均为共价化合物 23.常温下PH=a的CH3COOH稀溶液与PH=b的NaOH稀溶液等体积混合,下列判断正确的是 A.反应过程中,CH3COOH的电离程度增大 B.若混合后PH=7,则a+b=14 C.若混合后PH=5.3,则c(Na+)< c( CH3COO–) D.若混合后CH3COOH与NaOH恰好完全反应,则a+b<14 30. (15分)锂电池中Li+迁移需要一种高分子化合物作为介质,合成该高分子化合物的单体(化合物V)的反应如下: 化合物I的合成路线如下: (1)化合物I的分子式为 ;化合物V中含氧官能团的名称为 。 (2)C4H8呈链状,其结构中有一个碳原子上没有氢原子,写出由IV→III反应的化学方程式 。 (3)II的一种同分异构体,能发生分子内酯化反生成五元环状化合物,写出该同分异构体的结构简式 ,由II→I的反应类型为 。 (4)苯酚也可与发生类似反应①的反应,试写出其中一种产物的结构简式 。 31.(17分)乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为: 2CO(g) + 4H2(g) CH3CH2OH(g) + H2O(g) ∆H = –256.1 kJ·mol–1 已知:CO(g) + H2O(g) CO2(g)+H2(g) ∆H = – 41.2 kJ·mol–1 (1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下: 2CO2(g) +6H2(g) CH3CH2OH(g) +3H2O(g) ∆H = 。 (2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。 ①某研究小组在实验室以Ag– ZSM– 5为催化剂,测得NO转化为N2的转化率随温度变化情况如下图。若不使用CO,温度超过800℃,发现NO的转化率降低,其可能的原因为 ; 在n(NO)/n(CO)=1的条件下,应控制的最佳温度在 左右。 ②用活性炭还原法处理氮氧化物。有关反应为:C (s) +2NO(g) N2 (g) + CO2 (g)。某研究小组向某密闭容器中加入足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下: 浓度/mol∙L–1 时间/min NO N2 CO2 0 1.00 0 0 20 0.40 0.30 0.30 30 0.40 0.30 0.30 40 0.32 0.34 0.17 50 0.32 0.34 0.17 I.根据表中数据,求反应开始至20min以υ(NO)表示的反应速率为 (保留两位有效数字),T1℃时该反应的平衡常数为 (保留两位有效数字)。 II.30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。 下图表示CO2的逆反应速率[υ逆(CO2)]随反应时间的变化关系图。请在图中画出30min改变上述条件时,在40min时刻再次达到平衡的变化曲线。 32.(16分)Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药等。某生产BaCO3、BaSO4的化工厂生产中排出大量的钡泥[主要含有BaCO3、BaSO3、Ba(FeO2)2等],该厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下: 已知: ①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7; ②Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9=9-dd 。 (1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式说明提纯原理: 。 (2)酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为 。 (3)该厂结合本厂实际,选用的X为 (填序号), A.NaOH B.Ba(OH)2 C.Ba(NO3)2 D.BaCO3 中和I使溶液中的 (填离子符号)的浓度减小。 (4)最后的废渣中除原有的难溶性杂质外还含有 (填化学式)。 (5)测定所得Ba(NO3)2晶体的纯度:准确称取m1g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m2g,则该晶体纯度的计算表达式为 。 33.(16分)已知草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质。下图是利用饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2,ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11.0℃ A B C (1)该反应的反应原理为以下化学方程式,试配平: _____KClO3+_____H2C2O4 === ____KHCO3+____ClO2↑ (2)B装置的作用是____________________________________。 (3)C装置是尾气处理装置,反应一段时间后,C中含有NaOH、NaClO2、NaClO3等溶质,有同学说,C中还可能含有Na2CO3,试分析可能的原因 。 (4)某同学查资料得知“菠菜中富含可溶性草酸盐和碳酸盐,他将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈碱性,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤,沉淀备用,对生成的沉淀进行探究。 ①提出合理假设 假设1:只存在CaCO3; 假设2:既存在CaCO3,也存在CaC2O4; 假设3: 。 ②基于假设2,设计实验方案,进行实验。请在答题卷上写出实验步骤以及预期现象和结论。限选实验试剂:1 mol·L-1 H2SO4、0.1 mol·L-1 HCl、0.1 mol·L-1 HNO3、0.1 mol·L-1 NaOH、0.01 mol·L-1 KMnO4溶液、0.1 mol·L-1 KI溶液、淀粉、澄清石灰水。 实验步骤 预期现象和结论 步骤1:取少量沉淀于试管中,加入 。 步骤2: 。 2013年仲元中学三模化学答卷 班别: 姓名: 学号: 30.(15分) (1) ; 。 (2) 。 (3) ; 。 (4) 。 31.(17分) (1)∆H = 。 (2)① ; 。 ②I. ; 。 II. 。 32、(16分) (1) 。 (2) 。 (3) ; (填离子符号)。 (4) (填化学式)。 (5)计算表达式为 。 33.(16分) (1) _____, _____, ,____ ,____ (2) 。 (3) 。 (4)① 假设3: 。 ② 实验步骤 预期现象和结论 步骤1: 。 步骤2: 。 三模化学试题参考答案 7、D 8、C 9、D 10、A 11、B 12、D 22、CD 23、AC 33.(16分) (1) 2 1 2 2 (2分) (2)将ClO2冷凝收集(2分) (3)过量的草酸与KHCO3反应,逸出的CO2与NaOH溶液反应生成Na2CO3。(或因KClO3具有较强氧化性,将草酸氧化成CO2,逸出的CO2与NaOH溶液反应生成Na2CO3)(3分,答对其中一个原因就给满分)。 (4)①只存在CaC2O4(1分) ② 实验步骤 预期现象和结论 加入足量0.1 mol·L-1 HCl(2分) 沉淀全部溶解,有气泡产生,说明沉淀中有碳酸钙(2分) 往步骤1的剩余物中,再滴加几滴0.01 mol·L-1 KMnO4溶液(2分) 溶液紫红色褪去,说明沉淀中有CaC2O4,结合步骤1,说明假设2成立。(2分)查看更多