- 2021-05-10 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年高中化学同步学典5第六章第二节化学反应的速率与限度练习含解析 人教版必修第二册
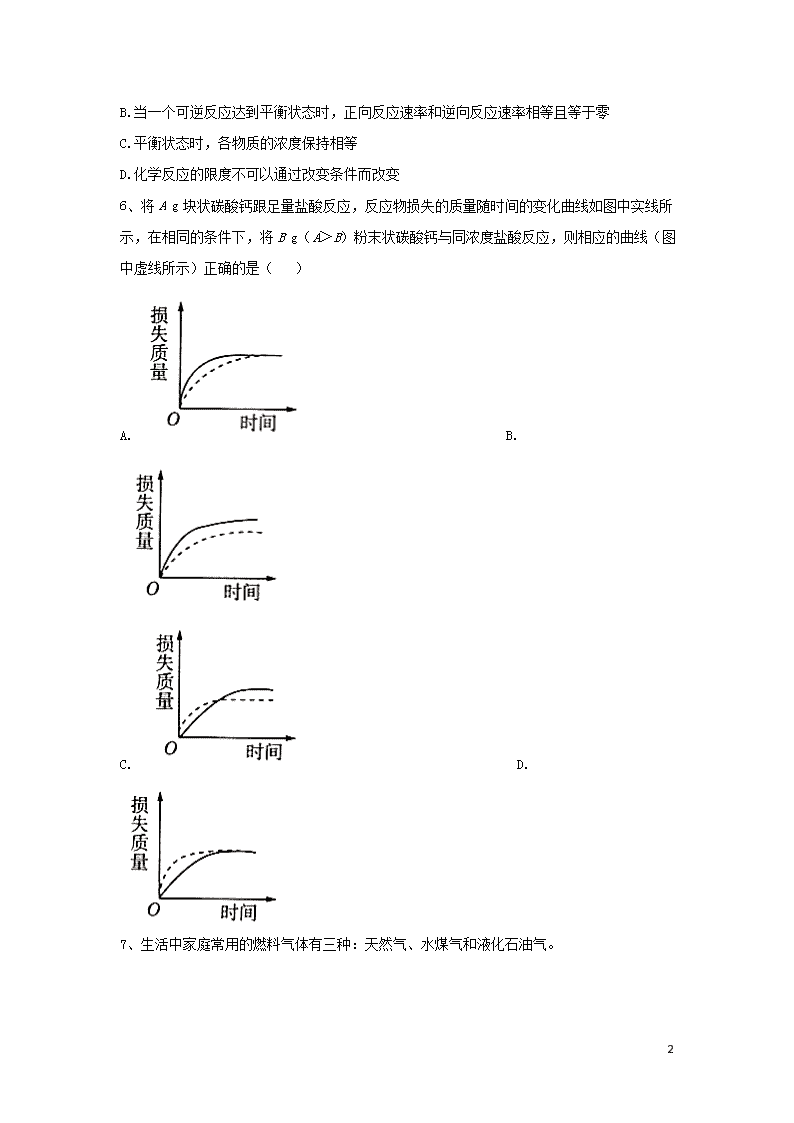
化学反应的速率与限度 1、关于化学反应速率的说法正确的是( ) A.化学反应速率可表示反应进行的程度 B.化学反应速率是指一定时间内,任何一种反应物浓度的减少或任何一种生成物浓度的增加 C.对于任何化学反应来说,反应速率越快,反应现象就越明显 D.根据反应速率的大小可知化学反应进行的相对快慢 2、硝酸是工业生产中的重要原料,工业制备硝酸的流程为NH3→NO→NO2→HNO3。 其中一个重要反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的速率v(X)(反应物的消耗速率或产物的生成速率)可表示为( ) A.v(NH3)=0.010mol·L-1·s-1 B.v(O2)=0.0010mol·L-1·s-1 C.v(NO)=0.0010mol·L-1·s-1 D.v(H2O)=0.045mol·L-1·s-1 3、下列措施可以提高燃料燃烧效率的是( ) ①提高燃料的着火点 ②降低燃料的着火点 ③将固体燃料粉碎 ④将液体燃料雾化处理 ⑤将煤进行气化处理 ⑥通入适当过量的空气 A.①③④⑤ B.②③⑤⑥ C.③④⑤⑥ D.①② ③④ 4、某温度下,浓度都是1mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,反应2min后,测得参加反应的X2为0.6mol·L-1,用Y2变化表示的反应速率v(Y2)=0.1mol·L-1·min-1,生成的c(Z)=0.4mol·L-1,则该反应的方程式为( ) A.3X2+Y22X3Y B.2X2+Y22X2Y C.X2+2Y22XY2 D.X2+3Y22XY3 5、下列关于化学反应限度的说法中正确的是( ) A.Cl2 10 溶于水发生了可逆反应 B.当一个可逆反应达到平衡状态时,正向反应速率和逆向反应速率相等且等于零 C.平衡状态时,各物质的浓度保持相等 D.化学反应的限度不可以通过改变条件而改变 6、将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如图中实线所示,在相同的条件下,将B g(A>B)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是( ) A. B. C. D. 7、生活中家庭常用的燃料气体有三种:天然气、水煤气和液化石油气。 10 天然气和液化石油气燃烧的主要化学方程式依次为CH4+2O2CO2+2H2O,C3H8+5O23CO2+4H2O,现有一套以天然气为燃料的灶具,今改为烧液化石油气,应采用的正确措施是( ) A.减少空气进入量,增大石油气进入量 B.增大空气进入量,减少石油气进入量 C.减少空气进入量,减少石油气进入量 D.增大空气进入量,增大石油气进入量 8、反应,经2 min后,B的浓度减少。下列说法中,正确的是( ) A.用A表示的化学反应速率是 B.分别用B、C、D表示化学反应速率,其比值是3:2:1 C.在2 min末的反应速率,用B表示的是 D.在这2 min内B和C两物质的浓度都减小 9、其他条件不变时,能使反应速率加快的是( ) A.对于反应,增大体系的压强 B.对于,容器体积固定不变时,充入Ar C.对于,容器体积固定不变时,充入 D.对于,容器气体压强不变时,充入Ar 10、在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是( ) A. B. C. D. 10 11、H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( ) A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快 B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快 C.图丙表明,有少量存在时,溶液碱性越强,H2O2分解速率越快 D.图丙和图丁表明,碱性溶液中,对H2O2分解速率的影响大 12、一定温度下,某恒容密闭容器中含有、两种气体,反应开始至达到平衡状态过程中,两种物质的浓度随时间的变化如下所示。 10 (1)表示浓度变化的曲线是__ _ __,写出相应的化学方程式:______________ ______。 (2)从反应开始至达到平衡的过程中,用表示的反应速率=_____,a、b两点对应状态中,曲线X代表的物质的反应速率相对大小为v(a)_____v(b)。 (3)若平衡后改变温度,容器中气体平均摩尔质量变大,则反应向生成_____(填“”或“”)的方向移动。 13、某实验小组以H2O2的分解为例,研究浓度、催化剂、溶液的酸碱性对反应速率的影响。在常温下按照如下方案完成实验。 实验编号 反应物 催化剂 ① 10 mL 2%溶液 无 ② 10 mL 5%溶液 无 ③ 10 mL 5%溶液 1 mL 溶液 ④ 10 mL 5%溶液+少量HCl溶液 1 mL 溶液 ⑤ 10 mL 5%溶液+少量HCl溶液 1 mL 溶液 (1)实验①和②的目的是_____ ___________。实验时由于没有观察到明显现象而无法得出结论。为了达到实验目的,你对原实验方案的改进是_____________ ___。 (2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图所示。 分析图示能够得出的实验结论是_______ _________。 10 14、一定温度下,在2L的密闭容器中,M、N两种气体的物质的量随时间变化的曲线如图所示: (1)反应的化学方程式为_______________。 (2)反应达到最大限度的时间是_ ___min,该时间内的平均反应速率v(N)=___ _。 (3)反应达到平衡状态时,放出80kJ的热量,当容器中充入1mol N时,反应放出的热量为 (填序号) ①等于Q kJ ②小于Q kJ ③大于Q kJ ④等于2Q kJ (4)判断该反应达到平衡状态的依据是 (填序号) ①该条件下,正、逆反应速率都为零 ②该条件下,混合气体的密度不再发生变化 ③该条件下,混合气体的压强不再发生变化 ④条件下,单位时间内消耗2mol N的同时,生成1mol M (5)能加快反应速率的措施是( )(填序号) ①升高温度 ②容器容积不变,充入惰性气体Ar ③容器压强不变,充入惰性气体Ar ④使用催化剂 答案以及解析 1答案及解析: 答案:D 2答案及解析: 答案:C 3答案及解析: 答案:C 10 解析:③将固体燃料粉碎、④将液体燃料雾化处理、⑤将煤进行气化处理、⑥通入适当过量的空气,均可以增大燃料与空气的接触面积,提高燃烧效率,故选C项。 4答案及解析: 答案:A 5答案及解析: 答案:A 6答案及解析: 答案:B 解析:固体表面 积越大,则反应速率越大,加入粉末状碳酸钙与同浓度盐酸反应,比块状碳酸钙反应速率大,即相同时间内虚线所示的曲线对应的损失的质量大,因为A>B,导致最终损失的质量AB,由图像可知,故选C 思路点拨:分析化学反应速率的图像应注意以下几方面:①看起点,分清反应物和生成物,浓度减小的是反应物,浓度增大的是生成物,生成物多数以原点为起点。②看变化趋势,分清正反应和逆反应,分清放热反应和吸热反应。③看终点,分清消耗浓度和增加浓度,反应物的消耗浓度与生成物增加浓度之比等于反应方程式中各物质的化学计量数之比。④对于速率一时间图像,看清曲线是连续的还是跳跃的,分清“渐变”和“突变”,“大变”和“小变”。 7答案及解析: 答案:B 8答案及解析: 答案:B 解析:A为固体,一般不用固体表示化学反应速率,因为固体的浓度一般视为常数,A项错误。在同一反应中,不同物质表示的化学反应速率的比值等于它们的化学计量数之比,B项正确。为平均值并非2 min末的反应速率,C项错误。B为反应物,C为生成物,两者不可能同时减小,D项错误。 9答案及解析: 答案:C 10 解析:A中反应物各物质为非气体,压强增大,反应速率不变。B选项,各反应物的浓度不变,化学反应速率不变。C选项,c()增大,反应速率加快。D选项,容器气体压强不变时,充入Ar,体积变大,各物质的浓度减小,反应速率减慢。方法技巧增大压强能引起气体反应物浓度增大的,才能加快反应速率。 10答案及解析: 答案:C 解析:同一个化学反应,用不同的物质表示其反应速率时,数值可能不同,但表示的意义是相同的。所以在比较反应速率快慢时,应该换算成用同一种物质表示,然后才能直接比较速率数值大小。根据速率之比是相应化学计量数之比可知,如果都用氢气表示,则选项A、C的反应速率分别是、。因为温度高,反应速率大,所以答案选C。 11答案及解析: 答案:D 解析:图甲表明,其他条件相同时.随着浓度的增大,其分解速率越快,故A项错误。图乙表明,其他条件相同时,随着NaOH浓度的增大,即溶液pH的增大, 分解速率越快,故B项错误。由图丙可知,有少量存在时,1.0 NaOH条件下对应的分解速率要小于0.1NaOH条件下的分解速率,因此并不是碱性越强. 分解速率越快,故C项错误。由图丙和图丁可知,pH相同的碱性条件下,浓度越大, 分解速率越快,故D项正确。综上所述,本题正确答案为D。 12答案及解析: 答案:(1)X; (2);> (3) 解析:(1)根据题图,达到平衡时,X的浓度降低了8,Y的浓度增大了4,因此表示浓度变化的曲线是X,反应的化学方程式为 10 (2)从反应开始至达到平衡的过程中,用表示的反应速率;a、b两点均未达到平衡状态,根据题图可知 v(a)> v(b)。 (3)若平衡后改变温度,容器中气体平均摩尔质量变大,说明气体的物质的量变小,则反应向生成的方向移动。 13答案及解析: 答案:(1)探究浓度对反应速率的影响;向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中); (2)碱性环境能加快H2O2分解的速率,酸性环境能减慢H2O2分解的速率 解析:(1)对比实验①、②的实验条件,其他条件相同,仅H2O2溶液的浓度不同,故其目的是探究反应物浓度对化学反应速率的影响。“通常条件下H2O2稳定,不易分解”,欲使H2O2分解产生O2,可向反应物中加入等种催化剂或将盛有尽应物的试管放入同一热水浴中,从而加快反应速率,便于观察。 (2)实验④为酸性溶液,实验⑤为碱性溶液,图中实验③、④、⑤生成氧气的体积相同,但反应的时间不同,反应速率不同,分析可知:溶液的酸性越强,H2O2的分解速率越慢;溶液的碱性越强,H2O2的分解速率越快。 14答案及解析: 答案:(1) (2)60.5mol/(L·min)(3)②(4)③(5)①④ 解析:(1)反应进行到6min时N减少8mol-2mol=6mol,M增加5mol-2mol=3mol,因此反应的化学方程式为 (2)根据题图可知反应进行到6min时物质的物质的量不再发生变化,因此反应达到最大限度的时间是6min,该时间内的平均反应速率。 (3)充入8mol N,反应达到平衡状态时,放出80kJ的热量,充入1mol N与充入8mol时相比,若转化率相同,则放出0kJ的热量。但该反应是在密闭容器中,充入1mol与充入8mol相比,压强减小,平衡逆向移动,所以反应放出的热量小于0kJ。 10 (4)A达到平衡状态时正、逆反应速率相等,但不能为零,错误;B密度是混合气体的质量和容器容积的比值,在反应过程中质最和容积始终是不变的,因此该条件下,混合气体的密度不再发生变化不能说明反应达到平衡状态,错误;C正反应体积减小,则该条件下,混合气体的压强不再发生变化能说明反应达到平衡状态,正确;D该条件下,单位时间内消耗2mol N的同时,生成1mol M,均表示正反应速率,不能说明反应达到平衡状态,错误。 (5)A升高温度反应速率加快;B容器容积不变,充入惰性气体Ar,反应物浓度不变,反应速率不变;C容器压强不变,充入惰性气体Ar,容器容积增大,反应物浓度减小,反应速率减小;D使用催化剂,反应速率加快。 10查看更多