- 2021-05-10 发布 |
- 37.5 KB |
- 11页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年高中化学课时作业21化学电源含解析 人教版选修4
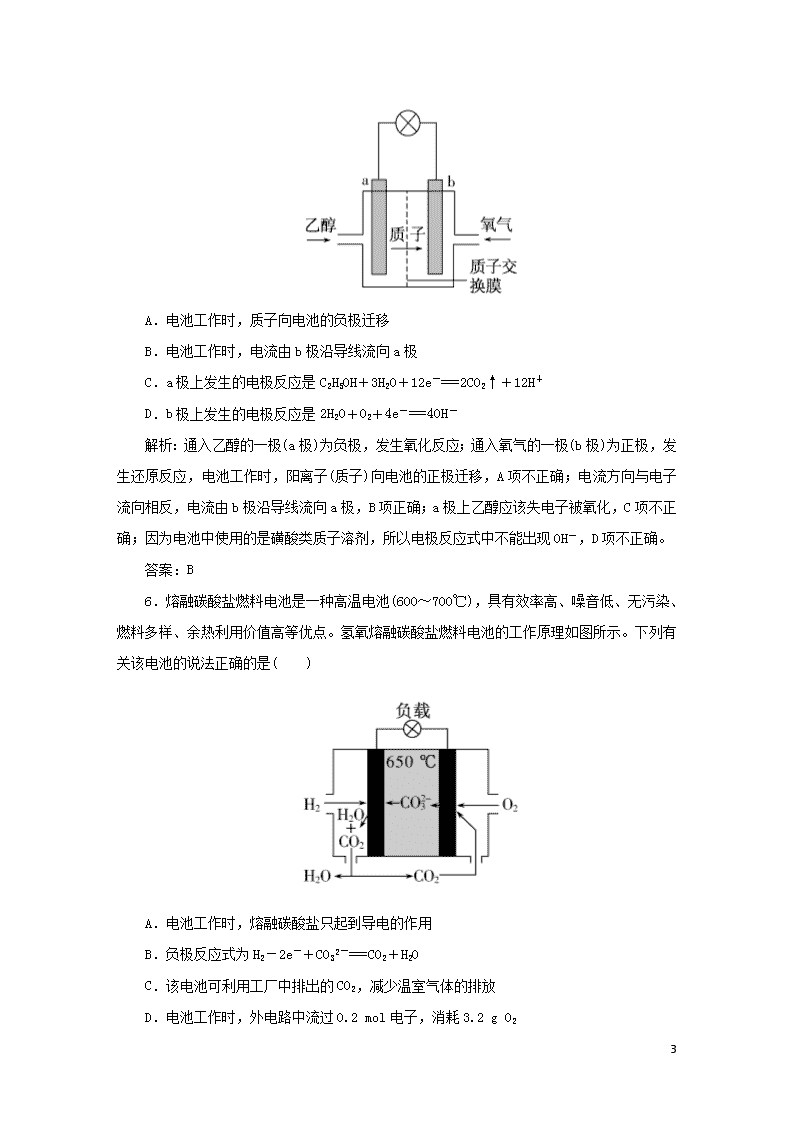
课时作业21 化学电源 10 基础训练 1.(2019年辽宁省期末)下列有关电池的说法不正确的是( ) A.手机上用的锂离子电池属于二次电池 B.锌锰干电池中,锌电极是负极 C.氢氧燃料电池可把化学能转化为电能 D.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 解析:手机上用的锂离子电池既能放电又能充电,故其属于二次电池,A正确;锌锰干电池中,碳棒是正极、锌电极是负极,B正确;氢氧燃料电池可把化学能转化为电能,C正确; 铜锌原电池工作时,电子沿外电路从锌电极流向铜电极,D不正确。 答案:D 2.(2019年辽宁省大连市高二期末)关于下列装置的说法,正确的是( ) A.装置①中,盐桥中的K+移向CuSO4溶液 B.装置①中,Zn为负极,发生还原反应 C.装置②中的Fe发生析氢腐蚀 D.装置②中电子由Fe流向石墨,然后再经溶液流向Fe 解析:装置①为原电池,锌比铜活泼,锌为负极,铜为正极,盐桥中的K+移向CuSO4溶液,即向正极移动,故A正确;装置①中,Zn为负极,发生氧化反应,故B错误;装置②电解质为氯化钠,溶液呈中性,铁发生吸氧腐蚀,故C错误;电子只能经过外电路,不能经过溶液,故D错误。 答案:A 10 3. (2019年河南省二模)铅蓄电池的示意图如图所示。下列说法正确的是( ) A.放电时,N为负极,其电极反应式为PbO2+SO42-+4H++2e-===PbSO4+2H2O B.放电时,c(H2SO4)不变,两极的质量增加 C.充电时,阳极反应式为PbSO4+2e-===Pb+SO42- D.充电时,若N连电源正极,则该极生成PbO2 解析:放电时,是原电池,N作正极,A不正确;放电时,正、负极均消耗硫酸,c(H2SO4)减小,B不正确;充电时阳极发生氧化反应,电极反应式为PbSO4-2e-+2H2O===PbO2+SO42-+4H+,C不正确;充电时,若N连电源正极,则该极为阳极,电极反应产物为PbO2,D正确。 答案:D 4.目前科学家已开发出一种新型燃料电池——固体氧化物电池,该电池用辛烷(C8H18)作燃料,电池中间部分的固体氧化物陶瓷可传递氧离子,下列说法正确的是( ) A.电池工作时,氧气发生氧化反应 B.电池负极的电极反应:O2+2H2O+4e-===4OH- C.电池负极的电极反应:C8H18+25O2--50e-===8CO2↑+9H2O D.若消耗的O2为11.2 L(标准状况),则电池中有1 mol电子发生转移 解析:该电池工作时,正极上氧气得电子发生还原反应,A项错误;负极上燃料辛烷失电子发生氧化反应,电极反应式为C8H18+25O2--50e-===8CO2↑+9H2O,B项错误,C项正确;标准状况下11.2 L氧气的物质的量为0.5 mol,根据O2+4e-===2O2-,当消耗0.5 mol氧气转移电子的物质的量为氧气的4倍,所以转移电子的物质的量为2 mol,D项错误。 答案:C 5.乙醇燃料电池中采用磺酸类质子溶剂,在200 ℃左右时供电,电池总反应式为C2H5OH+3O2===2CO2+3H2O,电池示意图如图所示,下列说法中正确的是( ) 10 A.电池工作时,质子向电池的负极迁移 B.电池工作时,电流由b极沿导线流向a极 C.a极上发生的电极反应是C2H5OH+3H2O+12e-===2CO2↑+12H+ D.b极上发生的电极反应是2H2O+O2+4e-===4OH- 解析:通入乙醇的一极(a极)为负极,发生氧化反应;通入氧气的一极(b极)为正极,发生还原反应,电池工作时,阳离子(质子)向电池的正极迁移,A项不正确;电流方向与电子流向相反,电流由b极沿导线流向a极,B项正确;a极上乙醇应该失电子被氧化,C项不正确;因为电池中使用的是磺酸类质子溶剂,所以电极反应式中不能出现OH-,D项不正确。 答案:B 6.熔融碳酸盐燃料电池是一种高温电池(600~700℃),具有效率高、噪音低、无污染、燃料多样、余热利用价值高等优点。氢氧熔融碳酸盐燃料电池的工作原理如图所示。下列有关该电池的说法正确的是( ) A.电池工作时,熔融碳酸盐只起到导电的作用 B.负极反应式为H2-2e-+CO32-===CO2+H2O C.该电池可利用工厂中排出的CO2,减少温室气体的排放 D.电池工作时,外电路中流过0.2 mol电子,消耗3.2 g O2 10 解析:根据图示,在氢氧熔融碳酸盐燃料电池中,通入氢气的电极为负极,负极发生氧化反应,电极反应式为H2-2e-+CO32-===CO2+H2O,通入氧气的电极为正极,正极发生还原反应,电极反应式为O2+2CO2+4e-===2CO32-,总反应为:2H2+O2===2H2O。A. 根据上述分析,电池工作时,熔融碳酸盐参与了电极反应,故A错误;B. 负极发生氧化反应,电极反应式为H2-2e-+CO32-===CO2+H2O,故B正确;C.根据总反应,该电池工作时没有消耗二氧化碳,不能减少温室气体的排放,故C错误;D.电池工作时,外电路中流过0.2 mol电子,消耗0.05 mol氧气,质量为1.6 g O2,故D错误。 答案:B 7.(2019年四川省广安市期末)金属(M)-空气电池的工作原理如图所示,下列说法不正确的是( ) A.金属M作电池负极 B.M2+移向金属(M)电极 C.正极的电极反应为O2+4e-+2H2O===4OH- D.电池反应为2M+O2+2H2O===2M(OH)2 解析:M失去电子作负极,A正确;原电池中阳离子向正极移动,则M2+移向正极,金属(M)电极是负极,B错误;正极上氧气得到电子,则正极的电极反应O2+4e-+2H2O===4OH-,C正确;M失去电子、氧气得到电子,则电池反应为2M+O2+2H2O===2M(OH)2,D正确。 答案:B 8.(2019年四川省遂宁市期末)某原电池装置如图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是( ) 10 A.正极反应为AgCl+e-===Ag+Cl- B.负极反应为Ag-e-===Ag+ C.放电时,交换膜右侧溶液中有大量白色沉淀生成 D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 解析:A.该原电池正极的电极反应式是Cl2+2e-===2Cl-,故A错误;根据电池总反应为2Ag+Cl2===2AgCl 知负极电极反应式为Ag-e-+Cl-===AgCl,故B 错误;Ag+在左侧,所以在左侧生成白色沉淀,故C错误;参加电极反应的是Cl2和Ag,左侧溶液发生的电极反应式是:Ag-e-+Cl-===AgCl,当电路中转移0.01 mol电子时,Cl-减少0.01 mol,同时有0.01 mol的H+移向右侧,故离子共减少0.02 mol,故D正确。 答案:D 9.(1)美国“阿波罗”宇宙飞船中使用的氢氧燃料电池,其构造如图所示: KOH作电解质,其反应为:2H2+O2===2H2O, 则负极通入的是________,电极反应式为:____________________________; 正极通入的是________,电极反应式为:____________________________。 (2)如果KOH改为稀H2SO4作电解质,则电极反应式为:负极________,正极________。 (3)如把H2改为CH4,KOH作电解质,则电极反应式为:负极________,正极________。 10 解析:根据原电池的原理,负极发生氧化反应,电子流出;正极发生还原反应,电子流入;燃料电池的燃料为负极,氧化剂为正极。 (1)KOH作电解质,则负极通入的是H2,因为电解质溶液显碱性,所以氢气失去电子变成H+后将与OH-结合生成水,电极反应为2H2+4OH--4e-===4H2O。正极通入的是O2,氧气得到电子变成O2-后将与H2O结合生成OH-,电极反应为O2+2H2O+4e-===4OH-。 (2)稀H2SO4作电解质时,溶液显酸性,所以氧气得到电子变成O2-后将与H+结合生成水,正极反应为O2+4H++4e-===2H2O,负极反应为2H2-4e-===4H+。 (3)把H2改为CH4,KOH作电解质,则负极通入的是CH4,因为电解质溶液显碱性,所以甲烷失去电子后将与OH-反应生成水和CO32-,利用反应前后电荷守恒,配平负极反应为CH4+10OH--8e-===CO32-+7H2O。 答案:(1)H2 2H2+4OH--4e-===4H2O O2 O2+2H2O+4e-===4OH- (2)2H2-4e-===4H+ O2+4H++4e-===2H2O (3)CH4+10OH--8e-===CO32-+7H2O 2O2+4H2O+8e-===8OH- 提高训练 10.(2019年云南省红河州高三检测)某电池以Na2FeO4和Zn为电极材料,NaOH溶液为电解质溶液,下列说法正确的是( ) A.该电池放电过程中电解质溶液浓度减小 B.正极反应式为2FeO42-+10H++6e-===Fe2O3+5H2O C.电池工作时OH-向负极迁移 D.Zn为电池的正极 解析:该电池总方程式为3Zn+2Na2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4NaOH,生成NaOH,则该电池放电过程中电解质溶液浓度增大,故A错误;因电解质溶液为NaOH,呈碱性,则正极电极方程式为2FeO42-+6e-+8H2O===2Fe(OH)3+10OH-,故B错误;原电池在工作时阴离子OH-向负极迁移,故C正确;根据化合价升降判断,Zn化合价只能上升,则为负极材料,故D错误。 答案:C 11.查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中, 10 理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为CH3CH2OH-2e-===X+2H+。下列说法中正确的是( ) A.电池内部H+由正极向负极移动 B.另一极的电极反应式为O2+4e-+2H2O===4OH- C.乙醇在正极发生反应,电子经过外电路流向负极 D.电池总反应式为2CH3CH2OH+O2===2CH3CHO+2H2O 解析:根据原电池工作原理、反应规律及质量守恒等,可以确定乙醇作原电池的负极,正极反应式为O2+4H++4e-===2H2O,物质X的分子式为C2H4O,是乙醇被氧化的产物,为CH3CHO,则电池的总反应式为2CH3CH2OH+O2===2CH3CHO+2H2O;工作过程中负极产生H+,正极消耗H+,所以,H+应由负极向正极移动;外电路中的电子应由负极流出,正极流入。 答案:D 12.(2019年辽宁省沈阳市实验中学期中)图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是新型氢氧燃料电池,则下列说法中不正确的是( ) A.图2电池放电过程中,O2-从B极区向A极区迁移 B.图2电池负极区的电极反应为H2-2e-+O2-===H2O C.若用氯化钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则铅笔芯C点先变红后褪色 D.图1的铅笔为正极 解析:图2是氢氧燃料电池,燃料电池放电过程中,通燃料气体的A极是负极,通氧气的B极是正极,O2-从正极区(B)向负极区(A)迁移,故A正确;图2是氢氧燃料电池,燃料电池放电规律是:通燃料气体的A极为负极,燃料在该极失电子,通氧气的B极是正极,氧气在该极得电子,所以负极区的电极反应为H2-2e-+O2-===H2O,故B正确;若用氯化钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则锌电极为负极,锌失电子, 10 铅笔芯为正极,水电离的氢离子得电子,在该极生成大量的氢氧化钠,能使酚酞变红色,故C错误;用导线将a、b直接相连,则锌电极为负极,锌失电子,铅笔芯为正极,氧气得电子,故D正确。 答案:C 13. (2019年河南省联考)一种碱性“二甲醚(CH3OCH3)燃料电池”具有启动快、能量密度高、效率高等优点,其电池总反应为:CH3OCH3+3O2+4OH-===2CO32-+5H2O,下列说法不正确的是( ) A.电池正极可用多孔碳材料制成 B.电池负极发生的反应为:CH3OCH3-12e-+3H2O===2CO32-+12H+ C.理论上,1 mol二甲醚放电量是1 mol甲醇放电量的2倍 D.电池工作时,OH-向电池负极迁移 解析:多孔碳是碳单质,是一种具有不同孔结构的碳素材料,可用作氢氧燃料电池的电极材料,选项A正确;根据电池总反应式可知电解质溶液呈碱性,负极电极反应为CH3OCH3-12e-+12OH-===2CO32-+6H2O,选项B不正确;每1 mol的二甲醚(CH3OCH3)燃烧会转移电子的物质的量为12mol;1mol的甲醇反应会转移电子6 mol,故做为燃料电池理论上,1 mol二甲醚放电量是1 mol甲醇放电量的2倍,选项C正确;电池工作时,阴离子向电池的负极迁移,即OH-向电池负极迁移,选项D正确。 答案:B 14.Ⅰ.Li—SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2,电池的总反应可表示为4Li+2SOCl2===4LiCl+S+SO2。 (1)电池正极发生的电极反应为__________________________。 (2)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是___________________,反应的化学方程式为___________________。 Ⅱ.熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。 (3)该燃料电池负极电极反应式为_______________________。 (4)该燃料电池正极电极反应式为________________________。 解析:(1)原电池的负极发生氧化反应,电极反应式为4Li-4e-+4Cl-===4LiCl,则正极的电极反应式用总反应方程式减去负极反应得2SOCl2+4e-===4Cl-+S+SO2。(2)用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成,说明反应过程中S元素的化合价仍是+4价, 10 未发生氧化还原反应,所以SOCl2与水反应的产物是二氧化硫与氯化氢,氯化氢与水结合形成白雾,则实验现象是出现白雾,有刺激性气味气体生成;化学方程式为SOCl2+H2O===SO2↑+2HCl↑。(3)燃料电池的负极发生氧化反应,所以丁烷在负极发生氧化反应,失去电子,因为熔融的K2CO3为电解质,所以生成二氧化碳和水,电极反应式为C4H10+13CO32--26e-===17CO2+5H2O。(4)正极是氧气发生还原反应,并与二氧化碳结合生成碳酸根离子,电极反应式为O2+2CO2+4e-===2CO32-。 答案:(1)2SOCl2+4e-===4Cl-+S+SO2 (2)出现白雾,有刺激性气体生成 SOCl2+H2O===SO2↑+2HCl↑ (3)C4H10+13CO32--26e-===17CO2+5H2O (4)O2+2CO2+4e-===2CO32- 15.航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置,它可直接将化学能转化为电能,我国发射的“神舟”五号载人飞船是采用先进的甲烷电池为电能来源的,该电池以KOH溶液为电解质,其总反应的化学方程式为:CH4+2O2+2OH-===CO32-+3H2O。 (1)负极上的电极反应为______________________。 (2)消耗标准状况下的5.6 L O2时,有________mol电子发生转移。 (3)开始放电时,正极附近溶液的pH________(填“增大”“减小”或“不变”)。 解析:(1)根据总的化学方程式知CH4~CO32-,C元素的化合价由-4→+4,则有CH4-8e-→CO32-,根据电荷守恒,左边应配10个OH-,最后根据质量守恒得:CH4+10OH--8e-===CO32-+7H2O;(2)正极反应为:2O2+4H2O+8e-===8OH-,5.6 L O2的物质的量为0.25 mol,故得电子的物质的量为0.25 mol×4=1 mol;(3)由于正极生成OH-,故其附近的pH增大。 答案:(1)CH4+10OH--8e-===CO32-+7H2O (2)1 (3)增大 探究创新 16.镉镍可充电电池在现代生活中有着广泛的应用,它的充、放电反应如下: Cd+2NiOOH+2H2OCd(OH)2+2Ni(OH)2 请回答下列问题: 10 (1)以下说法正确的是( ) ①以上反应是可逆反应 ②以上反应是不可逆反应 ③放电时镍元素化合价升高 ④放电时化学能转变为电能 A.①③ B.②④ C.①④ D.②③ (2)上述反应式中左边物质的总能量________(填“大于”“小于”或“等于)右边物质的总能量。 (3)放电时负极发生反应的物质是________,正极的电极反应式为____________________________。 (4)镉镍废旧电池必须进行回收并集中处理,最主要的原因是______________________________________________________。 解析:(1)放电和充电是不同条件,该反应为不可逆反应;放电时,镍元素化合价降低;放电时化学能转化为电能,故B项正确。 (2)原电池放电时对外释放能量,故反应物的总能量大于生成物的总能量。 (3)分析元素化合价的变化,可知该电池放电时Cd失电子,作电池负极,NiOOH得到电子,作正极,电极反应式为NiOOH+H2O+e-===Ni(OH)2+OH-。 (4)镉镍废旧电池中残留Cd2+、Ni2+等重金属离子,易对土壤和水源造成污染。 答案:(1)B (2)大于 (3)Cd NiOOH+H2O+e-===Ni(OH)2+OH- (4)防止废旧电池中残留的镍、镉离子污染土壤和水源 10 11查看更多