- 2021-05-08 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年高中化学课时作业5元素分析与相对分子质量的测定及分子结构的鉴定含解析 人教版选修5
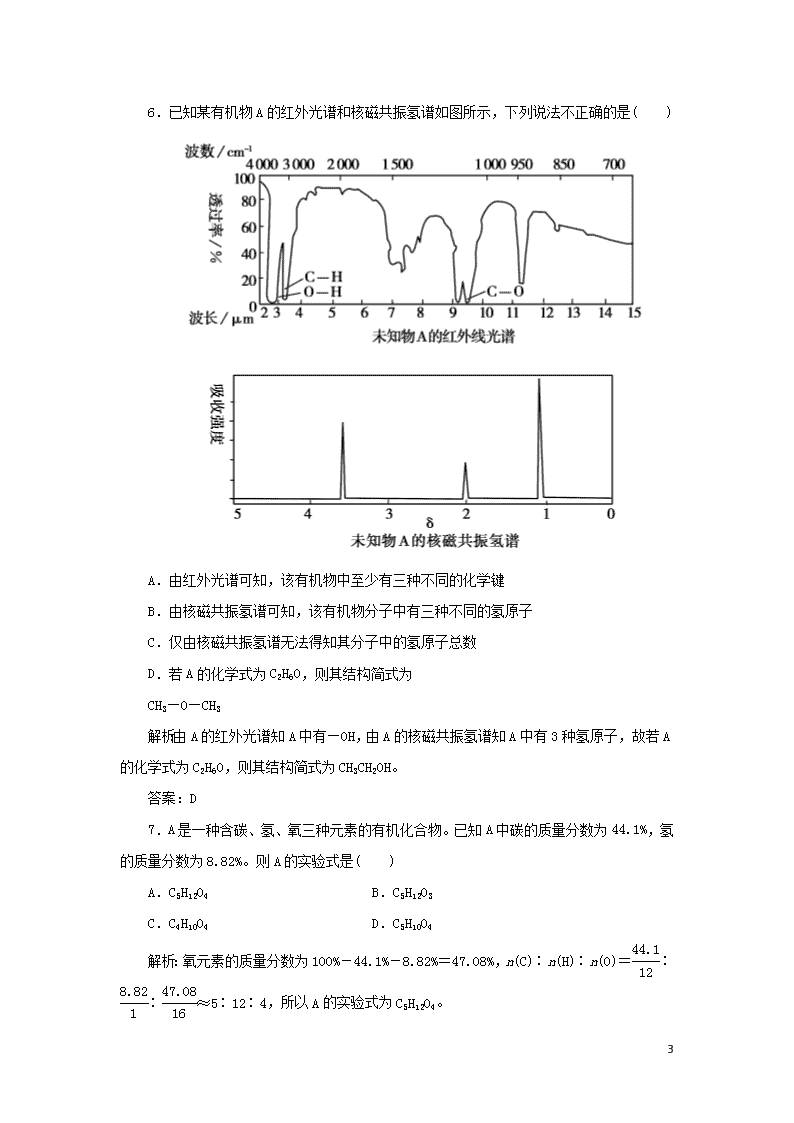
课时作业5 元素分析与相对分子质量的测定及分子结构的鉴定 基础巩固 1.在核磁共振氢谱中出现两个峰,其氢原子数之比为3∶1的化合物是( ) 解析:在核磁共振氢谱中出现两个峰,其氢原子数之比为3∶1,这说明分子中含有2类氢原子,又因为同一个碳原子上的氢原子是相同的,其次同一个碳原子所连接的所有甲基上的氢原子是相同的,再就是具有对称性结构的(类似于平面镜成像中物体和像的关系)。A.分子中含有2类氢原子,其氢原子数之比为3∶1,A正确;B.分子中含有3类氢原子,其氢原子数之比为3∶1∶1,B错误;C.分子中含有3类氢原子,其氢原子数之比为3∶1∶4,C错误;D.分子中含有2类氢原子,其氢原子数之比为3∶2,D错误。 答案:A 2.在核磁共振氢谱中出现三组峰的化合物是( ) 解析:A.高度对称,苯环上的四个氢等效,二个甲基上的六个氢也等效,只有两组峰,峰面积之比为6∶4=3∶2,选项A不符合;B.两个甲基上的氢等效,只有两组峰,且峰面积之比为6∶2=3∶1,选项B不符合;C.两个甲基上的氢等效,甲基取代位上的氢等效,另外六元环上的四个碳上共八个氢也等效,有三组峰,峰面积之比为6∶2∶8=3∶1∶4,选项C符合;D.高度对称,苯环上的四个氢等效,两个甲基上的六个氢也等效, 11 只有两组峰,峰面积之比为6∶4=3∶2,选项D不符合。 答案:C 3.利用红外光谱对有机化合物分子进行测试并记录,可以初步判断该有机物的分子拥有的( ) A.同分异构体数 B.原子个数 C.基团种类 D.共价键种类 解析:红外光谱可确定基团种类 答案:C 4.下列物质的核磁共振氢谱图中,有5个吸收峰的是( ) 解析:有几个吸收峰说明有几种不同化学环境的氢原子。A项,分子中有2种氢原子;B项,分子中有5种氢原子;C项,分子中有4种氢原子;D项,分子中有4种氢原子。 答案:B 5.燃烧0.1 mol某有机物得0.2 mol CO2和0.3 mol H2O,由此得出的结论不正确的是( ) A.该有机物分子的结构简式为CH3—CH3 B.该有机物中碳、氢元素原子数目之比为1∶3 C.该有机物分子中不可能含有双键 D.该有机物分子中可能含有氧原子 解析:n(有机物)∶n(CO2)∶n(H2O)=0.1 mol∶0.2 mol∶0.3 mol=1∶2∶3,所以n(有机物)∶n(C)∶n(H)=1∶2∶6,故有机物的分子式为C2H6Ox。 答案:A 11 6.已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法不正确的是( ) A.由红外光谱可知,该有机物中至少有三种不同的化学键 B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子 C.仅由核磁共振氢谱无法得知其分子中的氢原子总数 D.若A的化学式为C2H6O,则其结构简式为 CH3—O—CH3 解析:由A的红外光谱知A中有—OH,由A的核磁共振氢谱知A中有3种氢原子,故若A的化学式为C2H6O,则其结构简式为CH3CH2OH。 答案:D 7.A是一种含碳、氢、氧三种元素的有机化合物。已知A中碳的质量分数为44.1%,氢的质量分数为8.82%。则A的实验式是( ) A.C5H12O4 B.C5H12O3 C.C4H10O4 D.C5H10O4 解析:氧元素的质量分数为100%-44.1%-8.82%=47.08%,n(C)∶n(H)∶n(O)=∶∶≈5∶12∶4,所以A的实验式为C5H12O4。 11 答案:A 能力提升 8.已知某有机物A的核磁共振氢谱如下图所示,下列说法中,错误的是( ) A.若A的分子式为C3H6O2,则其结构简式为 CH3COOCH3 B.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子,且个数之比为1∶2∶3 C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数 D.若A的化学式为C3H6O2,则其同分异构体有三种 解析:由核磁共振氢谱可知,其分子中含有三种不同化学环境的氢原子,峰的面积之比等于其原子个数之比,但不能确定具体个数,故B、C正确;由A的分子式C3H6O2可知,其同分异构体有6种:CH3COOCH3、CH3CH2COOH、 HCOOCH2CH3、和其中有三种不同化学环境的氢原子且个数之比为1∶2∶3的有机物的结构简式为CH3CH2COOH、或HCOOCH2CH3。 答案:A 9.某有机化合物3.2克在氧气中充分燃烧, 11 将生成物依次通入盛有浓硫酸的洗气瓶和盛有碱石灰的干燥管,实验测得装有浓硫酸的洗气瓶增重3.6克,盛有碱石灰的干燥管增重4.4克。则下列判断正确的是( ) A.肯定含有碳、氢、氧三种元素 B.肯定含有碳、氢元素,可能含有氧元素 C.肯定含有碳、氢元素,不含氧元素 D.不可能同时含有碳、氢、氧三种元素 解析:本题考查有机物化学式确定的有关计算。3.2 g该有机物在氧气中燃烧后生成的产物依次通过浓硫酸和碱石灰,分别增重3.6 g和4.4 g,生成水的质量是3.6 g,所以氢原子的物质的量是0.4 mol,生成的二氧化碳的质量是4.4 g,碳原子的物质的量是0.1 mol,由质量守恒,有机物中含有氧的质量为3.2-0.1×12-0.4×1=1.6 g,物质的量为=0.1 mol,故该有机物肯定含碳、氢、氧元素。 答案:A 10.下列化合物的核磁共振氢谱中出现三组峰的是( ) A.2,2,3,3-四甲基丁烷 B.2,3,4-三甲基戊烷 C.3,4-二甲基己烷 D.2,5-二甲基己烷 解析:解题时应先把有机物的名称改写成结构简式,再根据结构简式确定核磁共振氢谱中出现几组吸收峰。A的结构简式为(CH3)3CC(CH3)3,核磁共振氢谱中出现一组峰;B的结构简式为(CH3)2CHCH(CH3)CH(CH3)2,核磁共振氢谱中出现四组峰;C的结构简式为CH3CH2CH(CH3)CH(CH3)CH2CH3,核磁共振氢谱中出现四组峰;D的结构简式为(CH3)2CHCH2CH2CH(CH3)2,核磁共振氢谱中出现三组峰。 答案:D 11.E(C5H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为。核磁共振法能够区分这两种结构。在核磁共振氢谱中,错误的结构与正确的结构核磁共振氢谱的峰的数目分别为( ) 11 A.5,5 B.3,5 C.5,1 D.3,1 解析:错误结构中有3种化学环境的氢原子,而正确结构中只有1种化学环境的氢原子。 答案:D 12.A、B两种有机化合物,当混合物总质量一定时,无论A、B以何种比例混合,完全燃烧时产生的水的量均相等,肯定符合上述条件的A、B是( ) ①同分异构体 ②具有相同的最简式 ③乳酸与聚乳酸 ④含氢的质量分数相同 ⑤苯乙烯和聚苯乙烯 ⑥葡萄糖与淀粉 ⑦甲苯与甘油 A.①②③④ B.①②④⑤ C.①②③④⑤⑦ D.①②④⑤⑦ 解析:由两种有机物组成的混合物,无论以何种比例混合,混合物的总质量一定,完全燃烧时产生的水的量均相等,则说明两种有机物分子中氢元素的质量分数相等。①互为同分异构体,分子式相同,两种有机物分子中氢元素的质量分数相等,故①符合;②最简式相同,两种有机物分子中氢元素的质量分数相等,故②符合;③乳酸与聚乳酸中氢元素质量分数不同,故③不符合;④有机物满足含氢的质量分数相同,故④符合;⑤苯乙烯和聚苯乙烯的最简式相同,两种有机物分子中氢元素的质量分数相等,故⑤符合;⑥葡萄糖与淀粉中氢元素质量分数不同,故⑥不符合;⑦甲苯与甘油分子中H原子数目均为8,二者相对分子质量相等,两种有机物分子中氢元素的质量分数相等,故⑦符合,故选D。 答案:D 13.常温下,10 mL某烃A和80 mL氧气(过量)混合,点燃,使其充分燃烧后恢复到原状况,残留气体体积为65 mL。 (1)若A为烷烃,则A的分子式为_________________________。 (2)若A为烯烃,则A的分子式为_________________________。 (3)若A为炔烃,则A的分子式为_________________________。 解析:CxHy(g)+O2(g)xCO2(g)+H2O(l) ΔV 1 x+ x 1+ 10 mL 80 mL 25 mL 则=,解得y=6。 11 (1)若A为烷烃,分子式为C2H6; (2)若A为烯烃,分子式为C3H6; (3)若A为炔烃,分子式为C4H6。 答案:(1)C2H6 (2)C3H6 (3)C4H6 14.肉桂酸甲酯(代号M)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。用质谱法测得其相对分子质量为162,分子中C、H、O原子个数比为5∶5∶1,且分子中只含有1个苯环,苯环上只有一个取代基。现测出M的核磁共振氢谱谱图有6个峰,其面积之比为1∶2∶2∶1∶1∶3。利用红外光谱仪可初步检测有机化合物中的某些基团,现测得M分子的红外光谱如下图: 根据以上信息确定肉桂酸甲酯的分子式为__________________, 结构简式为______________。 解析:设M的分子式为(C5H5O)n,其相对分子质量为162,则n=162÷(12×5+1×5+16)=2,所以M的分子式为:C10H10O2,该分子中只含有1个苯环,苯环上只有一个取代基,M的核磁共振氢谱谱图有6个峰,说明含有6种氢原子,其面积之比为1∶2∶2∶1∶1∶3,峰面积之比等于氢原子个数之比,根据红外光谱可知结构简式应为。 答案:C10H10O2 15.为了测定某有机物A的结构,做如下实验: 11 ①将2.3 g该有机物完全燃烧,生成0.1 mol CO2和 2.7 g水; ②用质谱仪测定其相对分子质量,得如图1所示的质谱图; ③用核磁共振仪处理该化合物,得到如图2所示图谱,图中三个峰的面积之比是1∶2∶3。试回答下列问题: (1)有机物A的相对分子质量是___________________________。 (2)有机物A的实验式是______________________________。 (3)A的分子式是________________________________________。 (4)A的结构简式为_____________________________________。 解析:(1)在A的质谱图中,最大质荷比为46,所以其相对分子质量也是46。 (2)在2.3 g该有机物中,n(C)=0.1 mol m(C)=0.1 mol×12 g·mol-1=1.2 g n(H)=×2=0.3 mol m(H)=0.3 mol×1 g·mol-1=0.3 g m(O)=2.3 g-1.2 g-0.3 g=0.8 g n(O)==0.05 mol n(C)∶n(H)∶n(O)=0.1 mol∶0.3 mol∶0.05 mol =2∶6∶1, 11 所以A的实验式是C2H6O。 (3)该有机物实验式C2H6O的式量是46,故其实验式即为分子式。 (4)由A的核磁共振氢谱知A中有3种氢原子,个数比为1∶2∶3,所以A的结构简式为CH3CH2OH。 答案:(1)46 (2)C2H6O (3)C2H6O (4)CH3CH2OH 16.青蒿素是一种有效的抗疟药。常温下,青蒿素为无色针状晶体,难溶于水,易溶于有机溶剂,熔点为156~157℃。提取青蒿素的方法之一是乙醚浸取法,提取流程如下: 请回答下列问题: (1)对青蒿进行破碎的目的是____________________________。 (2)操作I用到的玻璃仪器是________,操作Ⅱ的名称是_______。 (3)用下列实验装置测定青蒿素的化学式,将28.2 g青蒿素放在燃烧管C中充分燃烧: ①仪器各接口的连接顺序从左到右依次为________(每个装置限用一次);A装置中发生的化学反应方程式为________________。 ②装置C中CuO的作用是________________。 ③装置D中的试剂为________________。 11 ④已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验.测量数据如下表: 装置质量 实验前/g 实验后/g B 22.6 42.4 E(不含干燥管) 80.2 146.2 则青蒿素的最简式为____________________。 (4)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解度较小,加热并搅拌,青蒿素的溶解度增大,且溶液红色变浅,与青蒿素化学性质相似的物质是________(填字母代号)。 A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖 解析:本题主要考查物质的分离方法。 (1)对青蒿进行破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率。 (2)操作I是过滤,用到的玻璃仪器是漏斗、玻璃棒、烧杯,操作Ⅱ将乙醚溶液中的乙醚分离出来,其名称是蒸馏。 (3)① 装置A产生的氧气需要经过装置D干燥,纯净的氧气进入装置C,产生的水蒸气被装置B吸收,二氧化碳被装置E吸收,仪器各接口的连接顺序从左到右依次为afgdebchi;A装置中发生反应的化学方程式为2H2O22H2O+O2↑。② 装置C中CuO的作用是使青蒿素充分氧化生成CO2和H2O。 ③ 装置D中的试剂为浓硫酸。 ④B吸收水19.8 g,其中含氢2.2 mol即2.2 g,E吸收二氧化碳66 g,其中含碳1.5 mol即18 g,28.2 g青蒿素含氧8 g即0.5 mol,则青蒿素的最简式为C15H22O5。 (4)在含有NaOH、酚酞的水溶液中,乙酸乙酯水解,生成物乙酸与氢氧化钠反应使溶液红色变浅,所以与青蒿素化学性质相似的物质是乙酸乙酯,故选C。 答案:(1)增大青蒿与乙醚的接触面积,提高青蒿素的浸取率 (2) 漏斗、玻璃棒、烧杯 蒸馏 (3) ①afgdebchi 2H2O22H2O+O2↑ ②使青蒿素充分氧化生成CO2和H2O ③浓硫酸 11 ④C15H22O5 (4)C 11查看更多