- 2021-05-10 发布 |
- 37.5 KB |
- 30页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学一轮复习学案课件(人教版):第3章 金属及其化合物第2节 铝及其重要化合物
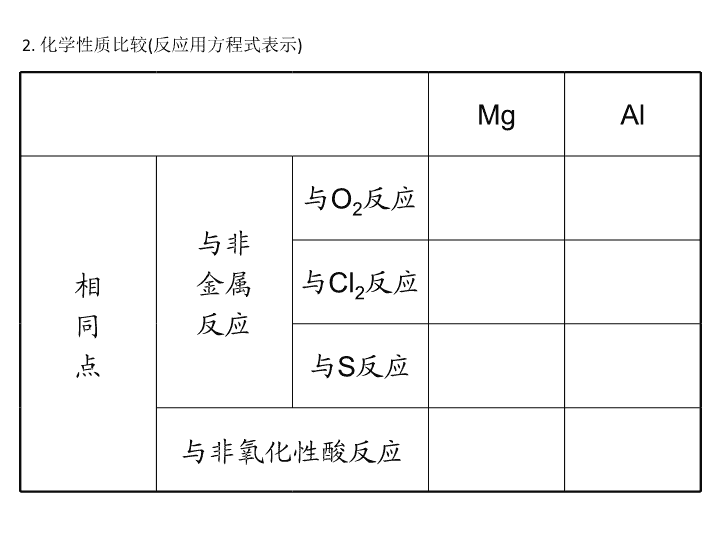
第二节 铝及其重要化合物 一、镁、铝的重要性质 1. 物理性质比较 镁和铝都是______色有______光泽的金属,质地都______,密度都______,都属于轻 金属。 熔沸点:Mg____Al;硬度:Mg____Al;密度:Mg____Al。 2. 化学性质比较(反应用方程式表示) Mg Al 相 同 点 与非 金属 反应 与O2反应 与Cl2反应 与S反应 与非氧化性酸反应 不 同 点 与氧化物反应 与CO2反应: ______ 与Fe2O3反应: ____ 与水或强碱溶 液反应 镁与热水反应, 不与强碱反应: ___________ ___ 铝不与热水反 应,而与强碱 溶液反应: _________ 与浓硫酸、浓 硝酸反应 常温下,Mg剧 烈反应 常温下,铝发 生____,加热 时剧烈反应 3. 镁、铝的制备 工业制备均用电解法,化学方程式分别为__________________________、 __________________________。 一、1. 银白 金属 较软 较小 < < < 2. 2Mg+O2==2MgO 4Al+3O2==2Al2O3 Mg+Cl2==MgCl2 2Al+3Cl2==2AlCl3 Mg+S==MgS 答案: 2Al+3S===Al2S3 Mg+2H+===Mg2++H2↑ 2Al+6H+===2Al3++3H2↑ 2Mg+CO2===2MgO+C 2Al+Fe2O3===Al2O3+2Fe Mg+2H2O===Mg(OH)2+H2↑ 2Al+2OH-+2H2O===2AlO2-+3H2↑ 钝化 3. MgCl2(熔融)===Mg+Cl2↑ 2Al2O3(熔融)===4Al+3O2↑ 答案: 二、铝的重要化合物 1. 氧化铝 (1)化学性质(两性氧化物) ①与盐酸反应的离子方程式:______________________。 ②与氢氧化钠溶液反应的离子方程式: ________________________________________________________________________。 (2)用途:①氧化铝是冶炼铝的原料,化学方程式为______________________; ②氧化铝是较好的耐火材料,可用于制造__________、________和耐高温的________ 等。 2. 氢氧化铝 (1)两性氢氧化物:电离方程式为______________________。 ①与盐酸反应的离子方程式:______________________。 ②与氢氧化钠溶液反应的离子方程式: ________________________________________________________________________。 (2)受热分解:化学方程式为______________________。 3. 明矾 化学式为______________________,其水解生成Al(OH)3胶体,故可作________。 二、1. (1)①Al2O3+6H+===2Al3++3H2O ②Al2O3+2OH-===2AlO2-+H2O (2)①2Al2O3(熔融)===4Al+3O2↑ ②耐火坩埚 耐火管 实验仪器 2. (1)AlO2-+H++H2O Al(OH)3 Al3++3OH- ①Al(OH)3+3H+===Al3+ +3H2O ②Al(OH)3+OH-===AlO2-+2H2O (2)2Al(OH)3===Al2O3+3H2O 3. KAl(SO4)2·12H2O 净水剂 答案: 铝的性质 【例1】 (2009高考·上海卷,15)镁和铝分别与等浓度、等体积的过量稀硫酸反应, 产生气体的体积(V)与时间(t)关系如下图。反应中镁和铝的( ) A. 物质的量之比为3∶ 2 B. B. 质量之比为3∶ 2 C. C. 摩尔质量之比为2∶ 3 D. D. 反应速率之比为2∶ 3 【自主解答】 A 解析:由关系式:Mg~H2,2Al~3H2,可知产生等量H2时,消耗Mg、Al物质的量之 比为3∶ 2,故A正确。二者质量之比为4∶ 3,摩尔质量之比为8∶ 9,反应速率之比为 3∶ 2。 铝分别与盐酸、氢氧化钠溶液反应的原理 2Al+6HCl===2AlCl3+3H2↑ 2Al+2NaOH+2H2O===2NaAlO2+3H2↑ 1. 等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气的体积比=1∶ 1 2. 足量的铝分别与等物质的量的盐酸和氢氧化钠反应,产生氢气的体积比为=1∶ 3 3. 一定量的铝分别和一定量的盐酸和氢氧化钠反应,若产生氢气的体积比为(1/3,1) 则必定是: (1)铝与盐酸反应时,铝过量而盐酸不足。 (2)铝与氢氧化钠反应时,铝不足而氢氧化钠过量。 1. 向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体 b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全, 得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则 下列关系不正确的是( ) A. c=1000b/11.2V B. p=m+Vc/125 C. n=m+17 Vc D. 5m/3查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档