- 2021-05-10 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学复习专题常见气体的制备与收集
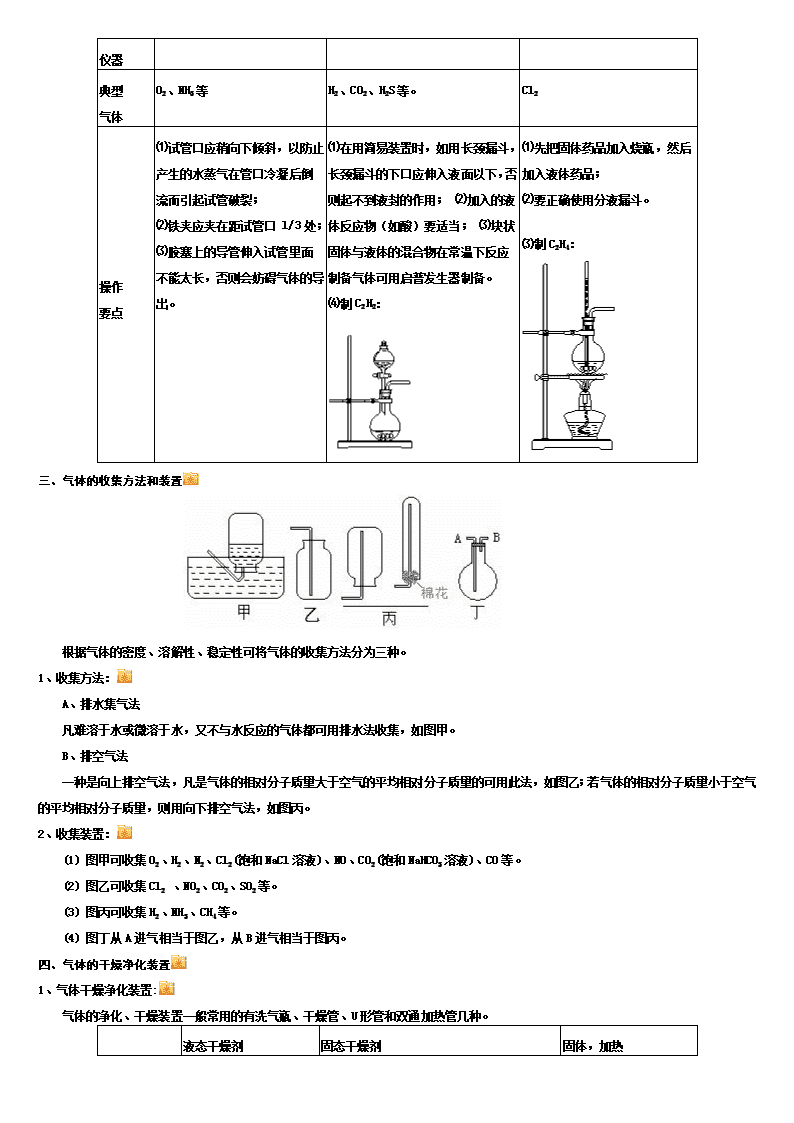
常见气体的制备与收集 一、几种气体制备的反应原理 二.气体发生装置的类型 1.设计原则: 根据反应原理、反应物状态和反应所需条件等因素来选择反应装置。 2.装置基本类型: 装置 类型 固体反应物(加热) 固液反应物(不加热) 固液反应物(加热) 装置 示意图 酒精灯、试管 启普发生器 酒精灯、烧瓶、分液漏斗 主要 仪器 典型 气体 O2、NH3等 H2、CO2、H2S等。 Cl2 操作 要点 ⑴试管口应稍向下倾斜,以防止产生的水蒸气在管口冷凝后倒流而引起试管破裂; ⑵铁夹应夹在距试管口 l/3处; ⑶胶塞上的导管伸入试管里面不能太长,否则会妨碍气体的导出。 ⑴在用简易装置时,如用长颈漏斗,长颈漏斗的下口应伸入液面以下,否则起不到液封的作用; ⑵加入的液体反应物(如酸)要适当; ⑶块状固体与液体的混合物在常温下反应制备气体可用启普发生器制备。 ⑷制C2H2: ⑴先把固体药品加入烧瓶,然后加入液体药品; ⑵要正确使用分液漏斗。 ⑶制C2H4: 三、气体的收集方法和装置 根据气体的密度、溶解性、稳定性可将气体的收集方法分为三种。 1、收集方法: A、排水集气法 凡难溶于水或微溶于水,又不与水反应的气体都可用排水法收集,如图甲。 B、排空气法 一种是向上排空气法,凡是气体的相对分子质量大于空气的平均相对分子质量的可用此法,如图乙;若气体的相对分子质量小于空气的平均相对分子质量,则用向下排空气法,如图丙。 2、收集装置: (1) 图甲可收集O2、H2、N2、Cl2(饱和NaCl溶液)、NO、CO2(饱和NaHCO3溶液)、CO等。 (2) 图乙可收集Cl2 、NO2、CO2、SO2等。 (3) 图丙可收集H2、NH3、CH4等。 (4) 图丁从A进气相当于图乙,从B进气相当于图丙。 四、气体的干燥净化装置 1、气体干燥净化装置: 气体的净化、干燥装置一般常用的有洗气瓶、干燥管、U形管和双通加热管几种。 液态干燥剂 固态干燥剂 固体,加热 装置 常见 干燥剂 浓硫酸(酸性、 强氧化性) 无水氯化钙 (中性) 碱石灰 (碱性) 除杂试剂 Cu、CuO、Mg等 可干燥 的气体 H2、Cl2、O2、SO2、N2、CO2、CO、CH4 H2、Cl2、O2、SO2、N2、CO2、CO、CH4 H2、O2、N2、CO、CH4、NH3 可除去H2、O2、N2、 CO 不可干燥 的气体 HBr、NH3、HI NH3 Cl2、SO2、CO2、NO2等 (1)洗气瓶中一般装入液体除杂试剂。除杂试剂应通过化学反应将杂质吸收或将杂质气体转化为所制取的气体。常见除杂试剂有: ①强碱溶液:如NaOH溶液可吸收CO2、SO2、H2S、Cl2、NO2等呈酸性的气体。 ②饱和的酸式盐溶液,可将杂质气体吸收转化,如: 饱和NaHCO3溶液能除去CO2中混有的HCl、SO2等强酸性气体。 饱和NaHSO3溶液能除去SO2中混有的HCl、SO3等气体。 饱和NaHS溶液能除去H2S中混有的HCl气体。 ③浓H2SO4:利用它的吸水性,可除去H2、SO2、HCl、CO、NO2、CH4等气体中混有的水蒸气。但由于浓H2SO4有强氧化性,不能用来干燥具有强还原性气体,如H2S、HBr、HI等。 ④酸性KMnO4溶液:利用它的强氧化性,可以除去具有还原性的气体,如除去混在CO2气体中的SO2、H2S等。 (2)干燥管、U形管一般装入固体的干燥剂。常见的固体干燥剂有: ①酸性干燥剂,用来干燥酸性气体。如P2O5、硅胶等。 ②碱性干燥剂,用来干燥碱性气体。如CaO、碱石灰、固体NaOH等。 ③中性干燥剂,既能干燥碱性气体又能干燥酸性气体。如CaCl2(但CaCl2不能干燥NH3,因易形成CaCl2·8NH3氨合物)。 (3)双通加热管一般装入固体除杂剂,除杂试剂和混合气体中的某一组分反应。例如:Cu和混合气体中O2反应而将O2除去。 另外还常用固体的无水CuSO4装入干燥管中,通过颜色变化检验水蒸气的存在(但不能用CuSO4作干燥剂,因CuSO4吸水率低)。用Na2O2固体也可将CO2、H2O(气)转化为O2。 2、尾气处理装置: 尾气处理与净化、干燥的原理和装置是一样的。 (1) 图甲装置中若装NaOH可吸收Cl2、SO2、NO2、CO2等酸性气体。若装Na2SO3可吸收Cl2、SO2、NO2等。 (2) 图乙和图丙装置中若装碱石灰可吸收Cl2、SO2、NO2、CO2等酸性气体,同时他们还是一个双吸收装置,应用于制取易潮解的物质,如,制无水AlCl3时,正好可吸收多余的Cl2,反应结束后冷却过程中又可吸收回流的空气以防止潮解。 (3) 尾气处理还可以用下列装置: 甲 乙 丙 A. 甲装置吸收极易溶于水的气体如HCl、NH3等。 B. 乙装置吸收溶解度较小的气体如Cl2等。 C. 丙装置除去可燃的有毒气体如CO等。 D. 无需要吸收直接排放的气体有O2、N2、H2、CO2、CXHY,其中H2和CXHY必须排放到室外。 3、防倒吸完全装置: 4.测量气体的体积: 利用气体的不溶于某些液体的性质(如H2难溶于水,Cl2难溶于饱和食盐水)可用排液法粗略测量气体的体积。其多种量气装置见下图。 实验操作水平的高低决定了测量误差的大小。为减少量气误差,应注意: 装置(A),反应后应恢复到室温再读数,实验前集气瓶应充满水。气体体积即量筒中水的体积, 装置(B):读数时应上下移动乙管,使甲、乙两管液面相平。读取反应前后甲管中液面体积读数的差值即为气体体积. 装置(C):测量收集到气体体积,应先使气体冷却至室温,再慢慢将量筒下移,使量筒内外液面高度相同,再读取读数. 装置(D):实验中水面要没过漏斗颈,量筒中装满水,反应在漏斗中进行,生成 气体的体积即为量筒内气体的体积。 装置(E):用于测量混合气体中被吸收(或不被吸收)的体积分数.读数时球形容器和量气管液面相平,量气管内增加的水的体积等于不被反应管吸收的气体的体积. 五、气体制备实验的基本过程 1、气体制备实验一般分为以下六个环节: 制气 → 安全装置 → 除杂 → 干燥 → 反应 → 尾气处理 2、气体制备实验操作的一般步骤: (1) 组装(从上到下、从左到右) (2) 检验气密性 (3) 加入药品 (4) 排尽装置内的空气 (5) 验纯 (6) 性质实验或反应 (7) 拆除装置 【典型例题】 1.下列实验装置图正确的是B 2.下列各组气体在常温下能共存且能用向上排空气法收集的是D A.NO和O2 B.HCI和NH3 C.H2和CO D.SO2和CO2 3.实验室模拟合成氨和氨催化氧化的流程如下: 已知实验室可用饱和亚硝酸钠(NaNO2 )溶液与饱和氯化铵溶液经加热后反应制取氮气。 (1)从上图中选择制取气体的合适装置: 氮气___________、氢气___________。 (2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有___________、___________。 (3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,___________(填“会”或“不会”)发生倒吸,原因是:___________。 (4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:___________,锥形瓶中还可观察到的现象是:___________。 (5)写出乙装置中氨氧化的化学方程式:___________。 (6)反应结束后锥形瓶内的溶液中含有H+、OH-、___________、___________离子。 (B)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为: (1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于___________上(用以下所给仪器的编号填入,下同),取用坩埚应使用___________,灼烧后的坩埚应放在___________上,不能直接放在桌面上。 实验所用仪器:A.蒸发皿 B.石棉网 C.泥三角 D.表面皿 E.坩埚钳 F.试管夹 (2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是___________。 A.灼烧过程中部分氧化铜被还原 B.灼烧不充分铜未被完全氧化 C.氧化铜在加热过程中分解生成铜 D.该条件下铜无法被氧气氧化 (3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、___________、冷却结晶、_________、自然干燥。(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:___________、___________。 (5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行___________次。 (6)若测定结果x值偏高,可能的原因是___________。 a.加热温度过高 b.胆矾晶体的颗粒较大 c.加热后放在空气中冷却 d.胆矾晶体部分风化 分析与解答: (A)(1)由题给反应物的状态,NaNO2和NH4Cl都是饱和溶液,可推知N2用a装置,而H2是由锌粒(固)和稀酸(液)来制取,则可用b制取。 (2)干燥气体和调节(或控制)H2和N2的流速。 (3)不会,因合成氨的反应是一个可逆反应,生成的混合气体除NH3以外还有大量的N2和H2存在。 (4)从能使铂丝保持红热可以推知,氨的氧化反应是一个放热反应。根据氨氧化的产物看有NO生成,NO被O2氧化又产生NO2,所以锥形瓶中会看到有红棕色气体产生。 (5)乙装置中氨氧化的反应方程式为4NH3+5O2 4NO+6H2O。 (6)因氨氧化生成的NO与O2、H2O反应生成HNO3,未氧化的氨与HNO3反应生成NH4NO3。因此,反应结束后,锥形瓶内的溶液中除有H+、OH-外,还应有NH和NO。 (B)(1)因坩埚加热后温度较高,应放在泥三角上进行加热,且取用坩埚时要用坩埚钳,并且为防止坩埚炸裂和烧坏桌面,烧后的坩埚要在石棉网上冷却,不能直接放在桌面上。 (2)灼烧后含有少量铜其原因可能是灼热不充分,铜未被完全氧化,也可能是灼烧过程中部分氧化铜被还原。 (3)利用途径Ⅱ制取胆矾时,必须先加酸将氧化铜溶解,加热通氧气将Cu氧化,过滤除去粗制氧化铜中的不溶物杂质后,然后再蒸发溶剂,冷却结晶,再过滤得晶体,最后将其干燥,由此可写出答案。 (4)根据途径Ⅰ的反应方程式Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O和途径Ⅱ的反应方程式2Cu+O2+2H2SO4(稀) 2CuSO4+2H2O,可以看出途径Ⅱ的优点是:①产生等量的胆矾比途径Ⅰ耗硫酸少;②途径Ⅱ不产生污染大气的气体(SO2)。 (5)称量操作至少进行4次,分别是:①称量坩埚;②称量加入晶体后的坩埚;③称量加热冷却后的坩埚; ④称量再加热、再冷却后的坩埚至两次称量的值相差不超过0.1 g。 (6)若测定结果x值偏高,可能是加热温度过高使CuSO4晶体中的CuSO4分解了,其他三项均使x值偏低。 答案: (A)(1)a、b (2)干燥气体 控制氢气和氮气的流速 (3)不会 因为混合气体中含有大量难溶于水的氮、氢两种气体 (4)说明氨的氧化反应是一个放热反应 有红棕色气体产生 (5)4NH3+5O2 4NO+6H2O (6)NH NO (B)(1)C E B (2)A B (3)蒸发 过滤 (4)产生等量胆矾途径Ⅱ消耗硫酸少 途径Ⅱ不会产生污染大气的气体(5)4 (6)a查看更多