- 2021-02-26 发布 |
- 37.5 KB |
- 13页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学刷题冲刺含最新模拟题专题七碳硅及其化合物无机非金属材料讲义含解析
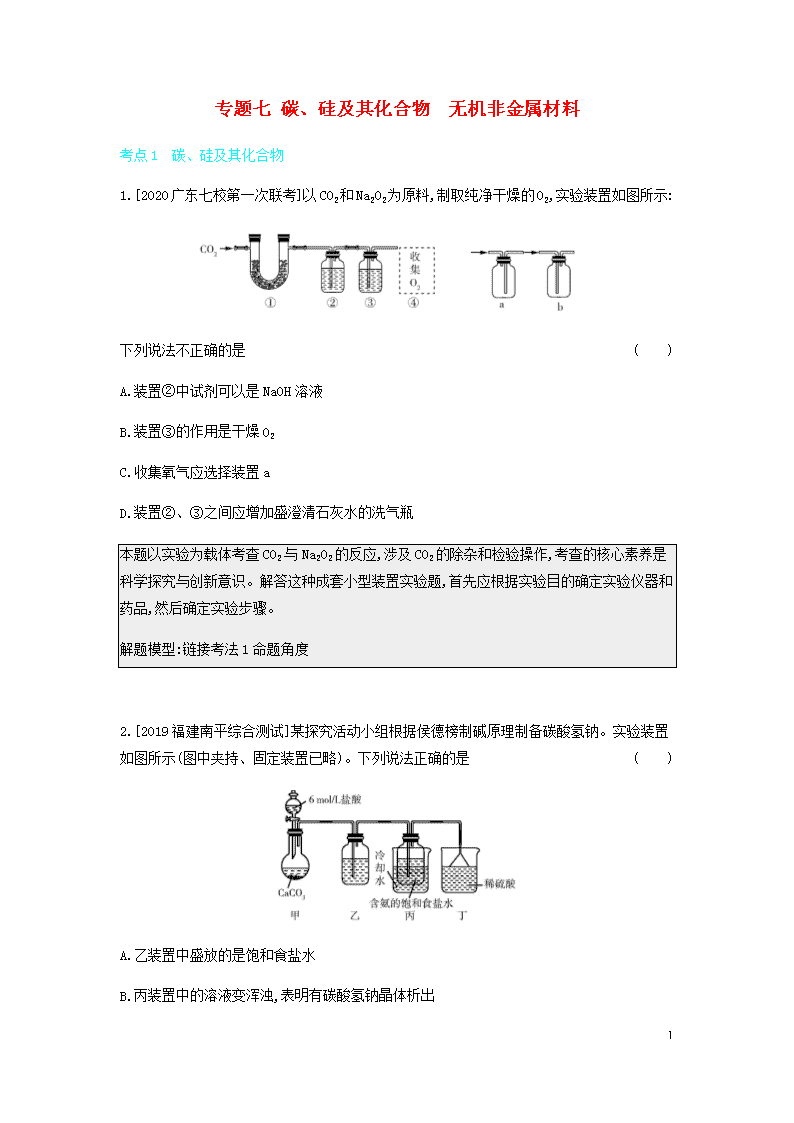
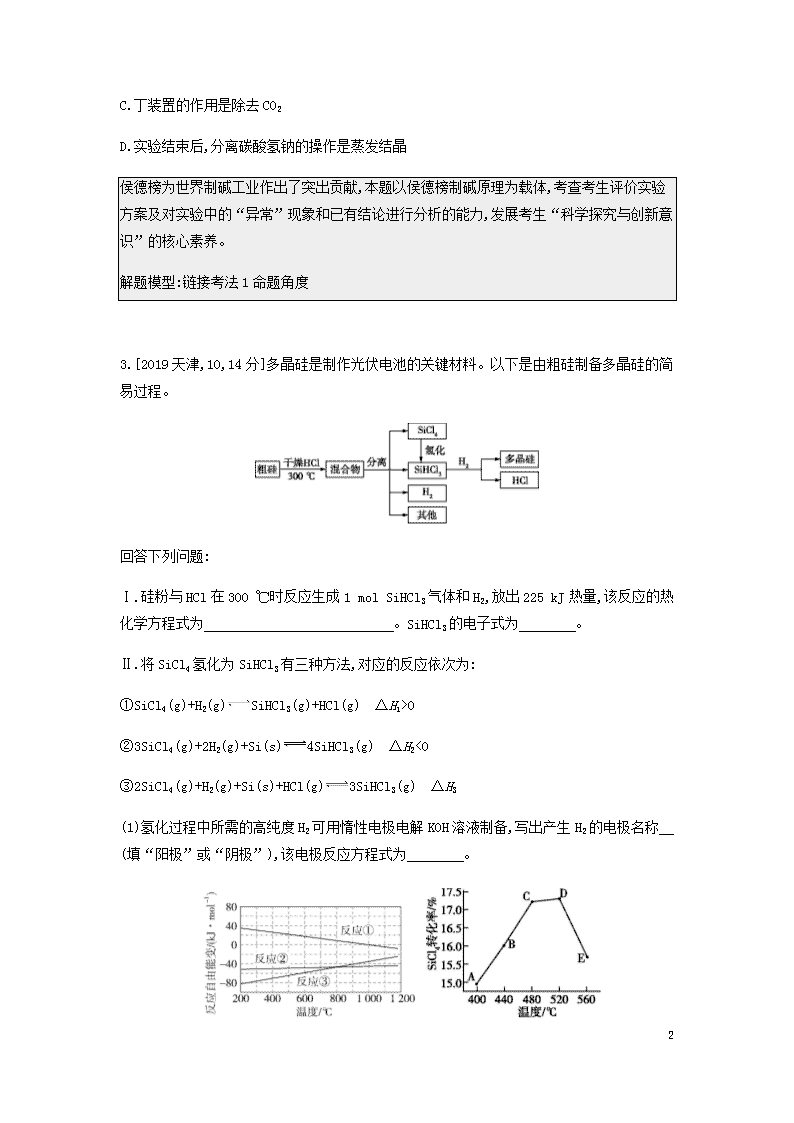
专题七 碳、硅及其化合物 无机非金属材料 考点1 碳、硅及其化合物 1.[2020广东七校第一次联考]以CO2和Na2O2为原料,制取纯净干燥的O2,实验装置如图所示: 下列说法不正确的是( ) A.装置②中试剂可以是NaOH溶液 B.装置③的作用是干燥O2 C.收集氧气应选择装置a D.装置②、③之间应增加盛澄清石灰水的洗气瓶 本题以实验为载体考查CO2与Na2O2的反应,涉及CO2的除杂和检验操作,考查的核心素养是科学探究与创新意识。解答这种成套小型装置实验题,首先应根据实验目的确定实验仪器和药品,然后确定实验步骤。 解题模型:链接考法1命题角度 2.[2019福建南平综合测试]某探究活动小组根据侯德榜制碱原理制备碳酸氢钠。实验装置如图所示(图中夹持、固定装置已略)。下列说法正确的是( ) A.乙装置中盛放的是饱和食盐水 B.丙装置中的溶液变浑浊,表明有碳酸氢钠晶体析出 12 C.丁装置的作用是除去CO2 D.实验结束后,分离碳酸氢钠的操作是蒸发结晶 侯德榜为世界制碱工业作出了突出贡献,本题以侯德榜制碱原理为载体,考查考生评价实验方案及对实验中的“异常”现象和已有结论进行分析的能力,发展考生“科学探究与创新意识”的核心素养。 解题模型:链接考法1命题角度 3.[2019天津,10,14分]多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。 回答下列问题: Ⅰ.硅粉与HCl在300 ℃时反应生成1 mol SiHCl3气体和H2,放出225 kJ热量,该反应的热化学方程式为 。SiHCl3的电子式为 。 Ⅱ.将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为: ①SiCl4(g)+H2(g)SiHCl3(g)+HCl(g) ΔH1>0 ②3SiCl4(g)+2H2(g)+Si(s)4SiHCl3(g) ΔH2<0 ③2SiCl4(g)+H2(g)+Si(s)+HCl(g)3SiHCl3(g) ΔH3 (1)氢化过程中所需的高纯度H2可用惰性电极电解KOH溶液制备,写出产生H2的电极名称 (填“阳极”或“阴极”),该电极反应方程式为 。 12 图1 图2 (2)已知体系自由能变ΔG=ΔH-TΔS,ΔG<0时反应自发进行。三个氢化反应的ΔG与温度的关系如图1所示,可知:反应①能自发进行的最低温度是 ;相同温度下,反应②比反应①的ΔG小,主要原因是 。 (3)不同温度下反应②中SiCl4转化率如图2所示。下列叙述正确的是 (填序号)。 a.B点:v正>v逆 b.v正:A点>E点 c.反应适宜温度:480~520 ℃ (4)反应③的ΔH3= (用ΔH1,ΔH2表示)。温度升高,反应③的平衡常数K (填“增大”“减小”或“不变”)。 (5)由粗硅制备多晶硅过程中循环使用的物质除SiCl4、 SiHCl3和Si外,还有 (填分子式)。 试题以由粗硅制备多晶硅的工艺流程为载体,考查热化学方程式的书写、典型物质电子式的书写、电解原理的运用、焓变与ΔG的关系、温度对平衡常数的影响等必备知识,体现高考命题综合性的新理念。 解题模型:链接考法2命题角度2 考点2 无机非金属材料 4.[2019全国卷Ι,7,6分]陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是( ) A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁 B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成 C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐 D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点 陶瓷、秦兵马俑、古诗词等都是中国传统文化的“精华”,本题与中国传统文化结合进行命题,增强考生对中国传统文化的认知,使考生了解化学在人类发展史上的重要作用。本题中,要明确陶瓷的主要成分是硅酸盐,要抓住硅酸盐的主要性质解题。 解题模型:链接考法3命题角度 12 考点1 碳、硅及其化合物 考法1碳及其化合物的性质 命题角度 结合实验流程考查碳及其化合物之间的转化 1 某实验小组利用如图所示装置对焦炭还原二氧化硅的气体产物的成分进行探究。 已知:PdCl2溶液可用于检验CO,反应的化学方程式为CO+PdCl2+H2OCO2+2HCl+Pd↓(产生黑色固体,使溶液变浑浊)。 (1)实验前要通入足量的N2,其原因是 。 (2)装置B的作用是 。 (3)装置C、D中所盛试剂分别为 、 ,若装置C、D中溶液均变浑浊,且经测定知两气体产物的物质的量相等,则该反应的化学方程式为 。 (4)该装置的缺点是 。 (5)设计实验证明碳酸的酸性比硅酸的强: 。 (1)碳与二氧化硅反应要在高温下进行,高温下,碳与空气中的氧气等也能反应,所以实验前要通入足量的N2,将装置中的空气排尽。(2)根据装置图可知,装置B的作用是作安全瓶,防止倒吸。(3)根据元素守恒,焦炭与二氧化硅反应可能生成一氧化碳也可能生成二氧化碳,所以装置C用来检验二氧化碳,装置D用来检验一氧化碳,所以装置C、D中所盛试剂分别 12 为澄清石灰水、PdCl2溶液;若装置C、D中溶液均变浑浊,说明既有二氧化碳生成又有一氧化碳生成,由于两气体产物的物质的量相等,则根据原子守恒可知该反应的化学方程式为3SiO2+4C2CO2↑+2CO↑+3Si。(4)一氧化碳有毒,会污染空气,该装置没有尾气处理装置吸收或收集CO。(5)设计实验证明碳酸的酸性比硅酸的强时,将CO2通入硅酸钠溶液,发生反应CO2+H2O+Na2SiO3Na2CO3+H2SiO3↓,溶液变浑浊,说明酸性H2CO3>H2SiO3。 (1)将装置中的空气排尽,避免空气中的氧气、二氧化碳、水蒸气对实验产生干扰 (2)作安全瓶,防止倒吸 (3)澄清石灰水 PdCl2溶液 3SiO2+4C2CO2↑+2CO↑+3Si (4)没有尾气处理装置 (5)向硅酸钠溶液中通入二氧化碳气体,溶液变浑浊,证明碳酸的酸性强于硅酸 考法归纳·学习理解 CO与CO2的除杂方法 1.若CO中混有CO2,可通过盛有NaOH溶液的洗气瓶除去。 2.若CO2中混有CO,可通过装有灼热CuO的硬质玻璃管除去。 3.若CO2中混有SO2或HCl,可通过盛有饱和NaHCO3溶液的洗气瓶除去。 考法2硅及其化合物的性质 命题角度1 结合物质推断考查硅及其化合物之间的转化 2已知A、B、C、D、E 五种物质中均含有短周期主族元素R,它们之间能发生如图所示的转化,A、B、D、E四种物质均难溶于水,元素R的单质能与NaOH溶液反应生成盐和氢气。 下列说法正确的是 A.反应①中氧化剂与还原剂的物质的量之比为1∶1 B.化合物A既能溶于NaOH溶液又能溶于氢氟酸 C.反应④的离子方程式为2R+2OH-+2H2O2RO2-+3H2↑ 12 D.化合物C的溶液与反应①产生的气体能够发生化学反应 R为短周期主族元素,元素R的单质能与NaOH溶液反应生成盐和氢气,则R是Al或Si,由题图中转化关系可知,若R是Al,则C应为NaAlO2,NaAlO2与过量盐酸反应可得到NaCl和AlCl3的混合溶液,不能生成难溶物,所以R是Si,根据题图中转化关系可知,A为SiO2,B为CaSiO3,D为Si,C为Na2SiO3,E为H2SiO3。反应①的化学方程式为SiO2+2CSi+2CO↑,则氧化剂与还原剂的物质的量之比为1∶2,故A错误;SiO2既能与NaOH溶液反应,又能和氢氟酸反应,故B正确;反应④的离子方程式为Si+2OH-+H2OSiO32-+2H2↑,故C错误;反应①产生的气体是CO,Na2SiO3溶液与CO不反应,故D错误。 B 考点扫描 1.[2017江苏,7C]CaCO3CaOCaSiO3( ) 2.[2015江苏,8A]粗硅SiCl4Si( ) 3.[2016江苏,9A]SiO2SiCl4Si( ) 提示:1.√ 2.√ 3.✕ 1. SiO2是一种化工原料,可以制备一系列物质,下列说法正确的是( ) A.图中所有反应都不属于氧化还原反应 B.硅酸盐的化学性质稳定,常用于制造光导纤维 C.可用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸钙 D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高 命题角度2 工艺流程中有关硅及其化合物的制备 12 3 工业上制备高纯硅有多种方法,其中的一种工艺流程如下: 已知流化床反应器中的产物除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等。下列说法正确的是 A.电弧炉中发生的反应为C+SiO2CO2↑+Si B.SiCl4进入还原炉之前需要经过蒸馏提纯 C.每生产1 mol高纯硅,需要44.8 L Cl2(标准状况) D.该工艺Si的产率高,符合绿色化学要求 二氧化硅与焦炭在高温下生成粗硅和一氧化碳,电弧炉中发生的反应为2C+SiO22CO↑+Si,选项A错误;流化床反应器中除有SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等物质,所以SiCl4进入还原炉之前需经过蒸馏提纯,选项B正确;根据转化关系Si(粗)→SiCl4→Si(高纯),每生产1mol高纯硅,需要1molSiCl4,而粗硅与Cl2反应时,产物不止有SiCl4,所以生成1molSiCl4消耗的Cl2的体积大于44.8L(标准状况),选项C错误;该工艺中产生氯化氢、CO等气体,且反应中有氯气参与,容易引起空气污染,不符合绿色化学要求,选项D错误。 B 考法归纳·应用实践 (1)高温下用碳还原二氧化硅制得粗硅 SiO2+2CSi(粗)+2CO↑ (2)粗硅与干燥HCl气体反应制得SiHCl3 Si(粗)+3HClSiHCl3+H2 (3)粗硅与干燥Cl2反应制得SiCl4 Si(粗)+2Cl2SiCl4 12 (4)SiHCl3与过量H2在1100~1200℃反应制得纯硅 SiHCl3+H2Si(纯)+3HCl (5)SiCl4与过量H2在高温下反应制得纯硅 SiCl4+2H2Si(纯)+4HCl (6)SiHCl3、SiCl4能与H2O发生反应 SiHCl3+3H2OH2SiO3↓+3HCl+H2↑ SiCl4+3H2OH2SiO3↓+4HCl (7)SiH4在空气中易自燃 SiH4+2O2SiO2+2H2O 2. 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:①高温下用焦炭还原二氧化硅制得粗硅;②粗硅与干燥的HCl气体反应制得SiHCl3,Si(粗)+3HClSiHCl3+H2;③经纯化的SiHCl3与过量H2在1 100~1 200 ℃下反应制得纯硅。已知SiHCl3 沸点为34 ℃,能与H2O剧烈反应,在空气中易自燃。请回答下列问题: (1)第①步制备粗硅时1 mol C完全反应转移的电子数为 (设NA为阿伏加德罗常数的值)。 (2)用SiHCl3与过量H2反应制备纯硅的装置如图所示(热源及夹持装置已略去): ①装置B中的试剂是 。装置C中的烧瓶需要加热,其采用的方法是 。 ②反应一段时间后,装置D中观察到的现象是 ,装置D中发生反应的化学方程式为 。 ③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。 12 考点2 无机非金属材料 考法3无机非金属材料 命题角度 无机非金属材料的应用 4 [2019福建龙岩质检]“九秋风露越窑开,夺得千峰翠色来”是赞誉越窑青瓷的诗句。玻璃、水泥和陶瓷均为硅酸盐制品,下列有关说法正确的是 A.玻璃是人类最早使用的硅酸盐制品 B.制水泥的原料为纯碱、石灰石和石英砂 C.硅酸盐制品的性质稳定 D.高温结构陶瓷的主要成分也为硅酸盐 陶瓷是人类最早使用的硅酸盐制品,A项错误;纯碱、石灰石和石英砂是制玻璃的原料,制水泥的原料是黏土和石灰石,B项错误;硅酸盐制品的性质稳定,C项正确;高温结构陶瓷属于新型无机非金属材料,其主要成分不是硅酸盐,D项错误。 C 3. 水玻璃(Na2SiO3水溶液)广泛应用于耐火材料、洗涤剂生产等领域,是一种重要的工业原料。如图所示是用稻壳灰(SiO2的质量分数为65%~70%,C的质量分数为30%~35%)制取水玻璃的工艺流程。 下列说法正确的是( ) 12 A.原材料稻壳灰价格低廉,且副产品活性炭有较高的经济价值 B.操作A与操作B完全相同 C.该流程中硅元素的化合价发生改变 D.反应器中发生的复分解反应为SiO2+2NaOHNa2SiO3+H2O 冲刺双一流 素材9 草酸和草酸盐的性质和应用 1.草酸的性质 (1)不稳定性 H2C2O4H2O+CO↑+CO2↑(固体受热易分解) (2)还原性 5H2C2O4+2MnO4-+6H+ 2Mn2++10CO2↑+8H2O (3)酸性 H2C2O4+CaCO3 CaC2O4+CO2↑+H2O 2.草酸盐的性质 (1)(NH4)2C2O4溶于水,微溶于乙醇,加热分解,由氨水或碳酸铵与草酸溶液作用而成。 (2)CaC2O4不溶于水、醋酸,溶于盐酸、稀硝酸;灼烧时转变成碳酸钙或氧化钙。 (3)草酸镁微溶于水,由可溶性镁盐与草酸铵在水溶液中作用而得。 考点扫描 12 1.[2017全国卷Ⅱ,26(4)改编]草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应的离子方程式为 。 2.[2015上海,30]KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式: 。 提示:1.2MnO4-+6H++5H2C2O42Mn2++10CO2↑+8H2O 2.2KClO3+H2C2O4+2H2SO42ClO2↑+2CO2↑+2KHSO4+2H2O 4.[2019北京,11,6分]探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L-1 H2C2O4的pH=1.3) 实验 装置 试剂a 现象 ① Ca(OH)2溶液(含酚酞) 溶液褪色,产生白色沉淀 ② 少量NaHCO3溶液 产生气泡 ③ 酸性KMnO4溶液 紫色溶液褪色 ④ C2H5OH和浓硫酸 加热后产生有香味物质 由上述实验所得草酸性质所对应的方程式不正确的是( ) A.H2C2O4有酸性,Ca(OH)2+H2C2O4 CaC2O4↓+2H2O B.酸性:H2C2O4>H2CO3,NaHCO3+H2C2O4 NaHC2O4+CO2↑+H2O C.H2C2O4有还原性,2MnO4-+5C2O42-+16H+ 2Mn2++10CO2↑+8H2O D.H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH C2H5OOCCOOC2H5+2H2O 5. [2015新课标全国卷Ⅰ,26,14分]草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101 ℃,易溶于水,受热脱水、升华,170 ℃以上分解。回答下列问题: 12 (1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象是 ,由此可知草酸晶体分解的产物中有 。装置B的主要作用是 。 (2)乙组同学认为草酸晶体分解产物中还有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。 ①乙组同学的实验装置中,依次连接的合理顺序为A、B、 。装置H反应管中盛有的物质是 。 ②能证明草酸晶体分解产物中有CO的现象是 。 (3)设计实验证明: ①草酸的酸性比碳酸的强 。 ②草酸为二元酸 。 12 12查看更多