四川省成都七中2020届高三高考三诊化学试题
2020年四川省成都七中高考化学三诊试卷
学校:___________姓名:___________班级:___________考号:___________
一、单选题(本大题共7小题,共42.0分)
1. 下列说法正确的是( )
A. 越王勾践剑的铸造材料主要是铜锡合金
B. 高温结构陶瓷属于传统硅酸盐产品
C. 棉、麻、真丝均属于纤维素
D. 石墨烯是一种能导电的有机高分子材料
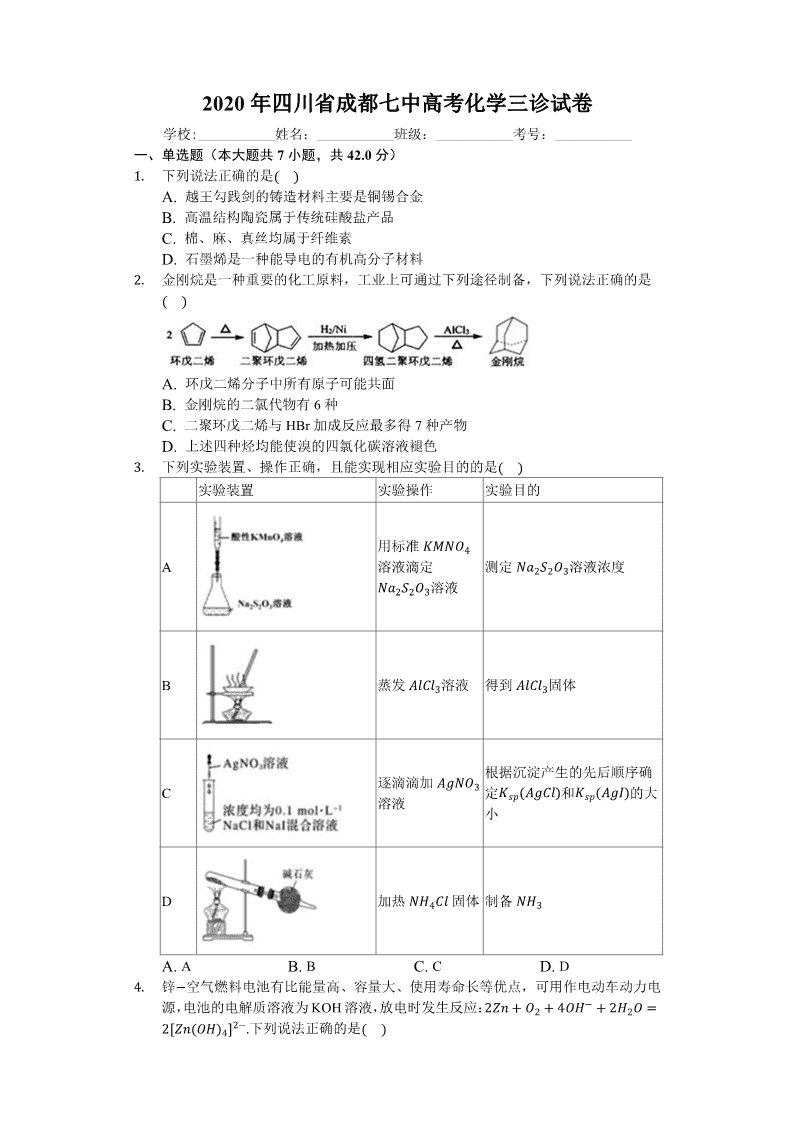
2. 金刚烷是一种重要的化工原料,工业上可通过下列途径制备,下列说法正确的是( )
A. 环戊二烯分子中所有原子可能共面
B. 金刚烷的二氯代物有6种
C. 二聚环戊二烯与HBr加成反应最多得7种产物
D. 上述四种烃均能使溴的四氯化碳溶液褪色
3. 下列实验装置、操作正确,且能实现相应实验目的的是( )
实验装置
实验操作
实验目的
A
用标准KMNO4溶液滴定Na2S2O3溶液
测定Na2S2O3溶液浓度
B
蒸发AlCl3溶液
得到AlCl3固体
C
逐滴滴加AgNO3溶液
根据沉淀产生的先后顺序确定Ksp(AgCl)和Ksp(AgI)的大小
D
加热NH4Cl固体
制备NH3
A. A B. B C. C D. D
4. 锌−空气燃料电池有比能量高、容量大、使用寿命长等优点,可用作电动车动力电源,电池的电解质溶液为KOH溶液,放电时发生反应:2Zn+O2+4OH−+2H2O=2[Zn(OH)4]2−.下列说法正确的是( )
2020年四川省成都七中高考化学三诊试卷
学校:___________姓名:___________班级:___________考号:___________
一、单选题(本大题共7小题,共42.0分)
1. 下列说法正确的是( )
A. 越王勾践剑的铸造材料主要是铜锡合金
B. 高温结构陶瓷属于传统硅酸盐产品
C. 棉、麻、真丝均属于纤维素
D. 石墨烯是一种能导电的有机高分子材料
2. 金刚烷是一种重要的化工原料,工业上可通过下列途径制备,下列说法正确的是( )
A. 环戊二烯分子中所有原子可能共面
B. 金刚烷的二氯代物有6种
C. 二聚环戊二烯与HBr加成反应最多得7种产物
D. 上述四种烃均能使溴的四氯化碳溶液褪色
3. 下列实验装置、操作正确,且能实现相应实验目的的是( )
实验装置
实验操作
实验目的
A
用标准KMNO4溶液滴定Na2S2O3溶液
测定Na2S2O3溶液浓度
B
蒸发AlCl3溶液
得到AlCl3固体
C
逐滴滴加AgNO3溶液
根据沉淀产生的先后顺序确定Ksp(AgCl)和Ksp(AgI)的大小
D
加热NH4Cl固体
制备NH3
A. A B. B C. C D. D
4. 锌−空气燃料电池有比能量高、容量大、使用寿命长等优点,可用作电动车动力电源,电池的电解质溶液为KOH溶液,放电时发生反应:2Zn+O2+4OH−+2H2O=2[Zn(OH)4]2−.下列说法正确的是( )
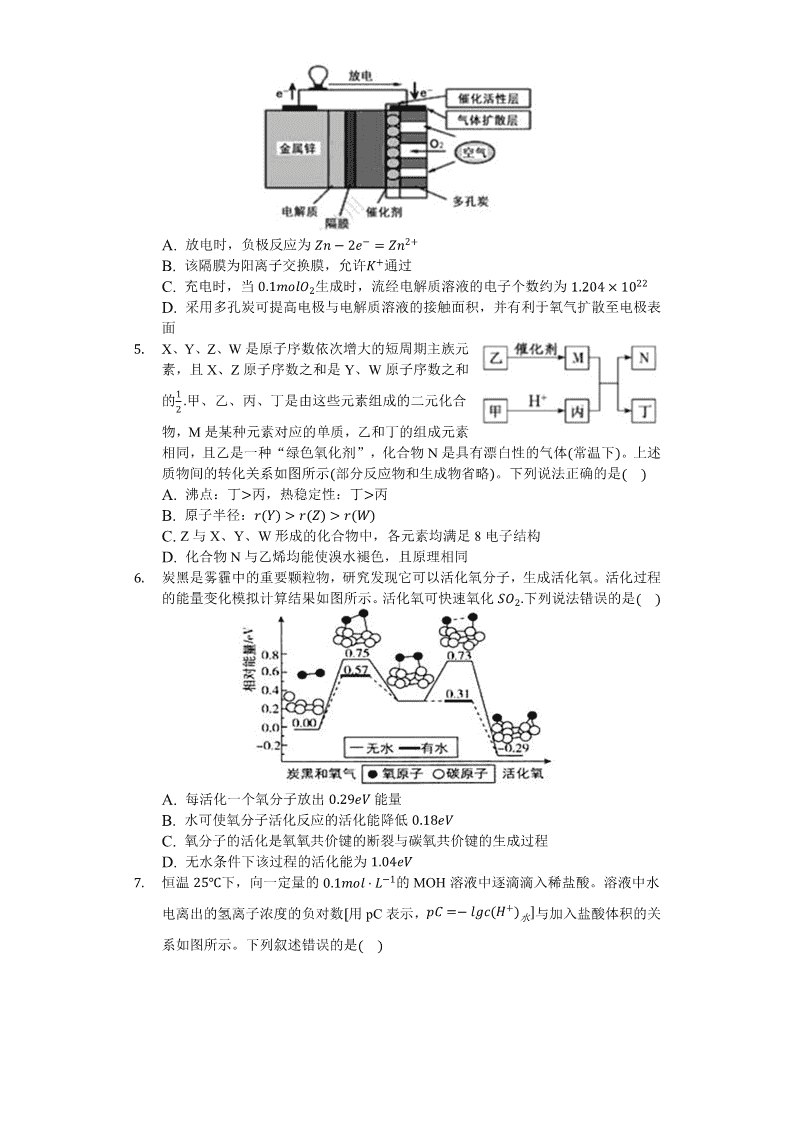
A. 放电时,负极反应为Zn−2e−=Zn2+
B. 该隔膜为阳离子交换膜,允许K+通过
C. 充电时,当0.1molO2生成时,流经电解质溶液的电子个数约为1.204×1022
D. 采用多孔炭可提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
1. X、Y、Z、W是原子序数依次增大的短周期主族元素,且X、Z原子序数之和是Y、W原子序数之和的12.甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。上述质物间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是( )
A. 沸点:丁>丙,热稳定性:丁>丙
B. 原子半径:r(Y)>r(Z)>r(W)
C. Z与X、Y、W形成的化合物中,各元素均满足8电子结构
D. 化合物N与乙烯均能使溴水褪色,且原理相同
2. 炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可快速氧化SO2.下列说法错误的是( )
A. 每活化一个氧分子放出0.29eV能量
B. 水可使氧分子活化反应的活化能降低0.18eV
C. 氧分子的活化是氧氧共价键的断裂与碳氧共价键的生成过程
D. 无水条件下该过程的活化能为1.04eV
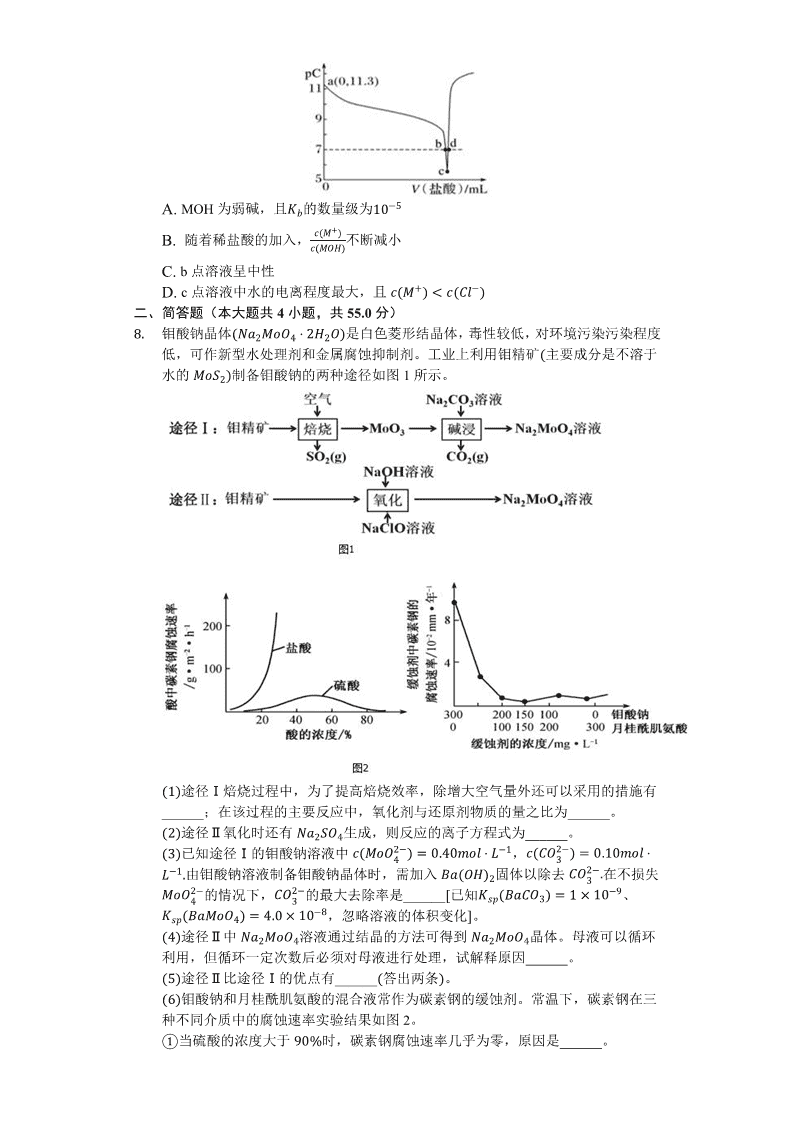
3. 恒温25℃下,向一定量的0.1mol⋅L−1的MOH溶液中逐滴滴入稀盐酸。溶液中水电离出的氢离子浓度的负对数[用pC表示,pC=−lgc(H+)水]与加入盐酸体积的关系如图所示。下列叙述错误的是( )
A. MOH为弱碱,且Kb的数量级为10−5
B. 随着稀盐酸的加入,c(M+)c(MOH)不断减小
C. b点溶液呈中性
D. c点溶液中水的电离程度最大,且c(M+)
Ksp(AgI),故C正确;
D.加热NH4Cl固体,分解为氨气和氯化氢,两者又会迅速结合生成NH4Cl,无法得到氨气,故D错误;
故选:C。
A.高锰酸钾可氧化橡胶;
B.加热促进水解,且生成盐酸易挥发;
C.浓度相同,Ksp小的先沉淀;
D.氯化铵分解后,在试管口化合生成氯化铵。
本题考查化学实验方案的评价,为高频考点,把握物质的性质、中和滴定、沉淀生成、盐类水解、物质制备、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
4.【答案】D
【解析】解:A、放电时,负极反应为Zn+4OH−−2e−=[Zn(OH)4]2−,故A错误;
B、正极反生反应:O2+4e−+2H2O=4OH−,负极电极反应式为Zn+4OH−−2e−=[Zn(OH)4]2−,可知该隔膜为阴离子交换膜,允许OH−通过,故B错误;
C、不论放电还是充电,电子不会流经电解质溶液,故C错误;
D、采用多孔炭可提高电极与电解质溶液的接触面积、有利于氧气扩散至电极表面,使原电池工作持续、稳定,故D正确;
故选:D。
根据2Zn+O2+4OH−+2H2O=2[Zn(OH)4]2−可知,O2中元素的化合价降低、被还原,则通入O2的电极为原电池正极,电极反应为O2+4e−+2H2O=4OH−,Zn元素化合价升高,被氧化,Zn为原电池负极,电极反应式为Zn+4OH−−2e−=[Zn(OH)4]2−,放电时电子由负极经过导线流向正极;电池充电与放电时电极反应相反,充电时总反应为[Zn(OH)4]2−=2Zn+O2↑+4OH−+2H2O,金属Zn为阴极,多孔碳为阳极,据此分析解答。
本题考查原电池与电解池的原理,正确判断正负极、阴阳极、电极反应式的书写及电子转移的计算,正确判断化合价的变化为解答该题的关键,注意:电子不能进入电解质溶液中,题目难度不大。
5.【答案】A
【解析】解:乙是一种“绿色氧化剂”,则乙为H2O2,乙和丁组成的元素相同,则丁为H2O;化合物N是具有漂白性的气体(常温下),则N为SO2,根据转化关系,M是单质,H2O2分解成O2和H2O,则M为O2;甲在酸中生成丙,丙为二元化合物,且含有S元素,则丙为H2S;四种元素原子序数依次增大,且都为短周期元素,X为H,Y为O,若W为S,X、Z原子序数之和是Y、W原子序数之和的12,则Z为Na;若Z为S,则W不符合要求。
A.丁为H2O,丙为H2S,非金属性O>S,则简单氢化物的热稳定性:H2O>H2S,同时水分子间存在氢键,则沸点:H2O>H2S,故A正确;
B.同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大,原子半径大小顺序为:r(Na)>r(S)>r(O),故B错误;
C.Z与X、Y、W形成化合物分别是NaH、Na2O(或Na2O2)、Na2S,NaH中H最外层有2个电子,不满足8电子结构,故C错误;
D.SO2能使溴水褪色,发生反应为:SO2+Br2+H2O=2HBr+H2SO4,利用了SO2的还原性,而乙烯和溴水发生的加成反应,其原理不同,故D错误;
故选:A。
乙是一种“绿色氧化剂”,则乙为H2O2,乙和丁组成的元素相同,则丁为H2O;化合物N是具有漂白性的气体(常温下),则N为SO2
,根据转化关系,M是单质,H2O2分解成O2和H2O,则M为O2;甲在酸中生成丙,丙为二元化合物,且含有S元素,则丙为H2S;四种元素原子序数依次增大,且都为短周期元素,X为H,Y为O,若W为S,X、Z原子序数之和是Y、W原子序数之和的12,则Z为Na;若Z为S,则W不符合要求,据此解答。
本题考查无机物推断,题目难度不大,推断物质、元素组成为解答关键,注意掌握元素周期律内容及常见元素化合物性质,试题侧重考查学生的分析能力及逻辑推理能力。
6.【答案】D
【解析】解:A.根据能量变化图分析,氧气最终变成活化氧,体系能量降低,则每活化一个氧气分子放出0.29eV能量,故A正确;
B.反应过程中存在多步反应的活化能,根据能量变化图分析,整个反应的活化能应是活化能较大的,则没有水加入的反应活化能E=0.75eV,有水加入反应的活化能E=0.57eV,所以水可以使氧分子活化反应的活化能降低0.75eV−0.57eV=0.18eV,故B正确;
C.根据能量变化图和题意,氧分子活化过程中氧氧的断裂,生成碳氧键,所以氧分子的活化是氧氧的断裂与碳氧键的生成过程,故C正确;
D.根据能量变化图分析,整个反应的活化能应是活化能较大的,则没有水加入的反应活化能E=0.75eV,故D错误;
故选:D。
A.由图可知,反应物的总能量高于生成物的总能量;
B.化能反应过程中存在多步反应的活化能,整个反应的活为活化能较大者;
C.根据图象分析,氧分子活化过程O−O键断裂,生成C−O键;
D.根据图象进行分析,整个反应的活化能应是活化能较大的。
本题考查催化反应过程机理的分析,催化剂存在改变反应历程,降低反应活化能,加快化学速率,明确多步反应历程中最大的活化能为整个反应的活化能是关键,整体难度中等。
7.【答案】B
【解析】解:A.MOH抑制了水的电离,由a点可知MOH电离出c(OH−)=10−1410−11.3mol/L=10−2.7mol/L,则Kb=10−2.7×10−2.70.1=10−4.4,Kb的数量级为10−5,故A正确;
B.c(M+)c(MOH)=Kbc(OH−),随着稀盐酸的加入c(OH−)减小,温度不变,则Kb不变,则c(M+)c(MOH)的值不断增大,故B错误;
C.25℃下,b点c(H+)水=10−7mol/L,此时为MOH和MCl的混合液,MOH对水的电离的抑制程度与MCl对水的电离的促进程度相同,则pH=7,即b点溶液呈中性,故C正确;
D.c点水的电离程度最大,此时溶质为MCl,M+水解使溶液显酸性,则c(M+)H>Li 激发态 平面三角形 sp3 9:1 甘氨酸分子间形成的氢键数比丙酸分子间形成的氢键数多(或甘氨酸中的氨基使分子间产生氢键) Cu(OH)2+4NH3⋅H2O=[Cu(NH3)4]2++2OH−+4H2O 正四面体 100% 111×4(646.5×10−10)3×NAg/cm3×41110.0708g/cm3
【解析】解:(1)同一周期元素原子的电负性随着原子序数的递增而增大,同一主族元素原子的电负性随着原子序数的递增而减小,在Li、H、O三种元素中Li的电负性最小,O的电负性最大,则电负性从大到小的顺序为O>H>Li;基态Al原子核外电子空间运动状态有7种,当运动状态不为7种时为激发态,
故答案为:O>H>Li;激发态;
(2)①NO3−的中心原子价层电子对数=3+5+1−3×22=3且孤电子对数为0,根据价层电子对互斥理论判断其空间构型为平面三角形,
故答案为:平面三角形;
②甘氨酸中N原子形成两个N−H键和一个N−C键,达到饱和状态,价层电子对数为4,采用sp3杂化;分子中碳氧双键中存在1个π键,其余均为σ键,所以分子中σ键与π键的个数比为9:1;分子质量相同时,甘氨酸分子间形成的氢键数比丙酸分子间形成的氢键数多(或甘氨酸中的氨基使分子间产生氢键),所以其熔点、沸点远高于相对分子质量几乎相等的丙酸,
故答案为:sp3;9:1;甘氨酸分子间形成的氢键数比丙酸分子间形成的氢键数多(或甘氨酸中的氨基使分子间产生氢键);
(3)蓝色沉淀溶解得到深蓝色溶液的过程是氢氧化铜变成氢氧化四氨合铜的过程,离子方程式为Cu(OH)2+4NH3⋅H2O=[Cu(NH3)4]2++2OH−+4H2O,
故答案为:Cu(OH)2+4NH3⋅H2O=[Cu(NH3)4]2++2OH−+4H2O;
由晶体结构可知,Ni原子个数=8×18+6×12=4,所有Mg原子的Ni配位数相等,Mg原子数为8,则Mg原子填入由Ni原子形成的四面体空隙中,该晶胞中含有8个由Ni形成的正四面体,8个Mg原子分别占据这8个正四面体,所以填隙率为100%,
故答案为:正四面体;100%;
(5)该晶胞中氢气质量分数=4111,该晶胞中Ni原子个数=8×18+6×12=4,根据化学式知,Mg原子个数=4×2=8、H原子个数=4×4=16,晶胞体积=(646.5×10−10cm)3,则晶体密度=111NA×4(646.5×10−10)3g/cm3,储氢能力=晶体密度×氢气质量分数液氢密度=111×4(646.5×10−10)3×NAg/cm3×41110.0708g/cm3,
故答案为:111×4(646.5×10−10)3×NAg/cm3×41110.0708g/cm3。
(1)元素的非金属性越强,其电负性越大;Al原子核外有13个电子,如果是基态原子,分别占据1s、2s、2p、3s、3p轨道,有7种空间运动状态;
(2)①NO3−的中心原子价层电子对数=3+5+1−3×22=3且孤电子对数为0,根据价层电子对互斥理论判断其空间构型;
②甘氨酸中N原子形成两个N−H键和一个N−C键,达到饱和状态,价层电子对数为4;分子中碳氧双键中存在1个π键,其余均为σ键;
形成分子间氢键个数越多,其熔沸点越高;
(3)蓝色沉淀溶解得到深蓝色溶液的过程是Cu(OH)2变成氢氧化四氨合铜的过程;
(4)由晶体结构可知,Ni原子个数=8×18+6×12=4,所有Mg原子的Ni配位数相等,Mg原子数为8,则Mg原子填入由Ni原子形成的四面体空隙中,该晶胞中含有8个由Ni形成的正四面体,8个Mg原子分别占据这8个正四面体;
(5)储氢能力=晶体密度×氢气质量分数液氢密度,该晶胞中氢气质量分数=4111,该晶胞中Ni原子个数=8×18+6×12=4,根据化学式知,Mg原子个数=4×2=8、H原子个数=4×4=16,晶胞体积=(646.5×10−10cm)3,则晶体密度=111NA×4(646.5×10−10)3g/cm3。
本题考查物质结构和性质,侧重考查基本理论的理解和运用、空间想象能力及计算能力,明确原子结构、元素化合物性质及晶胞计算方法是解本题关键,难点是晶胞计算,注意均摊法在晶胞计算中的灵活运用,题目难度中等。
11.【答案】NaOH(或Na2CO3);ClCH2CH=CH2;氯原子、碳碳双键;氧化反应;C16H21O2N;Cl2/光照;;取代反应;;+HNO3(浓+H2O;2−硝基−1,4−苯二甲酸(或硝基对苯二甲酸)
【解析】解:由合成反应可知,反应①中酚−OH转化为−ONa,则试剂a为NaOH(或Na2CO3),由反应②为取代反应及A、B的结构可知,b为ClCH2CH=CH2,反应③中加氧去H为C=C的氧化反应,反应④为开环加成反应,
(1)由上述分析可知,a为NaOH(或Na2CO3),b为ClCH2CH=CH2,b中官能团为氯原子、碳碳双键,故答案为:NaOH(或Na2CO3);ClCH2CH=CH2;氯原子、碳碳双键;
(2)由上述分析可知,③的反应类型为氧化反应,故答案为:氧化反应;
(3)由心得安的结构简式可知分子式为C16H21O2N,故答案为:C16H21O2N;
(4)b为ClCH2CH=CH2,由丙烷经三步反应合成,则合成流程为试剂b,则反应1的试剂与条件为Cl2/光照,反应2的化学反应方程为,反应3中甲基上的H被−Cl取代,反应类型是取代反应,
故答案为:Cl2/光照;;取代反应;
(5)D是1−萘酚的同分异构体,其分子中有两个官能团,能发生银镜反应,则含−CHO;D能被KMnO4酸性溶液氧化成E(C2H4O2)和芳香化合物F(C8H6O4),E和F与碳酸氢钠溶液反应均能放出CO2气体,E、F均含−COOH,则D中含−C≡C−CH3,F芳环上的一硝化产物只有一种,F为对二苯甲酸(),则D中−CHO、−C≡C−CH3在苯环的对位,所以D的结构简式为,由F生成的一硝化产物的化学方程式为+HNO3(浓+H2O,生成有机物的名称为2−硝基−1,4−苯二甲酸(或硝基对苯二甲酸),
故答案为:;+HNO3(浓+H2O;2−硝基−1,4−苯二甲酸(或硝基对苯二甲酸).
由合成反应可知,反应①中酚−OH转化为−ONa,则试剂a为NaOH(或Na2CO3),由反应②为取代反应及A、B的结构可知,b为ClCH2CH=CH2,反应③中加氧去H为C=C的氧化反应,反应④为开环加成反应,结合心得安的结构简式确定分子式,以此解答(1)~(3);
(4)b为ClCH2CH=CH2,由丙烷经三步反应合成,则合成流程为试剂b;
(5)D是1−萘酚的同分异构体,其分子中有两个官能团,能发生银镜反应,则含−CHO;D能被KMnO4酸性溶液氧化成E(C2H4O2)和芳香化合物F(C8H6O4),
E和F与碳酸氢钠溶液反应均能放出CO2气体,E、F均含−COOH,则D中含−C≡C−CH3,F芳环上的一硝化产物只有一种,F为对二苯甲酸,则D中−CHO、−C≡C−CH3在苯环的对位,以此来解答.
本题为2014年广西高考化学试题,侧重有机合成的考查,把握合成流程中结构、官能团的变化为解答的关键,明确官能团与性质的关系、反应条件和反应类型的关系、同分异构体的推断即可解答,题目难度中等.
12.【答案】BDE 2I−+ClO−+H2O=I2+Cl−+2OH− ClO−+H2O⇌HClO+OH− 次氯酸钠溶液 右侧碘水颜色变浅,电流表指针发生偏转 温度 试管开闭方式 敞口方式,当温度为70℃,产生的碘单质容易挥发,冷却后,会继续生产碘单质,故反应较慢
【解析】解:(1)灼烧海藻固体时,需要用到三脚架、酒精灯、盛放海藻的坩埚以及支撑坩埚的泥三角,
故答案为:BDE;
(2)①实验I中发生反应2I−+ClO−+H2O=I2+Cl−+2OH−,得到单质碘,碘水呈浅黄色,
故答案为:2I−+ClO−+H2O=I2+Cl−+2OH−;
②(a)次氯酸根离子在水中会水解:ClO−+H2O⇌HClO+OH−,因而显碱性,
故答案为:ClO−+H2O⇌HClO+OH−;
(b)既然要验证次氯酸钠能否氧化单质碘,甲溶液应是次氯酸钠溶液,若二者能发生氧化还原反应,右侧碘水因被消耗而颜色变浅,并且电流表的指针会发生偏转,
故答案为:次氯酸钠溶液;右侧碘水颜色变浅,电流表指针发生偏转;
③(a)根据表格,得出影响氧气氧化KI溶液的反应速率的因素有温度、试管开闭方式,
故答案为:温度;试管开闭方式;
(b)Ⅴ和Ⅵ对比,Ⅴ采用敞口方式,当温度为70℃,产生的碘单质容易挥发,冷却后,会继续生产碘单质,故反应较慢,
故答案为:敞口方式,当温度为70℃,产生的碘单质容易挥发,冷却后,会继续生产碘单质,故反应较慢。
由流程可知,海草晒干后在坩埚中灼烧,然后溶解、过滤分离出含碘离子的溶液,氧化碘离子生成碘单质,再加有机溶剂萃取分离碘。
(1)灼烧需要坩埚、泥三角、三脚架、酒精灯;
(2)①次氯酸钠具有强氧化性,可将I−氧化成单质碘,碘水呈浅黄色;
②(a)次氯酸钠是弱酸强碱盐,因水解而显碱性;
(b)右侧碘水因被消耗而颜色变浅,并且电流表的指针会发生偏转,可知发生原电池反应;
③(a)根据表格中信息对比作答;
(b)温度为70℃,产生的碘单质容易挥发,冷却后,会继续生产碘单质。
本题考查海水资源的应用及物质的性质,为高频考点,把握物质的性质、发生的反应、盐类水解及氧化还原反应、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验对比及控制变量法、找到两者的异同点为解答的难点,题目难度不大。