- 2021-05-09 发布 |
- 37.5 KB |
- 27页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021高考化学一轮复习专题一物质的组成性质和分类课件
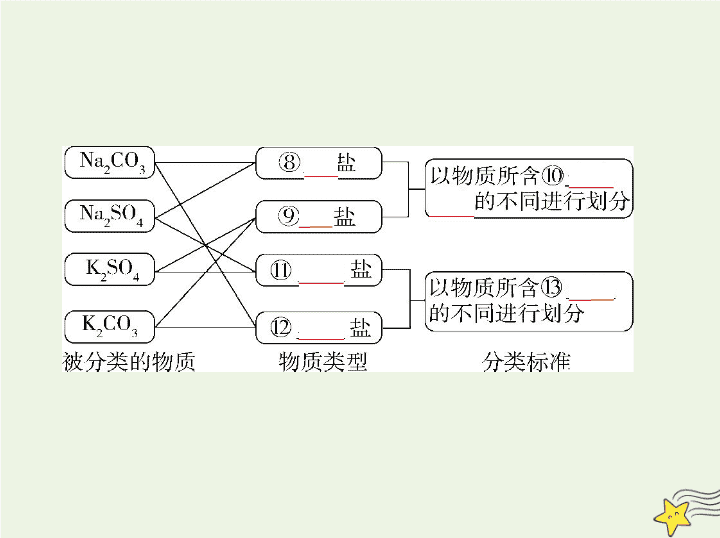
考点一 物质的组成、性质和分类 考点清单 基础知识 一、物质的组成 1.宏观上:物质由① 元素 组成,元素在自然界有两种存在形式,以 单质 形 式存在的称为元素的② 游离 态,以 化合物 形式存在的称为元素的③ 化合 态。 2.微观上:质子、中子、④ 电子 是构成原子的三种基本粒子,原子、分 子、⑤ 离子 是构成物质的三种基本微粒。 二、分类的方法 1.单一分类法 单一分类法就是对被分类的对象只用一种标准进行分别归类的分类方法, 如: 2.交叉分类法 交叉分类法就是将被分类的对象用多种不同的分类标准进行分类,如: 物 质 3.树状分类法 所谓树状分类法,简单地说,是根据被分类对象的整体与分出的类别间的关 系及其陈列式的形状(像树)来定义的,如下图: 核心精讲 一、物质分类中易混淆的概念 1.酸的元数不一定等于酸分子中的H原子数。如亚磷酸(H 3 PO 3 )是二元酸, 次磷酸(H 3 PO 2 )是一元酸,因为它们的结构分别是 、 。 2.无氧酸不一定是非金属元素的氢化物,如氢氰酸(HCN)等。 3.酸的氧化性与氧化性酸不同。酸的氧化性指H + 的氧化性;氧化性酸指酸 根具有氧化性的酸,如HClO、HNO 3 、浓H 2 SO 4 。 4.非金属氧化物不一定是酸性氧化物,如CO、NO等。 5.酸性氧化物不一定是非金属氧化物,如Mn 2 O 7 、CrO 3 。 6.金属氧化物不一定是碱性氧化物,如Al 2 O 3 、ZnO(两性氧化物),Mn 2 O 7 、 CrO 3 (酸性氧化物)。 7.碱性氧化物一定是金属氧化物。 8.酸酐不一定是酸性氧化物,如乙酸酐[(CH 3 CO) 2 O]等。 9.酸性氧化物一定是酸酐。 10.酸性氧化物不一定能与水反应生成相应的酸,如SiO 2 。 11.Na 2 O 2 与酸反应不仅生成盐和水,还生成O 2 ,因而不是碱性氧化物。 物理变化 化学变化 三馏 (1)蒸馏 (2)分馏 干馏 四色 焰色反应 (1)显色反应 (2)颜色反应 (3)指示剂变色反应 五解 潮解 (1)分解 (2)电解 (3)水解 (4)裂解 二、物质变化过程中的“三馏”“四色”“五解”和“十七化” 十七化 (1)熔化 (2)汽化 (3)液化 (1)氢化 (2)氧化 (3)水化 (4)风化 (5)炭化 (6)钝化 (7)催化 (8)皂化 (9)歧化 (10)卤化 (11)硝化 (12)酯化 (13)裂化 (14)油脂的硬化 注意 ①化学变化:同素异形体之间的相互转化、CuSO 4 ·5H 2 O的脱水、蛋 白质变性、电解质溶液导电、浓硫酸脱水、煤的气化和液化。②物理变 化:金属导电、盐析、活性炭吸附、渗析。③爆炸有的是由化学变化引起 的,有的是由物理变化引起的。 考点二 分散系 基础知识 一、分散系 分散系 二、溶液 1.饱和溶液 在一定温度下,向一定量的溶剂里加入某种溶质,当该溶质不能继续溶解 时,所得到的溶液叫作这种溶质的饱和溶液。 2.溶解度 溶解度:在一定温度下,某物质在⑤ 100 g溶剂里达到⑥ 饱和 状态 时所溶解的质量,单位是克,符号为 S 。 溶解度随温度升高而增大的物质,当把其饱和溶液的温度降低时,溶质将会 析出。 3.溶解度与溶质质量分数的区别 溶质质量分数与溶解度不同,它没有单位,既可以用百分数表示,又可以用 小数表示,且适用于任何溶液。而溶解度仅适用于⑦ 饱和 溶液。 4.溶解度的影响因素 (1)KNO 3 的溶解度随温度升高而显著⑧ 增大 ;NaCl的溶解度也随温度 升高而⑨ 增大 ,但变化趋势不如KNO 3 的大;Ca(OH) 2 的溶解度随温度的 升高而减小。 (2)气体的溶解度随温度的升高而减小,随压强的增大而增大。 5.有关溶质质量分数的计算 (1) ω =⑩ × 100%= × 100%。 (2) ω = × 100%(饱和溶液,溶解度为 S )。 三、胶体 1.定义:分散质粒子直径介于1~100 nm之间的分散系。 2.特征 (1)外观特征:均一。 (2) 本质特征:胶体粒子直径介于1~100 nm之间 。 按照存在状态的不同,将胶体分为三类: (1) 气 溶胶,如烟、云、雾; (2) 液 溶胶,如AgI水溶胶; (3) 固 溶胶,如烟水晶、有色玻璃。 4.性质 (1)丁达尔效应 当光束通过胶体时,可以看到一条光亮的“通路”。这是胶体粒子对光线 散射 形成的,叫作丁达尔效应。 3.分类 说明 a.丁达尔效应是物理现象; b.利用丁达尔效应可区别溶液和胶体 ; c.丁达尔效应能证明分散质粒子直径的大小范围; d.当光束通过胶体时,看到的光亮的“通路”是胶体粒子对光线散射形成 的,并不是胶体粒子本身发光。 (2)介稳性 胶体的稳定性介于溶液和浊液之间,在一定条件下能稳定存在,属于介稳体 系。 写出制备Fe(OH) 3 胶体的离子方程式: Fe 3+ +3H 2 O Fe(OH) 3 (胶体)+3H + 。 5.Fe(OH) 3 胶体的制备 核心精讲 几种分散系的比较 溶液 胶体 浊液 分散质粒子 直径的大小 <1 nm 1~100 nm >100 nm 分散质粒子 单个小分子或离子 许多分子的集 合体或高分子 巨大数目分子的集合体 实例 乙醇溶液、氯化钠溶液 Fe(OH) 3 胶体 石灰乳、油水 混合液 性 质 外观 均一、透明 均一 不均一、不透明 稳定性 稳定 较稳定 不稳定 能否透过滤纸 能 能 不能 能否透过半透膜 能 不能 不能 鉴别 无丁达尔效应 有丁达尔效应 静置分层 溶液 胶体 浊液 1.理解物质变化的“四个方面” (1)从宏观上看,有新物质生成的变化是化学变化,反之则为物理变化。这 里的新物质生成所能实现的仅是原子与分子(或离子)的相互转化,在整个 过程中原子核没有发生改变。一种原子变为另一种原子涉及原子核的变 化,不属于化学变化。 (2)从微观上看,化学变化过程中有旧化学键的断裂,同时又有新化学键的 形成,但有化学键断裂的变化未必就是化学变化,如NaCl晶体、SiO 2 晶体的 熔化,分别破坏了离子键、共价键,但属于物理变化。 (3)从能量上看,化学变化中一定伴随能量变化,而有能量变化的过程却不 一定是化学变化;物理变化中有的有能量变化,有的无能量变化。 知能拓展 (4)化学变化过程中一定伴有物理变化,观察到一定的实验现象并不一定发 生了化学变化。 2.胶体知识“9”提醒 (1)胶体区别于其他分散系的本质特征是胶体分散质颗粒直径在1~100 nm 之间。 (2)胶体的物理性质:①丁达尔效应;②电泳现象;③介稳性等。 (3)胶体微粒一般是离子、分子或难溶物的聚集体,但有些高分子化合物, 如淀粉、蛋白质,因它们的分子非常大,相对分子质量通常为几万、几十万 甚至上百万、上千万,因此一个分子就是一个胶体微粒,它们分散到水中可 形成胶体。 (4)区分胶体和其他分散系的最简便方法是利用丁达尔效应。 (5)胶体具有介稳性的主要原因是同种胶体粒子带有相同电荷。 (6)胶体的电泳现象反映了胶体粒子带有电荷,但不能说成胶体带有电荷。 胶体与溶液都是电中性的。 (7)在Fe(OH) 3 胶体中,Fe(OH) 3 胶体粒子的数目要远远小于原FeCl 3 溶液中Fe 3+ 的数目。 (8)向Fe(OH) 3 胶体中逐滴加入强酸(如盐酸、硫酸)时,出现的现象为先产生 沉淀后溶解。开始时出现沉淀是由于胶体中加入了电解质发生了聚沉,后 来沉淀消失是由于发生了反应。 (9)胶体粒子的直径在1~100 nm之间,它决定了胶体粒子具有较大的比表面 积,吸附能力很强,能在水中吸附悬浮固体或色素,从而达到净化水的目的, 这就是胶体净水的原理。能在水中形成胶体,并且对水质无明显副作用的 物质有KAl(SO 4 ) 2 ·12H 2 O、FeCl 3 ·6H 2 O等,这样的物质被称为净水剂,它们形 成胶体的化学原理是Al 3+ 、Fe 3+ 发生水解反应生成Al(OH) 3 胶体、Fe(OH) 3 胶体。 例 (2019安徽阜阳二模,7)科学家发现了利用泪液来检测糖尿病的方法, 其原理是用氯金酸钠(NaAuCl 4 )溶液与溶液中的葡萄糖发生反应生成纳米 金单质颗粒(直径为20~60 nm)。下列有关说法错误的是 ( ) A.氯金酸钠中金元素的化合价为+3价 B.葡萄糖具有还原性 C.检测时,NaAuCl 4 发生氧化反应 D.纳米金单质颗粒分散在水中所得的分散系能产生丁达尔效应 解题导引 化学的魅力在于合成新物质。以科技成果为背景,让学生通过 试题情境认识化学学科价值,从而增长见识。 解析 A项,Na元素为+1价,Cl元素为-1价,则氯金酸钠中Au元素的化合价 为+3价,故A项正确;B项,葡萄糖分子中含有醛基,具有还原性,故B项正确;C 项,氯金酸钠变为金,金元素化合价降低,发生还原反应,故C项错误;D项,纳 米金单质颗粒直径为20~60 nm,分散在水中所得的分散系为胶体,故D项正 确。 答案 C 1.化学与社会是紧密联系的,应注意以生活情境为背景创设的题目,考查学 生综合运用所学的化学知识和技能分析、解决与化学有关的实际问题的 能力。 例1 (2019 5·3原创冲刺卷四,7)2018年10月7日,国务院督查组对京津冀及 周边地区进行环境督查,发现VOCs整治不到位问题。VOCs(volatile organic compounds,挥发性有机物)是指常温常压下任何能挥发的有机固体或液 体。空气中VOCs浓度过高时很容易引起人体急性中毒。下列不需要考虑 VOCs整治的是 ( ) 实践探究 A.餐饮服务行业 B.建筑装饰装修行业 C.汽油储存、运输和销售行业 D.果蔬批发行业 解析 餐饮服务行业炒菜的烟气中含有挥发出来的食用油蒸气;建筑装饰 装修材料会挥发出甲醛;汽油储存、运输和销售过程中会挥发出气态烃,这 些都属于挥发性有机物(VOCs),需要整治。果蔬自然挥发出的香气虽然是 挥发性有机物,但极微少,无害,无需整治,所以D正确。 答案 D 题目价值 真实、具体且富有价值的问题情境是化学学科核心素养形成 和发展的重要平台,为化学学科核心素养提供了真实的表现机会。 2.物质分类方法多种多样,应注意从多角度对物质进行分类,提高迁移应用 的能力。 例2 (2019 5·3原创冲刺卷三,7)下列有关物质的分类正确的是 ( ) A.空气和泥浆均属于非均匀混合物 B.石油原油的脱水,塑料、橡胶及合成纤维的制备均与胶体有关 C.葡萄糖、淀粉、油脂等有机化合物都为非电解质 D.古代陶瓷、现代玻璃、蓝宝石、红宝石均属于硅酸盐产品 解析 空气为均匀混合物,泥浆属于非均匀混合物,故A不正确;淀粉、油脂 均为混合物,不是非电解质,故C不正确;红宝石、蓝宝石的主要成分为氧化 铝,故D不正确。 答案 B 题目价值 能根据物质组成和性质对物质进行分类,形成物质是由元素组 成和化学变化中元素种类不变的观点。了解生活中常用材料的组成与性 能,认识化学在日用材料的发展中的重要作用。查看更多