- 2021-05-08 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学考前三个月专题练习9水溶液中的离子平衡
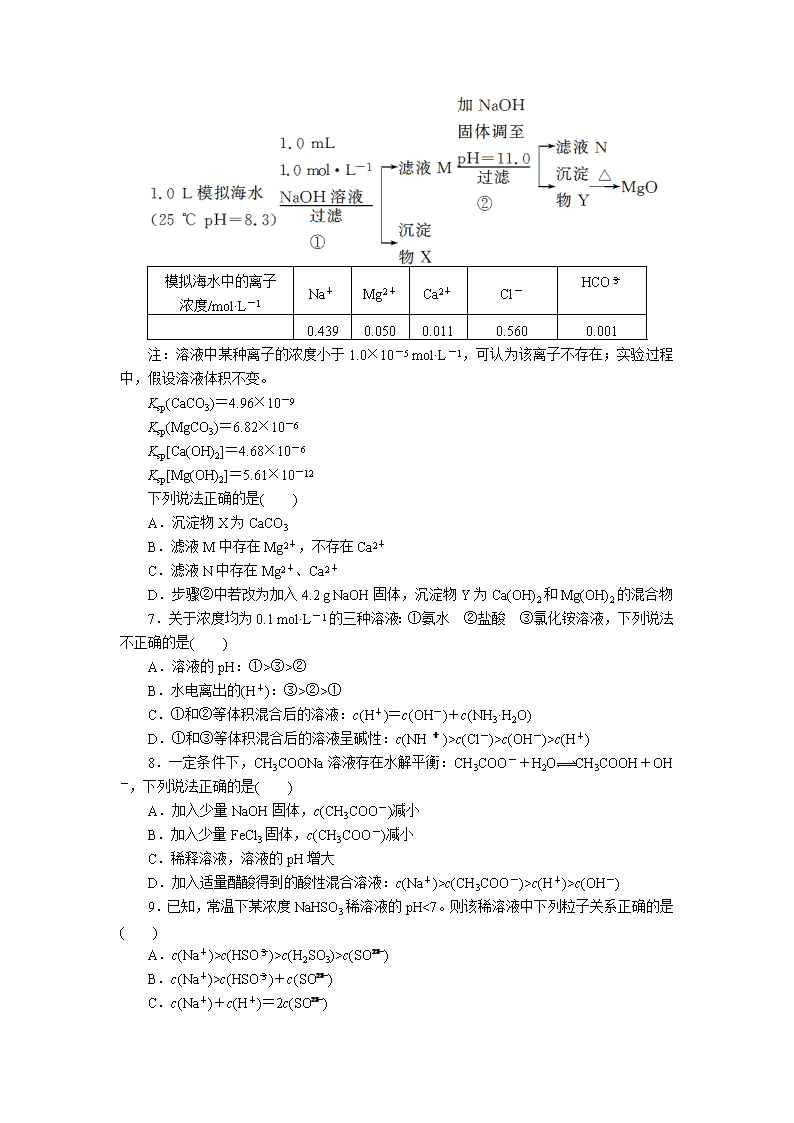
2013 届高考化学复习卷-专练 9 水溶液中的离子平衡 1.(2011·四川理综,9)25 ℃时,在等体积的①pH=0 的 H2SO4 溶液、②0.05 mol·L-1 的 Ba(OH)2 溶液、③pH=10 的 Na2S 溶液、④pH=5 的 NH4NO3 溶液中,发生电离的水的物质 的量之比是( ) A.1∶10∶1010∶109 B.1∶5∶5×109∶5×108 C.1∶20∶1010∶109 D.1∶10∶104∶109 2.(2011·福建理综,10)常温下 0.1 mol·L-1 醋酸溶液的 pH=a,下列能使溶液 pH=(a +1)的措施是( ) A.将溶液稀释到原体积的 10 倍 B.加入适量的醋酸钠固体 C.加入等体积 0.2 mol·L-1 盐酸 D.提高溶液的温度 3.(2011·山东理综,14)室温下向 10 mL pH=3 的醋酸溶液中加水稀释后,下列说法正 确的是( ) A.溶液中导电粒子的数目减少 B.溶液中 c(CH3COO-) c(CH3COOH)·c(OH-) 不变 C.醋酸的电离程度增大,c(H+)亦增大 D.再加入 10 mL pH=11 的 NaOH 溶液,混合液 pH=7 4.(2011·广东理综,11)对于 0.1 mol·L-1Na2SO3 溶液,正确的是( ) A.升高温度,溶液 pH 降低 B.c(Na+)=2c(SO2- 3 )+c(HSO- 3 )+c(H2SO3) C.c(Na+)+c(H+)=2c(SO2- 3 )+2c(HSO- 3 )+c(OH-) D.加入少量 NaOH 固体,c(SO2- 3 )与 c(Na+)均增大 5.(2011·天津理综,4)25 ℃时,向 10 mL 0.01 mol·L-1 KOH 溶液中滴加 0.01 mol·L-1 苯酚溶液,混合溶液中粒子浓度关系正确的是( ) A.pH>7 时,c(C6H5O-)>c(K+)>c(H+)>c(OH-) B.pH<7 时,c(K+)>c(C6H5O-)>c(H+)>c(OH-) C.V[C6H5OH(aq)]=10 mL 时,c(K+)=c(C6H5O-)>c(OH-)=c(H+) D.V[C6H5OH(aq)]=20 mL 时,c(C6H5O-)+c(C6H5OH)=2c(K+) 6.(2011·浙江理综,13)海水中含有丰富的镁资源。某同学设计了从模拟海水中制备 MgO 的实验方案: 模拟海水中的离子 浓度/mol·L-1 Na+ Mg2+ Ca2+ Cl- HCO- 3 0.439 0.050 0.011 0.560 0.001 注:溶液中某种离子的浓度小于 1.0×10-5 mol·L-1,可认为该离子不存在;实验过程中, 假设溶液体积不变。 Ksp(CaCO3)=4.96×10-9 Ksp(MgCO3)=6.82×10-6 Ksp[Ca(OH)2]=4.68×10-6 Ksp[Mg(OH)2]=5.61×10-12 下列说法正确的是( ) A.沉淀物 X 为 CaCO3 B.滤液 M 中存在 Mg2+,不存在 Ca2+ C.滤液 N 中存在 Mg2+、Ca2+ D.步骤②中若改为加入 4.2 g NaOH 固体,沉淀物 Y 为 Ca(OH)2 和 Mg(OH)2 的混合物 7.关于浓度均为 0.1 mol·L-1 的三种溶液:①氨水 ②盐酸 ③氯化铵溶液,下列说法 不正确的是( ) A.溶液的 pH:①>③>② B.水电离出的(H+):③>②>① C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O) D.①和③等体积混合后的溶液呈碱性:c(NH+4)>c(Cl-)>c(OH-)>c(H+) 8.一定条件下,CH3COONa 溶液存在水解平衡:CH3COO-+H2O CH3COOH+OH-, 下列说法正确的是( ) A.加入少量 NaOH 固体,c(CH3COO-)减小 B.加入少量 FeCl3 固体,c(CH3COO-)减小 C.稀释溶液,溶液的 pH 增大 D.加入适量醋酸得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) 9.已知,常温下某浓度 NaHSO3 稀溶液的 pH<7。则该稀溶液中下列粒子关系正确的是 ( ) A.c(Na+)>c(HSO- 3 )>c(H2SO3)>c(SO2- 3 ) B.c(Na+)>c(HSO- 3 )+c(SO2- 3 ) C.c(Na+)+c(H+)=2c(SO2- 3 ) D.c(Na+)+c(H+)=c(HSO- 3 )+c(OH-) 10.在 t ℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如下图所示。 又知 AgCl 的 Ksp=1.8×10-10。下列说法不正确的是( ) A.t ℃时,Ag2CrO4 的 Ksp 为 1×10-8 B.在饱和 Ag2CrO4 溶液中加入 K2CrO4 不能使溶液由 Y 点变为 X 点 C.t ℃时,Y 点和 Z 点时 Ag2CrO4 的 Ksp 相等 D.t ℃时,将 0.01 mol·L-1 AgNO3 溶液滴入 20 mL 0.01 mol·L-1 KCl 和 0.01 mol·L-1 K2CrO4 的混合溶液中,Cl-先沉淀 11.下列关于电解质溶液的叙述正确的是( ) A.常温下,在 pH=7 的醋酸钠和醋酸混合溶液中,c(CH3COO-)>c(Na+) B.稀释醋酸溶液,溶液中所有离子的浓度均降低 C.在 pH=5 的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl-) D.在 0.1 mol·L-1 的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) 12.下列关于电解质溶液的叙述正确的是( ) A.中和 pH 与体积都相同的盐酸和硫酸,消耗 NaOH 的物质的量之比是 1∶2 B.pH=13 的氨水加水稀释后,溶液中所有离子的浓度均降低 C . 浓 度 均 为 0.1 mol·L - 1 的 下 列 溶 液 , pH 由 大 到 小 排 列 顺 序 为 NaOH>Na2CO3>NaHSO4>(NH4)2SO4 D.0.1 mol·L-1 的硫酸铵溶液中,离子浓度大小顺序为 c(NH+4)>c(SO2- 4 )>c(H+)>c(OH-) 13.下列叙述正确的是( ) A.0.1 mol·L-1 氨水中,c(OH-)=c(NH+4) B. 10 mL 0.02 mol·L-1 HCl 溶液与 10 mL 0.02 mol·L-1 Ba(OH)2 溶液充分混合,若混合后 溶液的体积为 20 mL,则溶液的 pH=12 C.在 0.1 mol·L-1 CH3COONa 溶液中,c(OH-)>c(CH3COOH)+c(H+) D.0.1 mol·L-1 某二元弱酸强碱盐 NaHA 溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A) 14.常温下,物质的量浓度均为 0.1 mol·L-1 的两溶液 HA、BOH,HA 溶液的 pH>1, BOH 溶液中c(OH-) c(H+) =1012。下列有关说法正确的是( ) A.取等体积的 HA、BOH 溶液稀释相同的倍数,pH 变化较大的是 HA B.HA 溶液中水的电离程度小于 BOH 溶液中水的电离程度 C.若两溶液混合时:V(BOH)≥V(HA),则混合液中必有 c(B+)>c(A-) D.若两溶液混合后所得溶液的 pH=7,则混合液中必有 c(B+)=c(HA)+c(A-) 15.常温下,向 10 mL 0.1 mol·L-1 NaOH 溶液中逐滴加入 0.1 mol·L-1 醋酸溶液,所得 滴定曲线如图所示。下列说法正确的是( ) A.pH<7 时,溶液中:c(CH3COO-)查看更多