- 2021-05-08 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学第一轮复习课件第2讲 分子结构与性质-11分子间作用力与分子的性质
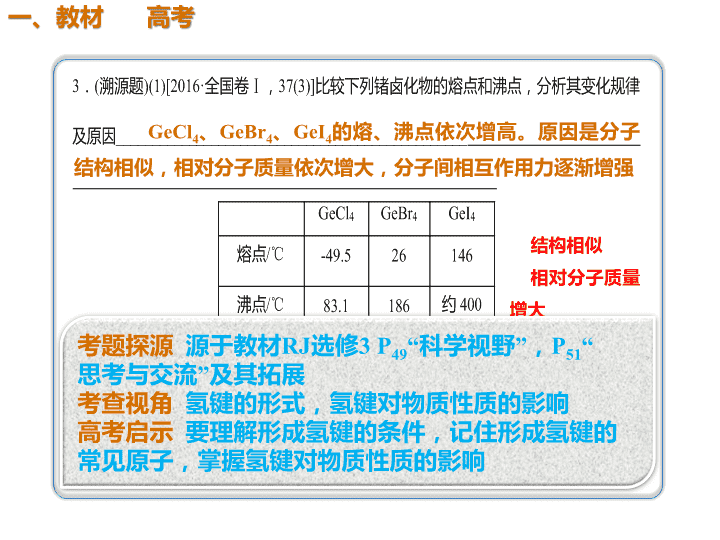
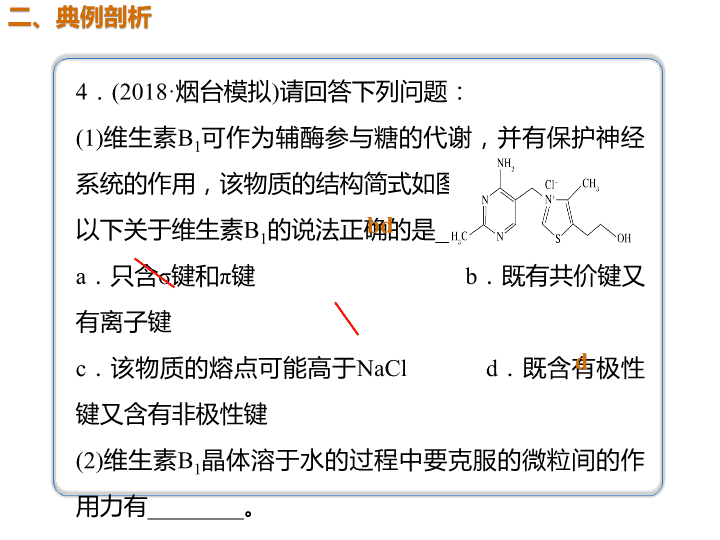
GeCl4、GeBr4、GeI4的熔、沸点依次增高。原因是分子 结构相似,相对分子质量依次增大,分子间相互作用力逐渐增强 高于 NH3分子间可形成氢键 极性 sp3 结构相似 相对分子质量 增大 4.(2018·烟台模拟)请回答下列问题: (1)维生素B1可作为辅酶参与糖的代谢,并有保护神经 系统的作用,该物质的结构简式如图所示: 以下关于维生素B1的说法正确的是________。 a.只含σ键和π键 b.既有共价键又 有离子键 c.该物质的熔点可能高于NaCl d.既含有极性 键又含有非极性键 (2)维生素B1晶体溶于水的过程中要克服的微粒间的作 用力有________。 a.离子键、共价键 b.离子键、氢键、共价 键 c.氢键、范德华力 d.离子键、氢键、范德 华力 bd d CO2 氨气分子为极性分子,易溶于极性溶剂水中,氨气分子与水分子 间易形成氢键,氨气可与水反应 氢键、范德华力 非极性键 分子晶 体 解析 (1)由结构简式知,维生素B1中含有Cl-及另一种有机离子, 存在离子键,其他原子之间形成共价键,故a错误、b正确;与 氯化钠晶体相比,维生素B1中的阳离子比Na+半径大,晶格能小, 熔点不可能高于NaCl,故c错误;维生素B1中碳碳键为非极性键, 氮氢键、氧氢键、碳氢键等为极性键,故d正确。 (2)晶体溶于水的过程会电离出Cl-等,故需要克服离子键,维生 素B1分子间存在氢键、范德华力,故d正确。 (3)N2为单质,另外五种化合物中属于非极性分子的是CO2。NH3 极易溶于水,是因为NH3和水均为极性分子,NH3溶于水后, NH3与水之间可形成氢键,NH3可与水反应。 (4)液氨汽化破坏了分子间作用力,包括氢键和范德华力;氨气 分解生成N2和H2,破坏了氮氢极性键;N2、H2生成氮原子和氢 原子,破坏了非极性键。 无机含氧酸分子的酸性判断及比较的思维方法 (1)无机含氧酸分子之所以能显示酸性,是因 为其分子中含有—OH,而—OH上的H原子在 水分子的作用下能够变成H+而显示一定的酸 性。如HNO3、H2SO4的结构式分别是 (2)同一种元素的含氧酸酸性规律 H2SO4与HNO3是强酸,其—OH上的H原子能 够完全电离成为H + 。而同样是含氧酸的 H2SO3和HNO2却是弱酸。即酸性强弱为H2SO3 <H2SO4,HNO2<HNO3。其他的有变价的非 金属元素所形成的含氧酸也有类似的情况。 如酸性强弱HClO<HClO2<HClO3<HClO4。 不难得出:对于同一种元素的含氧酸来说, 该元素的化合价越高,其含氧酸的酸性越强。查看更多