- 2021-05-08 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学名师讲练大一轮复习方略人教通用版题组训练过关 第9讲 考点2 3-3铁及其化合物的转化及其应用
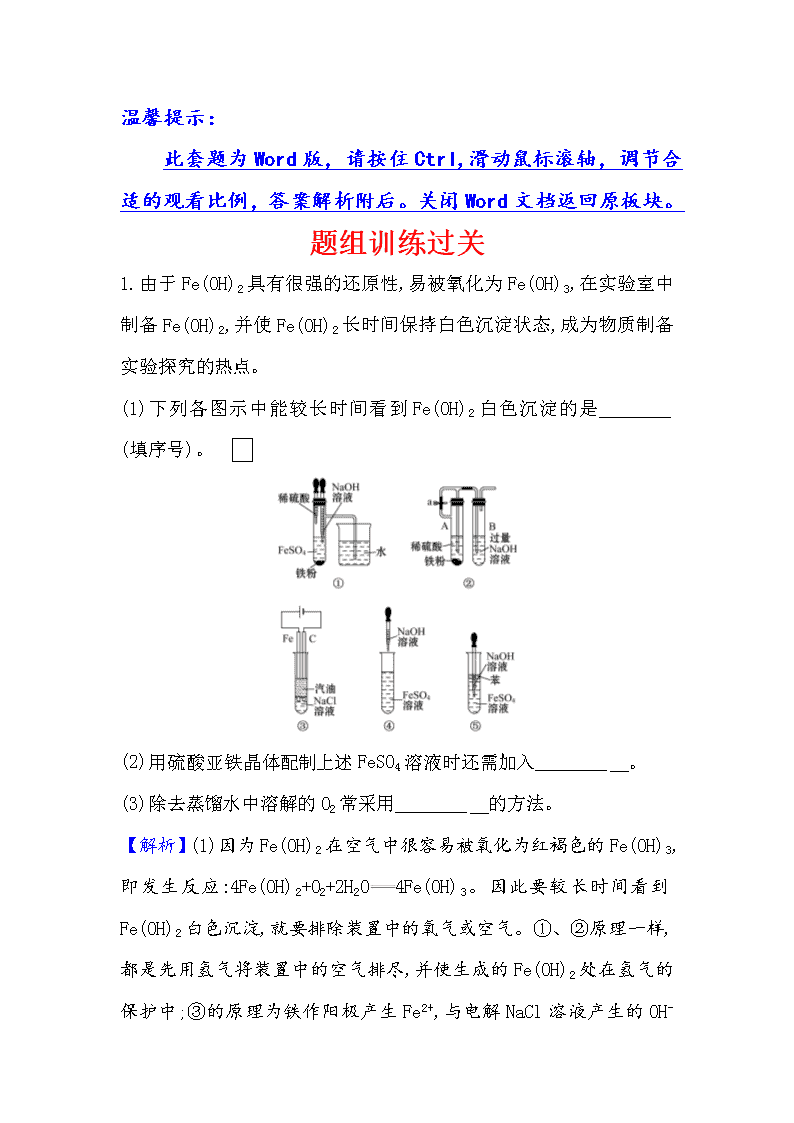
温馨提示: 此套题为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,答案解析附后。关闭Word文档返回原板块。 题组训练过关 1.由于Fe(OH)2具有很强的还原性,易被氧化为Fe(OH)3,在实验室中制备Fe(OH)2,并使Fe(OH)2长时间保持白色沉淀状态,成为物质制备实验探究的热点。 (1)下列各图示中能较长时间看到Fe(OH)2白色沉淀的是________ (填序号)。 (2)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入________ 。 (3)除去蒸馏水中溶解的O2常采用________ 的方法。 【解析】(1)因为Fe(OH)2在空气中很容易被氧化为红褐色的Fe(OH)3,即发生反应:4Fe(OH)2+O2+2H2O4Fe(OH)3。因此要较长时间看到Fe(OH)2白色沉淀,就要排除装置中的氧气或空气。①、②原理一样,都是先用氢气将装置中的空气排尽,并使生成的Fe(OH)2处在氢气的保护中;③的原理为铁作阳极产生Fe2+,与电解NaCl溶液产生的OH- 结合生成Fe(OH)2,且液面用汽油保护,能防止空气进入;⑤中液面加苯阻止了空气进入;④由于带入空气中的氧气,能迅速将Fe(OH)2氧化,因而不能较长时间看到白色沉淀。(2)稀硫酸抑制Fe2+水解。(3)Fe(OH)2很容易被氧化,实验过程中要确保在无氧条件下生成。 答案:(1)①②③⑤ (2)稀硫酸 (3)加热煮沸 2.铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述白色沉淀和红棕色残渣分别是 ( ) A.Fe(OH)3 Fe2O3 B.Fe(OH)2 Fe2O3 C.Fe(OH)2 Fe(OH)3 D.Fe(OH)2 FeO 【解析】选B。铁与稀硫酸反应生成FeSO4,再与过量氨水反应生成白色沉淀Fe(OH)2,在空气中加热生成Fe(OH)3,铁元素被氧化为+3价,最后所得红棕色残渣为Fe2O3。 【加固训练】 1.砖瓦是用含铁等元素的黏土隔绝空气烧制而成的;当烧窑作业临近结束时,若用淋水的办法来降低温度,窑内处于还原性气氛,则砖呈青色,称青砖;若用捅开窑顶自然冷却的办法,则砖呈红色,称红砖。由此判断砖块中的成分,错误的是 ( ) A.砖块中的主要成分是硅酸盐 B.青砖中的铁元素主要以氢氧化亚铁的形式存在 C.红砖中的铁元素主要以氧化铁的形式存在 D.青砖中的铁元素主要以氧化亚铁的形式存在 【解析】选B。砖瓦的主要成分是硅酸盐, A正确;青砖块中的铁以氧化亚铁的形式存在,因而砖呈青色, B错误,D正确;红砖中的铁元素主要以氧化铁的形式存在,铁元素被氧化生成Fe2O3而呈红色, C正确。 2.下列离子方程式书写正确的是 ( ) A.FeO固体放入稀硝酸中:FeO+2H+Fe2++H2O B.过量的铁粉与稀硝酸反应:Fe+4H++NFe3++NO↑+2H2O C.Fe(OH)2放入稀硝酸中:Fe(OH)2+3H+Fe2++3H2O D.向Fe(OH)3中加入氢碘酸:2Fe(OH)3+6H++2I-2Fe2++I2+6H2O 【解析】选D。稀硝酸为氧化性酸,FeO、Fe(OH)2中+2价的Fe被氧化为Fe3+,A、C错误;铁粉过量时,生成的Fe3+与Fe继续反应生成Fe2+,B错误;I-具有较强的还原性,因而氢碘酸可把Fe(OH)3还原为Fe2+,D正确。 【归纳提升】 1.Fe(OH)2具有很强的还原性,易被氧化为Fe(OH)3。在实验室中制备Fe(OH)2,并使Fe(OH)2长时间保持白色沉淀状态,关键注意以下两点: (1)溶液中不含Fe3+和O2等氧化性物质; (2)制备过程中,保证生成的Fe(OH)2在密闭的隔绝空气的体系中。 2.防止Fe(OH)2氧化的方法 (1)将配制溶液的蒸馏水煮沸,排出溶解的氧气。 (2)将盛有氢氧化钠溶液的胶头滴管尖端插入试管里的亚铁盐溶液底部,再慢慢挤出NaOH溶液。 (3)在亚铁盐溶液上面加保护层,例如苯或植物油等。 关闭Word文档返回原板块查看更多