- 2021-05-07 发布 |
- 37.5 KB |
- 10页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】福建省厦门市双十中学2020届高三下第一次月考
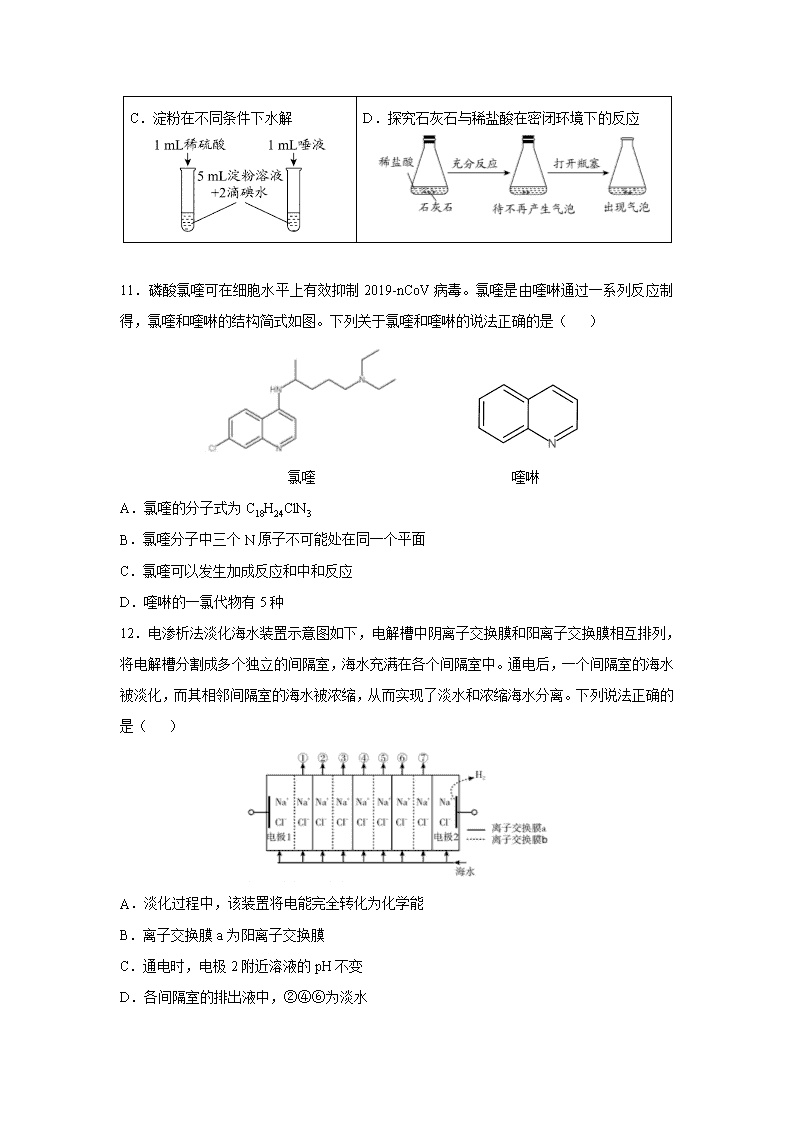
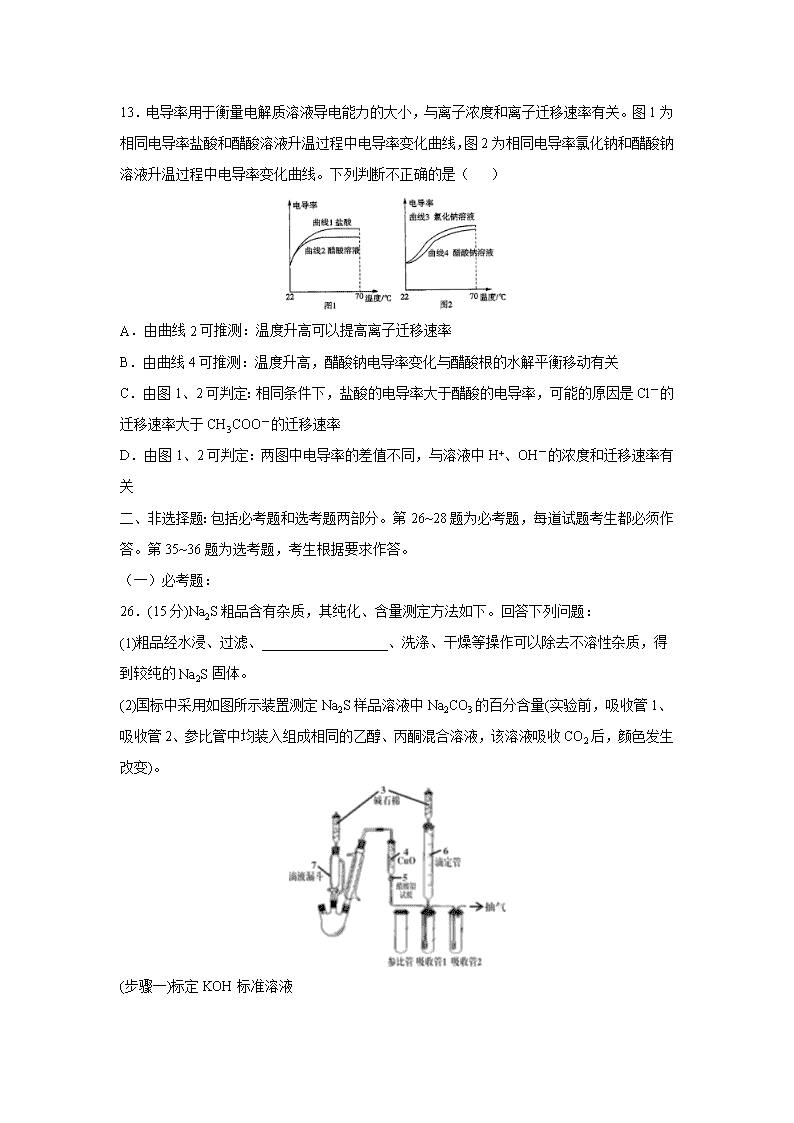
福建省厦门市双十中学2020届高三下第一次月考 可能用到的相对原子质量:H-1 C-12 N-14 O-16 Si-28 Cl-35.5 K-39 Ga-70 Br-80 一、选择题:本题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7.宋代周密的《癸辛杂识》记载:“适有一物,如小桶而无底,非竹,非木,非金,非石……幸以告我”商曰“此至宝也,其名曰海井。寻常航海必须载淡水自随,今但以大器满贮海水,置此井于水中,汲之皆甘泉也。”“海井”的作用是( ) A.过滤 B.萃取 C.蒸馏 D.离子交换 8.NA代表阿伏加德罗常数的值,下列有关叙述正确的是( ) A.标准状况下,铁在22.4 L氯气中完全燃烧时转移电子数为3NA B.1 L 0.1 mol·L-1的NaHCO3溶液中HCO和CO离子数之和为0.1NA C.含有NA个Fe(OH)3胶粒的氢氧化铁胶体中,铁元素的质量为56 g D.常温常压下,NO2与N2O4的混合气体46 g,所含氧原子数为2NA 9.分属周期表前三周期的四种元素W、X、Y、Z可形成结构如下的物质,该物质中所有原子均满足稳定结构,W的原子序数最大,Y、Z处于同一周期。下列说法错误的是( ) A.X、Z可形成具有强氧化性的高效消毒剂 B.Y的最高价氧化物对应的水化物中,除了氢原子外所有原子满足8电子稳定结构 C.由Z和W形成的化合物中可以存在共价键 D.X、Y、Z的原子半径从大到小为: Y > Z >X 10.下列实验操作或现象不能用平衡移动原理解释的是 ( ) A.卤化银沉淀的转化 B.配制FeCl3溶液 溶解 C.淀粉在不同条件下水解 D.探究石灰石与稀盐酸在密闭环境下的反应 11.磷酸氯喹可在细胞水平上有效抑制2019-nCoV病毒。氯喹是由喹啉通过一系列反应制得,氯喹和喹啉的结构简式如图。下列关于氯喹和喹啉的说法正确的是( ) 氯喹 喹啉 A.氯喹的分子式为C18H24ClN3 B.氯喹分子中三个N原子不可能处在同一个平面 C.氯喹可以发生加成反应和中和反应 D.喹啉的一氯代物有5种 12.电渗析法淡化海水装置示意图如下,电解槽中阴离子交换膜和阳离子交换膜相互排列,将电解槽分割成多个独立的间隔室,海水充满在各个间隔室中。通电后,一个间隔室的海水被淡化,而其相邻间隔室的海水被浓缩,从而实现了淡水和浓缩海水分离。下列说法正确的是( ) A.淡化过程中,该装置将电能完全转化为化学能 B.离子交换膜a为阳离子交换膜 C.通电时,电极2附近溶液的pH不变 D.各间隔室的排出液中,②④⑥为淡水 13.电导率用于衡量电解质溶液导电能力的大小,与离子浓度和离子迁移速率有关。图1为相同电导率盐酸和醋酸溶液升温过程中电导率变化曲线,图2为相同电导率氯化钠和醋酸钠溶液升温过程中电导率变化曲线。下列判断不正确的是( ) A.由曲线2可推测:温度升高可以提高离子迁移速率 B.由曲线4可推测:温度升高,醋酸钠电导率变化与醋酸根的水解平衡移动有关 C.由图1、2可判定:相同条件下,盐酸的电导率大于醋酸的电导率,可能的原因是Cl-的迁移速率大于CH3COO-的迁移速率 D.由图1、2可判定:两图中电导率的差值不同,与溶液中H+、OH-的浓度和迁移速率有关 二、非选择题:包括必考题和选考题两部分。第26~28题为必考题,每道试题考生都必须作答。第35~36题为选考题,考生根据要求作答。 (一)必考题: 26.(15分)Na2S粗品含有杂质,其纯化、含量测定方法如下。回答下列问题: (1)粗品经水浸、过滤、__________________、洗涤、干燥等操作可以除去不溶性杂质,得到较纯的Na2S固体。 (2)国标中采用如图所示装置测定Na2S样品溶液中Na2CO3的百分含量(实验前,吸收管1、吸收管2、参比管中均装入组成相同的乙醇、丙酮混合溶液,该溶液吸收CO2后,颜色发生改变)。 (步骤一)标定KOH标准溶液 准确称取w g邻苯二甲酸氢钾(KC8H5O4)置于锥形瓶中,加入适量蒸馏水、2滴指示剂,用待标定的KOH溶液滴定至终点,消耗V mL KOH溶液。 ①标定过程中应该选用的指示剂名称是________,说明理由是______________________________________________________; (已知邻苯二甲酸的电离平衡常数为Ka1=1.1×10-3,Ka2=4.0×10-6) ②KOH溶液的准确浓度为_____________mol·L-1(用含V、w的代数式表示) (步骤二)往三颈烧瓶中先后加入100mL样品溶液、15 mL过氧化氢溶液(足量),连接好装置,加热并打开抽气装置; (步骤三)上述反应完成后,从滴液漏斗中慢慢加入足量稀硫酸溶液,充分反应; (步骤四)用装置6中的KOH标准溶液滴定吸收管1中的溶液至与参比管中溶液相同的颜色,3 min内不变色为终点。 ③过氧化氢的作用是_________________;碱石棉的作用是___________________________; ④如果抽气速度过快,可能导致测定结果_________(填“偏高”、“偏低”或“无影响”); ⑤若步骤三中出现____________________________(填现象),说明实验失败,必须重新测定。 27.(14分)阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如下图所示: (1)电解饱和食盐水的化学方程式为_______________________________________________。 (2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是________(填字母序号)。 a.Na2SO4 b.Na2SO3 c.热空气吹出 d.降低阳极区液面上方的气压 (3)食盐水中的I-若进入电解槽,可被电解产生的Cl2氧化为ICl,进一步转化为IO3-。IO3-可继续被氧化为高碘酸根(IO4-),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。 ①从原子结构的角度解释ICl中碘元素的化合价为+1价的原因:_______________________。 ②NaIO3被氧化为NaIO4的化学方程式为___________________________________________。 (4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如右图所示。已知:吸光度越高表明该体系中c(I2)越大。 ①结合化学用语解释10 min时不同pH体系吸光度不同的原因:____________________________________________。 ②pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因:__________________________。 ③研究表明食盐水中I-含量≤0.2 mg·L-1时对离子交换膜影响可忽略。现将1m3含I-浓度为1.47 mg·L-1的食盐水进行处理,为达到使用标准,理论上至少需要0.05 mol·L-1NaClO溶液________mL。(已知NaClO的反应产物为NaCl,溶液体积变化忽略不计) 28.硼(B)可形成H3BO3、NaBH4、NaBO2等化合物,用途广泛。 (1)H3BO3为一元弱酸,可由硼砂(Na2B4O7·10H2O)与盐酸加热反应制得。该反应的化学方程式为_________________________________________________。常温下0.1 mol·L-1的H3BO3溶液pH约为5.0, 则H3BO3的电离常数Ka 约为___________。 (2)在恒容密闭容器中发生储氢反应: BPO4(s)+4Na(s)+ 2H2(g)Na3PO4(s)+ NaBH4(s) △H<0 图(a)为NaBH4产率与反应温度的关系曲线: ①反应达到平衡时,下列有关叙述正确的是______(填标号)。 A.生成1molNaBH4只需1molBPO4、4molNa和2molH2 B.若向容器内通入少量H2,则v(放氢)< v(吸氢) C.升高温度,放氢速率加快,重新达到平衡时容器压强增大 D.降低温度,该反应的平衡常数减小 ②NaBH4的产率在603K之前随温度升高而增大的原因是_____________________________。 (3)NaBH4可水解放出氢气,反应方程式为:NaBH4+ 2H2O===NaBO2+ 4H2↑。 ①t1/2为NaBH4水解的半衰期(水解一半所需要的时间,单位为分钟)。lgt1/2随pH和温度的变化如图(b)所示。在酸性条件下,NaBH4不能稳定存在,原因是_________________________ (用离子方程式表示);T1_____T2 (填“>”或“<”)。 图(b) 图(c) ②用H2制备H2O2的一种工艺简单、能耗低的方法,反应原理如图(c)所示。总反应的化学方程式为_____________________________________________。 (二)选考题:共45分。请考生从给出的2道化学题中任选一题作答。如果多答,则每科按所答的第一题计分。 35.[化学——选修3:物质结构与性质](15分) 镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料,应用于航空航天测控、光纤通讯等领域。回答下列问题: (1)硒常用作光敏材料,基态硒原子的核外电子排布式为__________;与硒同周期的p区元素中第一电离能大于硒的元素有__________种;SeO3的空间构型是_______________。 (2)根据元素周期律,原子半径Ga______As,第一电离能Ga________As。(填“大于”或“小于”) (3)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是____________。硅与氢结合能形成一系列的二元化合物SiH4、Si2H6等,与氯、溴结合能形成SiCl4、SiBr4,上述四种物质沸点由高到低顺序为_______________,丁硅烯(Si4H8)中σ键与π键个数之比为_________。 (4)GaN、GaP、GaAs都是很好的半导体材料,熔点如下表所示,分析其变化原因_______________________________________________________________________。 GaN GaP GaAs 熔点 1700℃ 1480℃ 1238℃ (5)GaN晶胞结构如图1所示。已知六棱柱底边边长为a pm,阿伏加德罗常数的值为NA。 ①晶胞中Ga原子采用六方最密堆积,每个Ga原子周围距离最近的Ga原子数目为______; ②从GaN晶体中“分割”出的平行六面体如图2。若该平行六面体的高为a pm,GaN晶体的密度为__________g/cm3(用a、NA表示)。 图1 图2 36.[选修5-有机化学基础] (15分) 新型冠状病毒引起了全世界的关注。国外顶级医学期刊《新英格兰医学杂志》在2020年1月31号报道称:美国首例新型冠状病毒(2019-nCoV)感染患者,在住院第7天开始使用药物Remdesivir(瑞德西韦)治疗,经治疗后发烧症状消失,咳嗽减轻,病情明显好转!Remdesivir(瑞德西韦)的初步治疗效果引起了我国的高度重视。发现中间体K是合成该药物的关键中间体。 药物瑞德西韦(Remdesivir))对2019年新型冠状病毒(2019-nCoV)有明显抑制作用;K为药物合成的中间体,其合成路线如下: 回答下列问题: (1)B的化学名称为____________。 (2)J中含氧官能团的名称为________。 (3)B到C的反应类型______________。 (4)由G生成H的化学反应方程式为_____________________________。 (5)E中含两个Cl原子,则E的结构简式_________________________。 (6)X是C同分异构体,写出满足下列条件的X的结构简式_____________________________。 ①苯环上含有硝基且苯环上只有一种氢原子;②遇FeCl3溶液发生显色反应;③1mol的X与足量金属Na反应可生成2g H2。 (7)设计由苯甲醇为原料制备化合物。 【参考答案】 7 8 9 10 11 12 13 D D B C C B A 26.(15分) (1)蒸发浓缩、冷却结晶、过滤(2分) (2)①酚酞(1分) 滴定终点为邻苯二甲酸钾的水溶液,呈碱性(2分) ②(2分) ③氧化除去S2-(2分) 除去空气中的CO2(2分) ④偏低(2分) ⑤吸收管2中的溶液颜色发生明显变化(2分) 27.(14分)(1)2 NaCl + 2H2O C12↑ + H2↑+ 2NaOH(2分) (2)bcd (2分) (3)(2分)①碘元素和氯元素处于同一主族(VIIA),二者最外层电子数均为7,ICl中共用一对电(划线为2点,答出1点即得1分),由于碘原子半径大于氯原子(1分),碘原子得电子能力弱于氯原子,故共用电子对偏离碘原子,使得碘元素显+1价 ②Na+ +IO3- + Cl2 + H2O===NaIO4↓+ 2H+ + 2Cl-(2分) (4)①(2分)ClO-+ 2H+ + 2I-===I2 + Cl-+ H2O(1分),10 min时pH越低,c(H+)越大,反应速率加快(或ClO-氧化性增强),c(I2)越高(1分),吸光度越大 ②c(H+)较高,ClO-继续将I2_氧化为高价含碘微粒,c(I2)降低,吸光度下降(2分) ③100(2分) 28.(14分) (1)Na2B4O7·10H2O +2HCl4H3BO3+2NaCl+5H2O(2分) 1.0×10-9(2分) (2)①BC(2分) ②反应未达到平衡状态,温度升高,反应速率加快(2分) (3)①BH4-+H++3H2O===H3BO3+4H2↑(2分) <(2分) ②H2+O2H2O2(2分) 35.(15分) (1)[Ar]3d104s24p4(2分) 3(1分) 平面正三角形(1分) (2)大于(1分) 小于(1分) (3)SiBr4>SiCl4>Si2H6>SiH4(1分) 11:1 (2分) (4)三者均为原子晶体,原子半径N查看更多