- 2021-05-07 发布 |
- 37.5 KB |
- 16页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学刷题冲刺(含最新模拟题)专题六铁、铜及其化合物金属的冶炼习题
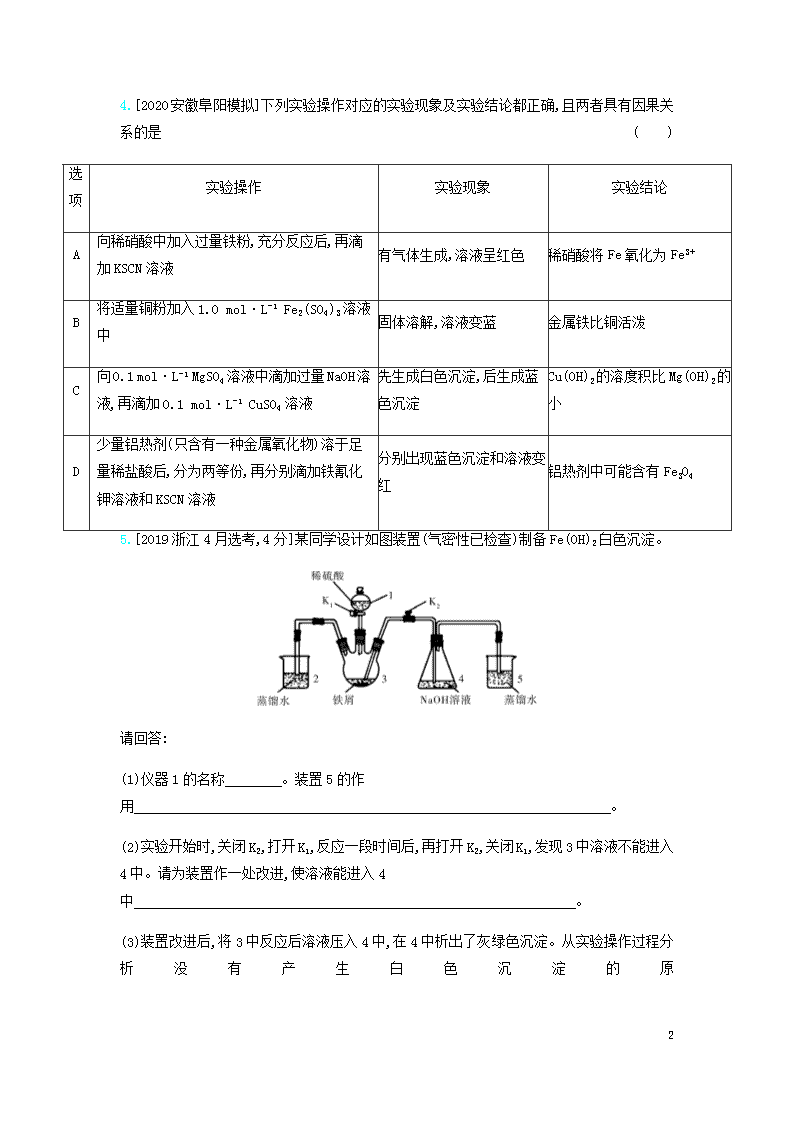
专题六 铁、铜及其化合物 金属的冶炼 考点1 铁及其重要化合物 1.[2020四川绵阳第一次诊断]下列实验操作或方法正确的是( ) A.检验某溶液中是否含有Fe2+时,先加入少量H2O2,再滴加KSCN溶液 B.配制100 mL 1 mol·L-1 NaCl溶液时,用托盘天平称取5.85 g NaCl固体 C.将FeCl3饱和溶液煮沸制备Fe(OH)3胶体 D.用紫色石蕊溶液鉴别乙醇、乙酸和苯 2.[2020河南新乡模拟]已知:2Fe3++2I-2Fe2++I2,2Fe2++Br22Fe3++2Br-。向含等物质的量浓度的FeI2、FeBr2混合溶液中通入一定量的氯气后,再滴加少量的KSCN溶液,溶液变红,则下列方程式书写不合理的是( ) A.2I-+2Fe2++2Cl22Fe3++I2+4Cl- B.2Br-+2I-+2Fe2++3Cl2I2+Br2+2Fe3++6Cl- C.2Br-+4I-+2Fe2++4Cl22I2+Br2+2Fe3++8Cl- D.2Fe2++4I-+3Cl22Fe3++2I2+6Cl- 3.[2020湖北三校联考改编][双选]以某硫酸渣(含Fe2O3、SiO2等)为原料制备铁黄[FeO(OH)]的一种工艺流程如图所示: 下列说法不正确的是( ) A.“酸溶”中加热或搅拌或适当增大硫酸浓度均可加快溶解速度 B.滤渣的主要成分是SiO2 C.“沉铁”过程中生成Fe(OH)2的化学方程式为FeSO4+2NH4HCO3Fe(OH)2↓+(NH4)2SO4+2CO2↑ D.“氧化”Fe(OH)2浆液时,可用氯气代替空气 16 4.[2020安徽阜阳模拟]下列实验操作对应的实验现象及实验结论都正确,且两者具有因果关系的是( ) 选项 实验操作 实验现象 实验结论 A 向稀硝酸中加入过量铁粉,充分反应后,再滴加KSCN溶液 有气体生成,溶液呈红色 稀硝酸将Fe氧化为Fe3+ B 将适量铜粉加入1.0 mol·L-1 Fe2(SO4)3溶液中 固体溶解,溶液变蓝 金属铁比铜活泼 C 向0.1 mol·L-1 MgSO4溶液中滴加过量NaOH溶液,再滴加0.1 mol·L-1 CuSO4溶液 先生成白色沉淀,后生成蓝色沉淀 Cu(OH)2的溶度积比Mg(OH)2的小 D 少量铝热剂(只含有一种金属氧化物)溶于足量稀盐酸后,分为两等份,再分别滴加铁氰化钾溶液和KSCN溶液 分别出现蓝色沉淀和溶液变红 铝热剂中可能含有Fe3O4 5.[2019浙江4月选考,4分]某同学设计如图装置(气密性已检查)制备Fe(OH)2白色沉淀。 请回答: (1)仪器1的名称 。装置5的作用 。 (2)实验开始时,关闭K2,打开K1,反应一段时间后,再打开K2,关闭K1,发现3中溶液不能进入4中。请为装置作一处改进,使溶液能进入4中 。 (3)装置改进后,将3中反应后溶液压入4中,在4中析出了灰绿色沉淀。从实验操作过程分析没有产生白色沉淀的原 16 因 。 6.[2019天津南开区模拟,12分]Ⅰ.Fe是生产、生活及生命中的重要元素。 (1)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO2)从而有输送O2的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2的结合能力,药品“美蓝”是其有效的解毒剂,解毒时“美蓝”发生 (填“氧化”或“还原”)反应。 (2)现有一瓶放置了一段时间的某浓度的FeCl3溶液,请设计实验检验其中是否含有Fe3+: 。 (3)普通铁粉与水蒸气在高温下反应生成铁的某种氧化物和氢气,该氧化物和氢气在高温下发生“逆反应”得到“引火铁”。若一定量的普通铁粉和水蒸气在高温下反应生成44.8 L(标况下)H2,则转移电子数目为 (设NA为阿伏加德罗常数的值);“引火铁” 是一种极细的铁粉,它在空气中可以自燃,原因是 。 Ⅱ.化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验: 气体甲可使湿润的红色石蕊试纸变蓝。请回答: (1)M的化学式为 ,气体甲的电子式为 。 (2)白色沉淀乙在空气中变成红褐色沉淀丙的原因是 (用化学方程式表示)。 (3)高温条件下,丁与甲反应生成两种单质和水,该反应的化学方程式为 。 7.[2020贵州贵阳摸底考试,13分]高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3,含少量SiO2)为原料制备高铁酸钠的生产过程如图1所示: 16 图1 已知:Na2FeO4只在碱性环境中稳定存在。 (1)Na2FeO4中铁元素的化合价为 ;下列标志应贴在盛装Na2FeO4容器上的是 (填标号)。 (2)粉碎菱铁矿的目的是 ,“碱浸”过程中SiO2所发生反应的化学方程式为 。 (3)操作1与操作2的名称均为 ,步骤③的目的是将Fe2+氧化成Fe3+, 其离子方程式为 。 (4)高铁酸钠消毒后的还原产物具有净水作用,解释净水原理: 。 (5)已知4FeO42-+10H2O4Fe(OH)3+8OH-+3O2↑,将一定量的Na2FeO4投入到pH不同的工业污水中(污水中其余成分均相同),测得溶液中Na2FeO4的质量浓度变化如图2中曲线Ⅰ、Ⅱ所示。试分析曲线Ⅰ比曲线Ⅱ对应的污水pH (填“高”或“低”)。 图2 16 考点2 铜及其化合物 8.[2020湖南三校联考]向一定量的铜和氧化铁的混合物中加入200 mL 1.5 mol/L的稀硫酸,完全反应后固体无剩余,所得溶液中 只有两种溶质,假设反应前后溶液体积不变,则下列说法错误的是( ) A.原混合物中Cu和Fe2O3的物质的量之比为1∶1 B.反应后的溶液中Fe2(SO4)3的物质的量的浓度为0.5 mol/L C.若用CO还原等质量的原混合物,充分反应后,质量将减少4.8 g D.若用KMnO4溶液来滴定反应后的溶液,完全反应后,将消耗KMnO4 0.04 mol 9.[2020湖北部分重点中学新起点考试]以铜银合金(含少量铁)废料为原料回收银和铜的工艺流程如图所示: 下列说法正确的是( ) A.粗铜溶于过量稀硝酸,过滤、低温干燥得纯铜 B.电解时用粗银作阴极,硝酸银溶液为电解质溶液 C.用稀硫酸处理渣料时主要发生了氧化还原反应 D.从滤液B中可以提取绿矾(FeSO4·7H2O) 10.[2020江西南昌摸底测试,8分]某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如图所示: 16 (1)步骤①的作用是清洗废铁屑表面的油污,其中加热的目的是 。 (2)写出步骤②中生成Fe2+的离子方程式: 。(写一个即可) (3)步骤③中“氯气”不引入杂质但有毒,可以用 代替(填化学式)。 (4)溶液B中只含有Fe2+而不含Fe3+,可证明该事实的实验操作是 。 (5)步骤⑤产生金属铜的化学方程式为 。 考点3 金属材料与金属矿物的开发利用 11.[2020湖南三校联考]下列说法不正确的是( ) A.在金属的冶炼方法中,铝热法本质上属于热还原法 B.化学上所说的钢铁,其实钢是钢,铁是铁,钢是混合物,而铁是纯净物 C.反应FeCuS2+SFeS2+CuS中FeS2既是氧化产物又是还原产物 D.已知BrCl的化学性质跟Cl2相似,则BrCl与水的反应(生成HCl和HBrO)也是氧化还原反应 12.[2020河南洛阳第一次联考]一种利用废干电池中黑色粉末(主要成分为MnO2、炭粉,还含有少量Hg2+、Pb2+等重金属盐)制备MnSO4晶体的工艺流程如图所示: 下列说法错误的是( ) A.反应①中1 mol Fe至多还原1.5 mol MnO2 B.重金属主要在滤渣2中 16 C.步骤③煮沸可使沉淀颗粒长大,目的是便于固液分离 D.合理处理废旧电池有利于资源再利用并防止汞、铅等重金属污染 一、选择题 1.[2020福建福州八县一中联考改编][双选]下列实验操作对应的现象和根据现象得出的结论均正确的是( ) 选项 实验操作 现象 结论 A 向FeCl3溶液中加入浓NaOH溶液 溶液由黄色变为红棕色 生成了氢氧化铁胶体 B 向Co2O3中滴入浓盐酸加热 产生黄绿色气体 氧化性:Cl2查看更多