- 2021-04-28 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学刷题冲刺含最新模拟题专题十四原电池习题含解析
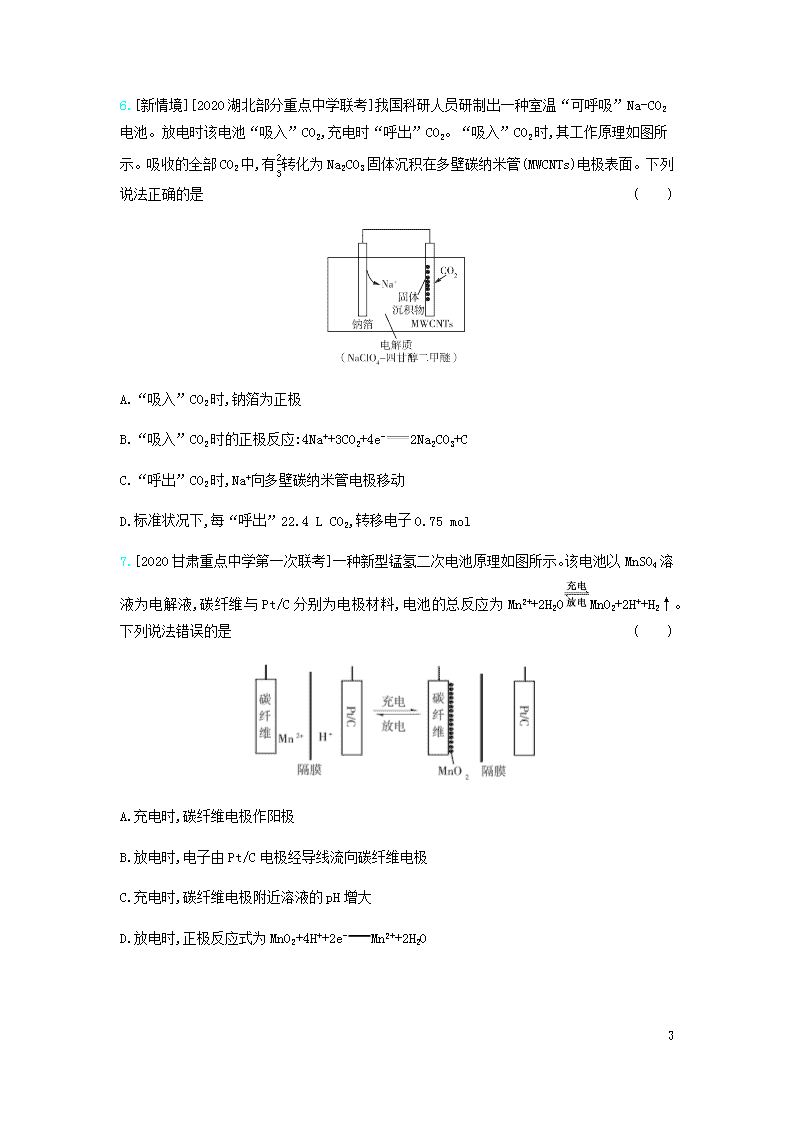
专题十四 原电池 考点1原电池 1.[2020福建三明第一中学模拟]SO2可形成酸雨,是大气污染物,用如图所示装置既可以吸收工厂排放的废气中的SO2,又可以生成一定量的硫酸溶液,下列说法正确的是( ) A.a极为正极,b极为负极 B.生产过程中氢离子由右向左移动 C.从左下口流出的硫酸溶液的质量分数一定大于50% D.负极反应式为SO2+2H2O-2e-SO42-+4H+ 2.[2020湖北武汉部分学校质量监测]某碱性电池的总反应为3HO2-+2AlOH-+2AlO2-+H2O ,工作原理如图所示。下列叙述错误的是( ) A.电子迁移方向: Al→用电器→Pt B.电池工作时,负极附近溶液 pH 减小 C.正极反应式为HO2-+3H+ + 2e- 2H2O D.负极会发生副反应: 2Al + 2OH-+2H2O2AlO2-+ 3H2↑ 3.[2020河北唐山摸底考试]通过膜电池可除去废水中的乙酸钠和对氯苯酚(),其原理如图所示,下列说法错误的是( ) 11 A.该方法能够提供电能 B.b极上的电势比a极上的电势低 C.a极的电极反应为+H++2e- Cl-+ D.电池工作时H+通过质子交换膜由正极区向负极区移动 4.[2019云南昆明诊断测试]利用铜和石墨作电极,在盐酸介质中,铜与氢叠氮酸(HN3)构成原电池,总反应方程式为2Cu+2Cl-+HN3+3H+2CuCl(s)+N2↑+NH4+。下列判断正确的是( ) A.电子从石墨电极流向铜电极 B.溶液中Cl-向石墨电极移动 C.每转移1 mol电子,负极减重64 g D.正极反应式为HN3+2e-+3H+N2↑+NH4+ 考点2 常见的化学电源 5.[2020江西南昌摸底测试]如图利用一种微生物将废水中的有机物(如淀粉)和NO的化学能直接转化为电能,下列说法一定正确的是( ) A.M电极为正极 B.电子流动方向为N→M C.N电极反应式:2NO+4e-+4H+N2+2H2O D.质子透过阳离子交换膜由右向左移动 11 6.[新情境][2020湖北部分重点中学联考]我国科研人员研制出一种室温“可呼吸”Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。“吸入”CO2时,其工作原理如图所示。吸收的全部CO2中,有23转化为Na2CO3固体沉积在多壁碳纳米管(MWCNTs)电极表面。下列说法正确的是( ) A.“吸入”CO2时,钠箔为正极 B.“吸入”CO2时的正极反应:4Na++3CO2+4e-2Na2CO3+C C.“呼出”CO2时,Na+向多壁碳纳米管电极移动 D.标准状况下,每“呼出”22.4 L CO2,转移电子0.75 mol 7.[2020甘肃重点中学第一次联考]一种新型锰氢二次电池原理如图所示。该电池以MnSO4溶液为电解液,碳纤维与Pt/C分别为电极材料,电池的总反应为Mn2++2H2OMnO2+2H++H2↑。下列说法错误的是( ) A.充电时,碳纤维电极作阳极 B.放电时,电子由Pt/C电极经导线流向碳纤维电极 C.充电时,碳纤维电极附近溶液的pH增大 D.放电时,正极反应式为MnO2+4H++2e-Mn2++2H2O 11 8.[2020安徽合肥调研检测]以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),电解质只传导锂离子,通过在室温条件下对锂离子电池进行循环充放电,成功实现了对磁性的可逆调控(如图)。下列说法正确的是( ) A.电解质溶液可用Li2SO4溶液 B.放电时,锂离子向正极移动生成金属锂 C.放电时,Fe作为负极,电池能被磁铁吸引 D.充电时,阳极反应:2Fe+3Li2O-6e-Fe2O3+6Li+ 一、选择题 1.[2020四川绵阳第一次诊断]如图所示为镍锌可充电电池放电时电极发生物质转化的示意图,电池使用KOH和K2Zn(OH)4为电解质溶液。下列关于该电池说法正确的是( ) A.放电时溶液中的K+移向负极 B.充电时阴极附近溶液的pH会降低 C.放电时正极反应为H++NiOOH+e-Ni(OH)2 D.负极质量每减少6.5 g,溶液质量增加6.3 g 11 2.[新情境]锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O2Cu+2Li++2OH-,下列说法不正确的是( ) A.放电时,正极的电极反应式为Cu2O+H2O+2e-2Cu+2OH- B.放电时,电子通过固体电解质向Li极移动 C.通空气时,铜被腐蚀,表面产生Cu2O D.整个反应过程中,氧化剂为O2 3.[2020河北衡水中学一联]一种浓差电池的装置图如图所示,阴、阳离子交换膜交替放置,中间的间隔交替充入河水和海水,选择性透过Cl-和Na+,在两电极形成电势差,进而在外部产生电流。下列关于该电池的说法错误的是( ) A.a电极为正极,电极反应式为2H2O+2e-H2↑+2OH- B.A为阴离子交换膜,C为阳离子交换膜 C.d室的电中性溶液通过b电极表面的氧化作用维持 D.该电池的缺点是离子交换膜价格昂贵,电极产物也没有经济价值 11 4.[2020山东临沂模拟]利用微生物燃料电池进行废水处理,可实现碳氮联合转化。某微生物燃料电池的工作原理如图所示,其中M、N为厌氧微生物电极。下列有关叙述错误的是( ) A.负极反应式为CH3COO--8e-+2H2O2CO2↑+7H+ B.电池工作时,H+由M极区移向N极区 C.相同条件下,M极区生成的CO2与N极区生成的N2的体积之比为3∶2 D.好氧微生物反应器中发生的反应的离子方程式为NH4++2O2NO3-+2H++H2O 5.[2020贵州贵阳摸底考试]在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现。铁片腐蚀过程中发生反应的总化学方程式为2Fe+2H2O+O22Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图所示。 下列说法正确的是( ) A.铁片发生还原反应而被腐蚀 B.铁片腐蚀生成的铁锈可以保护内层的铁不被腐蚀 C.铁片腐蚀过程中负极发生的电极反应: 2H2O+O2+4e-4OH- D.铁片里的铁和碳与食盐水形成了无数微小原电池,发生了电化学腐蚀 6.[2020湖南四校摸底调研联考]碳呼吸电池(如图1所示)被誉为改变世界的创新技术,用碳呼吸电池为钠硫电池充电的装置如图2所示。下列说法不正确的是( ) 11 图1 图2 A.b极是多孔碳电极 B.充电时,Na+通过固体氧化铝陶瓷向M极移动 C.随着反应的进行,碳呼吸电池中C2O42-浓度不断减小 D.充电过程中碳呼吸电池每消耗1 mol Al,N极上可生成1.5x mol S单质 7.[新情境][2020北京朝阳区期中考试]2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。磷酸铁锂锂离子电池充电时阳极反应式为LiFePO4-xLi+-xe-Li1-xFePO4。放电工作示意图如图。下列叙述不正确的是( ) A.放电时,Li+通过隔膜移向正极 B.放电时,电子由铝箔沿导线流向铜箔 C.放电时正极反应为Li1-xFePO4+xLi++xe-LiFePO4 D.磷酸铁锂锂离子电池充放电过程通过Li+迁移实现,C、Fe、P的化合价均不发生变化 8.[新角度]某同学做了如下实验: 11 装置 现象 电流计指针未发生偏转 电流计指针发生偏转 下列说法正确的是( ) A.加热铁片Ⅰ所在烧杯,电流计指针会发生偏转 B.用KSCN溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断电池的正、负极 C.铁片Ⅰ、Ⅲ的腐蚀速率相等 D.“电流计指针未发生偏转”说明铁片Ⅰ、Ⅱ均未被腐蚀 9.[2019河南郑州二测]如图所示为一种利用原电池原理设计的测定O2含量的气体传感器示意图,RbAg4I5是只能传导Ag+的固体电解质。O2可以通过聚四氟乙烯膜与AlI3反应生成Al2O3和I2,通过电池电位计的变化可以测得O2的含量。下列说法正确的是( ) A.正极反应为3O2+12e-+4Al3+2Al2O3 B.气体传感器的总反应为3O2+4AlI3+12Ag2Al2O3+12AgI C.外电路转移0.01 mol电子时,消耗O2的体积为0.56 L D.气体传感器充电时,Ag+向多孔石墨电极移动 10.[新情境]美国犹他大学 Minteer教授成功构筑了H2-N2生物燃料电池。该电池以氮气和氢气为原料,氢化酶和固氮酶为两极催化剂,质子交换膜(能够传递H+)为隔膜,在室温条件下实现了氨的合成同时还能提供电能(原理如图)。下列说法错误的是( ) 11 A.A极为负极 B.B极发生的电极反应为MV2++e-MV+ C.电池工作时电子由A极经负载流向B极 D.电路中每通过3 mol电子,生成22.4 L NH3 11.[2019四省八校联考]某学习小组的同学查阅相关资料知氧化性:Cr2O72->Fe3+,设计了盐桥式的原电池,装置如图所示,盐桥中装有琼脂与饱和K2SO4溶液。下列叙述正确的是( ) A.甲烧杯中发生还原反应 B.乙烧杯中发生的电极反应为2Cr3++7H2O-6e-Cr2O72-+14H+ C.外电路的电流方向是从b到a D.电池工作时,盐桥中的SO42-移向乙烧杯 二、非选择题(共19分) 12.[新情境][4分]有人将合成氨反应设计成原电池,装置如图所示。 (1)放电时正极反应式为 。 11 (2)已知该原电池的标准电动势Eθ=a V。25 ℃时反应的平衡常数K与Eθ之间存在定量关系lg K=nEθ0.0591(n为原电池反应转移的电子数),则合成氨反应(N2+3H22NH3)的平衡常数K为 (用含a的代数式表示,不需要化简)。 13.[15分]为实现废旧普通干电池中锌与MnO2的回收,某研究小组设计了如图1的工艺流程和如图2的实验探究装置。 图1 图2 回答下列问题: (1)普通锌锰干电池放电时被还原的物质是 ,用离子方程式解释其被称为“酸性”电池的原因: 。 (2)测得滤液中c(ZnSO4)略大于c(MnSO4),则稀硫酸酸浸时发生主要反应的化学方程式为 ,粉碎的重要作用是 。 (3)燃料电池的优点是 ,图2中甲烷燃料电池负极的电极反应为 。 (4)闭合开关K一段时间后,阳极附近溶液的pH (填“增大”“不变”或“减小”),电解池中回收锌与MnO2的总反应的离子方程式为 。 (5)若燃料电池中负极消耗2.24 L(标准状况)CH4,且完全转化为电能,电解池中回收制得19.5 g单质Zn,计算图2装置的电流效率η= 。(η=生成目标产物消耗的电子数转移的电子总数×100%) 11 11查看更多