- 2021-05-07 发布 |
- 37.5 KB |
- 8页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】四川省宜宾市叙州区第一中学校2020届高三第一次高考适应性考试理综
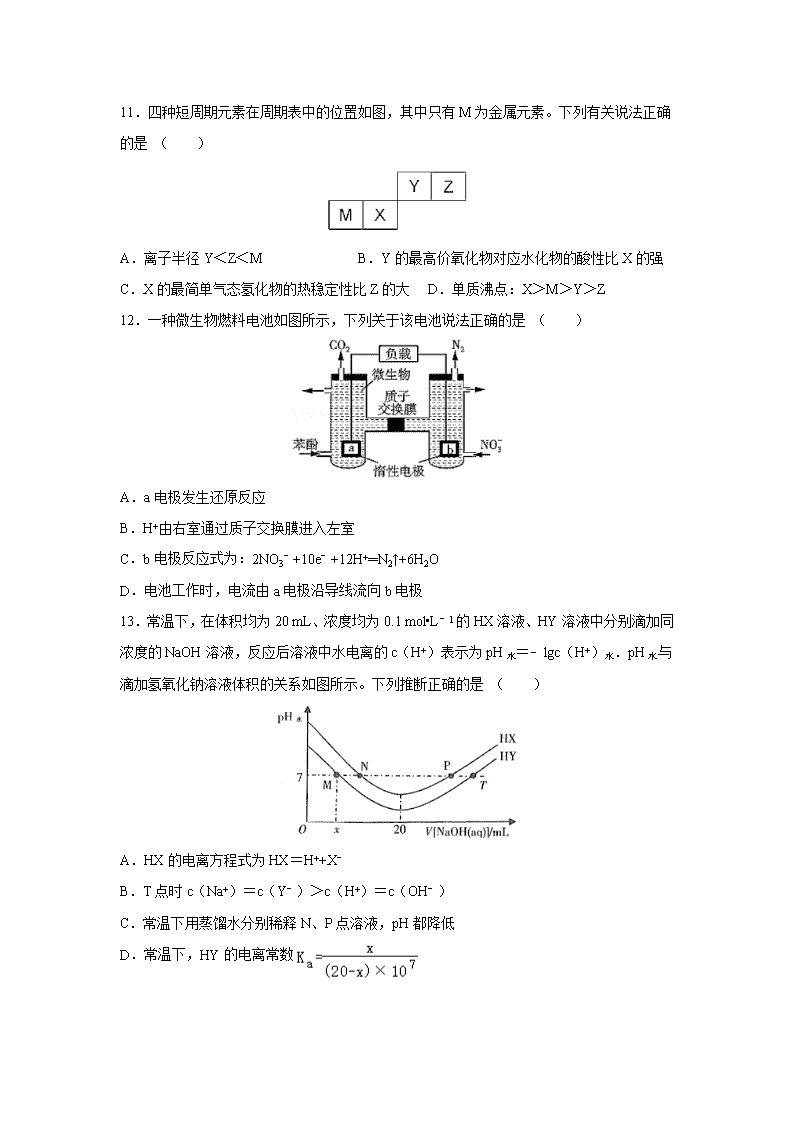
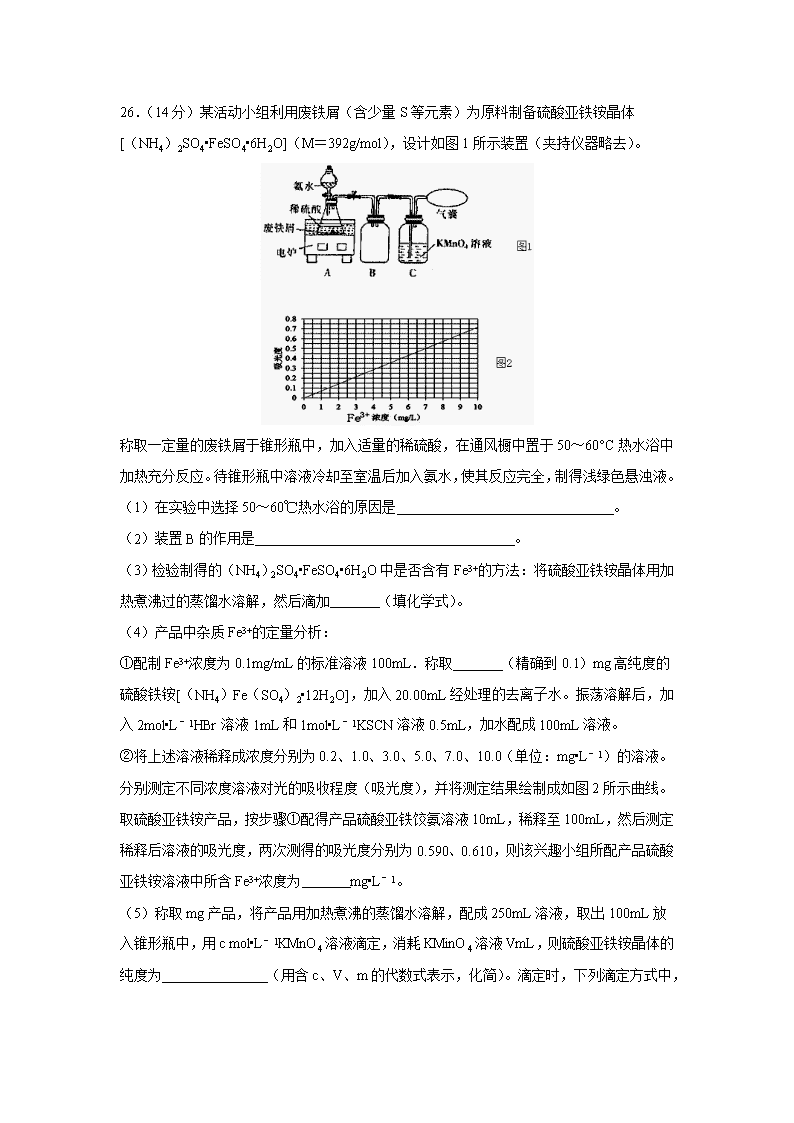
四川省宜宾市叙州区第一中学校2020届高三第一次高考适应性考试理综 7.化学与材料、生活和环境密切相关.下列有关说法中错误的是( ) A.新型材料聚酯纤维、光导纤维都属于有机高分子 B.医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性 C.大力实施矿物燃料脱硫脱硝技术以减少硫、氮氧化物排放 D.煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 8.下列装置能达到实验目的是( ) A.熔化Na2CO3 B.验证SO2氧化性 C.实验室制取NH3 D.保存液溴 9.设NA为阿伏伽德罗常数的值。下列说法正确的是( ) A.标准状况下,2.24L SO3中含原子数为0.2NA B.10mL 12mol/L浓盐酸与足量MnO2加热反应,制得氯气的分子数0.03NA C.0.1mol CH4与0.4mol Cl2在光照下充分反应,生成CCl4的分子数为0.1NA D.常温常压下,6g乙酸中C﹣H键的数目为0.3NA 10.有机物邻二乙烯苯广泛用于制造离子交换树脂,其结构简式为,下列关于邻二乙烯苯的说法正确的是 ( ) A.1mol邻二乙烯苯含有5mol碳碳双键 B.所有的原子不可能在同一平面 C.能发生加成反应,也能发生取代反应,不能发生聚合反应 D.苯环上的二氯取代物有4种(不含立体异构) 11.四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列有关说法正确的是 ( ) A.离子半径Y<Z<M B.Y的最高价氧化物对应水化物的酸性比X的强 C.X的最简单气态氢化物的热稳定性比Z的大 D.单质沸点:X>M>Y>Z 12.一种微生物燃料电池如图所示,下列关于该电池说法正确的是 ( ) A.a电极发生还原反应 B.H+由右室通过质子交换膜进入左室 C.b电极反应式为:2NO3﹣+10e﹣+12H+═N2↑+6H2O D.电池工作时,电流由a电极沿导线流向b电极 13.常温下,在体积均为20 mL、浓度均为0.1 mol•L﹣1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)表示为pH水=﹣lgc(H+)水.pH水与滴加氢氧化钠溶液体积的关系如图所示。下列推断正确的是 ( ) A.HX的电离方程式为HX=H++X﹣ B.T点时c(Na+)=c(Y﹣)>c(H+)=c(OH﹣) C.常温下用蒸馏水分别稀释N、P点溶液,pH都降低 D.常温下,HY的电离常数 26.(14分)某活动小组利用废铁屑(含少量S等元素)为原料制备硫酸亚铁铵晶体[(NH4)2SO4•FeSO4•6H2O](M=392g/mol),设计如图1所示装置(夹持仪器略去)。 称取一定量的废铁屑于锥形瓶中,加入适量的稀硫酸,在通风橱中置于50~60°C热水浴中加热充分反应。待锥形瓶中溶液冷却至室温后加入氨水,使其反应完全,制得浅绿色悬浊液。 (1)在实验中选择50~60℃热水浴的原因是 。 (2)装置B的作用是 。 (3)检验制得的(NH4)2SO4•FeSO4•6H2O中是否含有Fe3+的方法:将硫酸亚铁铵晶体用加热煮沸过的蒸馏水溶解,然后滴加 (填化学式)。 (4)产品中杂质Fe3+的定量分析: ①配制Fe3+浓度为0.1mg/mL的标准溶液100mL.称取 (精确到0.1)mg高纯度的硫酸铁铵[(NH4)Fe(SO4)2•12H2O],加入20.00mL经处理的去离子水。振荡溶解后,加入2mol•L﹣1HBr溶液1mL和1mol•L﹣1KSCN溶液0.5mL,加水配成100mL溶液。 ②将上述溶液稀释成浓度分别为0.2、1.0、3.0、5.0、7.0、10.0(单位:mg•L﹣1)的溶液。分别测定不同浓度溶液对光的吸收程度(吸光度),并将测定结果绘制成如图2所示曲线。取硫酸亚铁铵产品,按步骤①配得产品硫酸亚铁饺氨溶液10mL,稀释至100mL,然后测定稀释后溶液的吸光度,两次测得的吸光度分别为0.590、0.610,则该兴趣小组所配产品硫酸亚铁铵溶液中所含Fe3+浓度为 mg•L﹣1。 (5)称取mg产品,将产品用加热煮沸的蒸馏水溶解,配成250mL溶液,取出100mL放入锥形瓶中,用c mol•L﹣1KMnO4溶液滴定,消耗KMinO4溶液VmL,则硫酸亚铁铵晶体的纯度为 (用含c、V、m的代数式表示,化简)。滴定时,下列滴定方式中,最合理的是 (填字母)。 若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,实验结果将会 (填“偏大*偏小”或“无影响”。) 27.(14分)磷酸铝(AlPO4)是一种用途广泛的材料,在建筑、耐火材料、化工等方面具有广泛的应用前景。以磷硅渣[主要成分为Ca3(PO4)2、Al2O3、SiO2和V2O5等]为原料制备磷酸铝的工艺流程如图所示: 请回答下列问题: (1)酸浸液中含磷元素的主要粒子是 (填化学式,下同),浸渣中的主要化学成分是 。 (2)生石灰除了调节pH外,另一作用是 。 (3)滤液中钒元素以V3O93﹣形式存在,V3O93﹣易水解为[VO3(OH)]2﹣,该水解反应的离子方程式为 。 (4)碱浸时,粗磷酸铝转化为可溶性溶质,则可溶性溶质分别是 (填化学式)。 (5)实验测得pH、反应温度与时间对碱浸时固相中P、Al含量的影响如图所示: 则最优反应条件是 (6)固相反应制备磷酸铝的方法之一是在900℃的焙烧炉内加热磷酸二氢铵与氧化铝混合物,写出该反应的化学方程式: 。 (7)已知:Ksp(AlPO4)=6.3×10﹣19、Ksp[Ca3(PO4)2]=2.0×10﹣29.在物质的量浓度分别为0.01mo•L﹣1的CaCl2和AlCl3的混合溶液中加入等体积的Na3PO4溶液,若使A13+恰好沉淀完全,即溶液中c(A13+)=1.0×10﹣5mol•L﹣1,此时是否有Ca3(PO4)2沉淀生成: (列式计算)。 28.(15分)CO2、CO是化石燃料燃烧后的主要产物。 (1)将体积比为2:1的CO2和CO混合气体通入有适量Na2O2固体的密闭容器中,同时不断地用电火花点燃,产生一种固体物质,将该物质溶于水配成溶液。已知25℃时,该溶液的Kh1=5×10﹣5mol•L﹣1,则当溶液中c(HCO3﹣):c(CO32﹣)=1:2时,试求溶液的pH约为 (2)已知:2CO(g)+O2(g)=2CO2(g)△H=﹣566.0kJ•mol﹣1键能E(O=O)=499.0kJ•moI﹣1。 ①CO(g)+O2(g)⇌CO2(g)+O(g)的△H= kJ•moI﹣1 ②已知2500K时,①中反应的平衡常数为0.40,某时刻该反应体系中各物质浓度满足:c(CO)•c(O2)=c(CO2)•c(O),则此时反应 (填“向左”或“向右”)进行。 (3)在容积可变的密闭容器中发生反应CO2(g)+H2(g)⇌CO(g)+H2O(g),c(CO)随反应时间t变化如图中曲线Ⅰ所示,此时平衡时容器体积为3L若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅰ当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。 当通过改变压强使曲线Ⅰ变为曲线Ⅲ时,曲线Ⅲ达到平衡时容器的体积为 。 35.(15分)2016年中国科学家成功合成NiO/TiO2电解水催化剂和新型高效的钙钛矿太阳能电池,为解决能源危机保护环境作出了重大贡献。请回答下列问题: (1)TiO2与焦炭、Cl2在高温下反应的化学方程式为:TiO2+2C+2Cl2TiCl4+2CO ①基态钛原子的价电子排布式为 。 ②该反应中涉及到的非金属元素的电负性大小顺序为 。 (2) 已知NiO/TiO2催化化合物甲生成化合物乙的过程如图所示: 化合物甲的沸点小于化合物乙的沸点,主要原因是 。 在化合物乙中,氧原子的杂化方式是 。 (3)CH3NH3+、Ti4+、Pb2+、Cl﹣等离子是组成新型钙钛矿太阳能电池的主要离子。CH3NH3+离子中H﹣N﹣H键的键角比NH3分子中H﹣N﹣H键的键角 (填“大”或“小”),原因是 。 (4)Sb(锑)和Ga(镓)的卤化物有很多用途。一定条件下将SbCl3与 GaCl3以物质的量之比为l:l反应得到一种固态离子化合物,有人提出了以下两种结构。你认为下列关于结构和说法中合理的是 。 a.[SbCl2+][GaCl4﹣] b.[GaCl2+][SbCl4﹣] c.没有相关资料,无法判断 (5)金属钛晶胞(如图1所示)中有若干个正四面体空隙,图1中a、b、c、d四个钛原子形成的正四面体其内部空隙中可以填充其他原子。 ①请回答,金属钛晶胞的结构属于 a.简单立方 b.体心立方 c.面心立方 d.金刚石型 ②若晶胞中所有的正四面体空隙中都填充氢原子,那么形成的氢化钛的化学式为 。 (6)某钙钛矿太阳能电池材料的晶胞如图2所示,其晶胞参数为dpm、密度为ρg•cm﹣3.则该晶体的摩尔质量 g•mol﹣1. (用含d、ρ等符号的式子表示,用NA表示阿伏加德罗常数的值 ) 36.(15分)Prolitane是一种抗抑郁药物,以芳香烃A为原料的合成路线如下: 请回答以下问题: (1)D的化学名称为 ,D→E的反应类型为 。 (2)G的官能团名称为 。 (3)B的结构简式为 。 (4)F→G的化学方程式为 。 (5)X是D的同系物,x分子比D分子少一个碳原子,且能发生银镜反应,则满足此条件的X共有 种(不含立体异构);其中核磁共振氢谱显示为5组峰,其峰面积比为3:2:2:2:1,写出符合该要求的Ⅹ的一种同分异构体的结构简式: 。 (6)参照 Prolitane的合成路线,设计一条由苯和乙醇为原料制备苯甲酸乙酯的合成路线(其他无机试剂和溶剂任选)。 。 【参考答案】 7-13:A B D D B C D 26.(1):加快反应速率,受热均匀;(2):防止倒吸;(3):KSCN溶液;(4):86.1;②:85;(5):%;B;无影响。 27.(1):H3PO4;SiO2、CaSO4;(2):除去过量的硫酸根离子; (3):V3O93﹣+3H2O⇌3[VO3(OH)]2﹣+3H+;(4):NaAlO2、Na3PO4; (5):pH=12、温度为80℃、时间为1h;(6):2NH4H2PO4+Al2O32AlPO4+2NH3↑+3H2O;(7):物质的量浓度分别为0.01mol•L﹣1的CaCl2和AlCl3的混合溶液中加入等体积的NaPO4溶液,c(Ca2+)=0.01mol/L×=0.005mol/L,c(Al3+)=1.0×10﹣5mol•L﹣1,此时c(PO43﹣)==6.3×10﹣14mol/L,Qc[Ca3(PO4)2]=(0.005)3×(6.3×10﹣14)2=5.0×10﹣34<Ksp=2.0×10﹣29,没有Ca3(PO4)2沉淀。 28.(1):10;(2):﹣33.5;②:向左;(3):加入催化剂; 2L; 35.(1):3d24s2;②:O>Cl>C;(2):二者均为分子晶体,化合物乙能形成分子间氢键; (3):成键电子(C﹣N键)对H﹣N键的排斥力小于孤电子对对H﹣N键的排斥力; (4):a;(5):c;②:TiH2;(6):d3ρNA×10﹣30。 36.(1):苯乙酸乙酯;取代反应;(2):羰基;(3):;(4):;(5):14;; (6):。查看更多