- 2021-05-07 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
难溶电解质的溶解平衡高考题
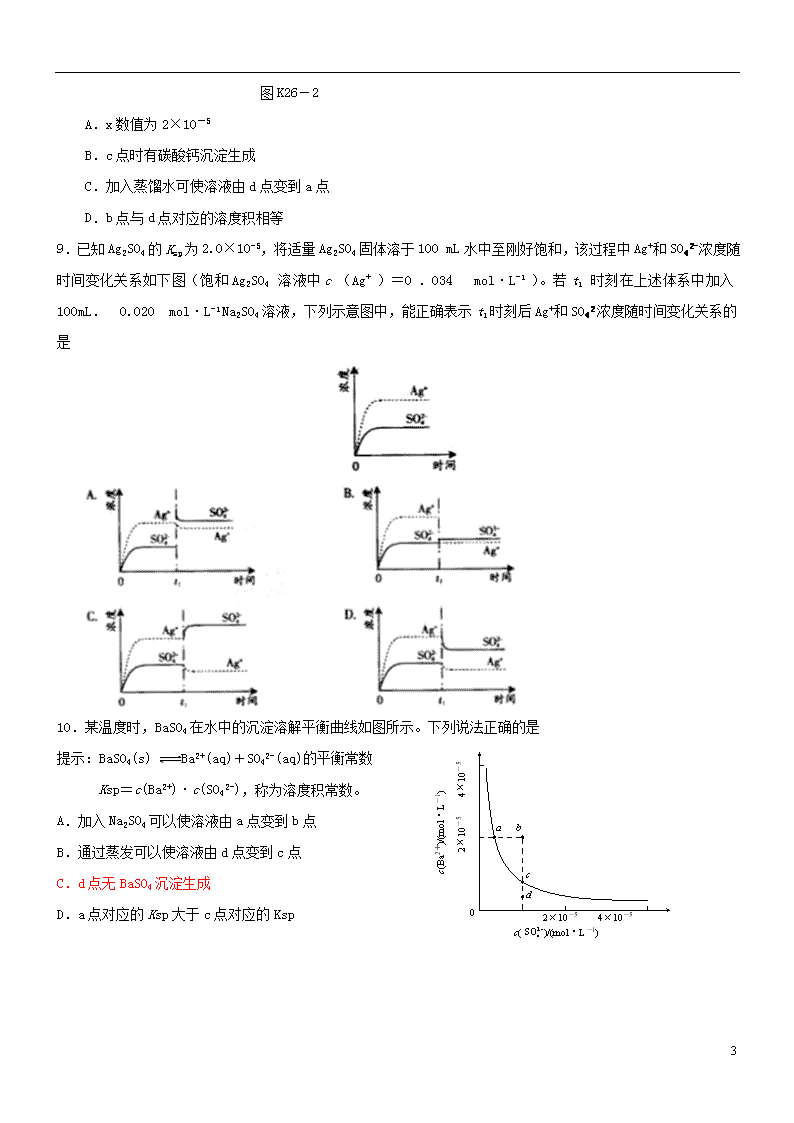
难溶电解质的溶解平衡 1.下列对沉淀溶解平衡的描述正确的是( ) A.开始时,溶液中各离子浓度相等 B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 2.在BaSO4饱和溶液中,加入Na2SO4(s),达平衡时( ) A.c(Ba2+)=c(SO) B.c(Ba2+)=c(SO)=[Ksp(BaSO4)]1/2 C.c(Ba2+)≠c(SO),c(Ba2+)·c(SO)=Ksp(BaSO4) D.c(Ba2+)≠c(SO),c(Ba2+)·c(SO)≠Ksp(BaSO4) 3.[2012·扬州三模] 下列说法不正确的是( ) A.常温下反应2Na2SO3(s)+O2(g)===2Na2SO4(s)能自发进行,则ΔH<0 B.Al2(SO4)3溶液蒸干所得固体产物为Al(OH)3 C.电解NH4Cl和HCl混合溶液在阴极可生成H2 D.用碳酸钠溶液浸泡锅炉水垢:CO+CaSO4===CaCO3+SO 4.[2012·江西六校第一次联考] 在溶液中有浓度均为0.01 mol·L-1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知: Ksp[Fe(OH)3]=2.6×10-39; Ksp[Cr(OH)3]=7.0×10-31; Ksp[Zn(OH)2]=1.0×10-17; Ksp[Mg(OH)2]=1.8×10-11。 当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小( ) A.Fe3+ B.Cr3+ C.Zn2+ D.Mg2+ 5.溶液中含有Cl-、Br-和I-三种离子,其浓度均为0.01 mol·L-1,现向溶液中逐滴加入AgNO3溶液时,最先和最后沉淀的是( ) 已知: Ksp(AgCl)=1.8×10-10(mol·L-1)2, Ksp(AgBr)=5.0×10-13(mol·L-1)2, Ksp(AgI)=8.3×10-17(mol·L-1)2。 A.AgBr和AgI 7 B.AgI 和AgCl C.AgBr和AgCl D.同时沉淀 6.某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图K26-1所示。据图分析,下列判断错误的是( ) 图K26-1 A.Ksp[Fe(OH)3]查看更多