备战2021年高考化学模拟专练卷09(学生版)
模拟专练卷 09
化学
可能用到的相对原子质量:H-1 C-12 O-16 Cl-35.5 Se-79 Sn-119
一、选择题:本题共 7 个小题,每小题 6 分。共 42 分,在每小题给出的四个选项中,只有一项是符合题目要求
的。
7.化学与生产、生活及环境密切相关,下列说法不正确的是( )
A.针对新冠肺炎疫情,可用高锰酸钾溶液、无水酒精、双氧水对场所进行杀菌消毒
B.常用危险化学品标志中的数字主要表示的是危险的级别
C.硅胶常用作食品干燥剂,也可以用作催化剂载体
D.葡萄酒中通常含有微量 SO2
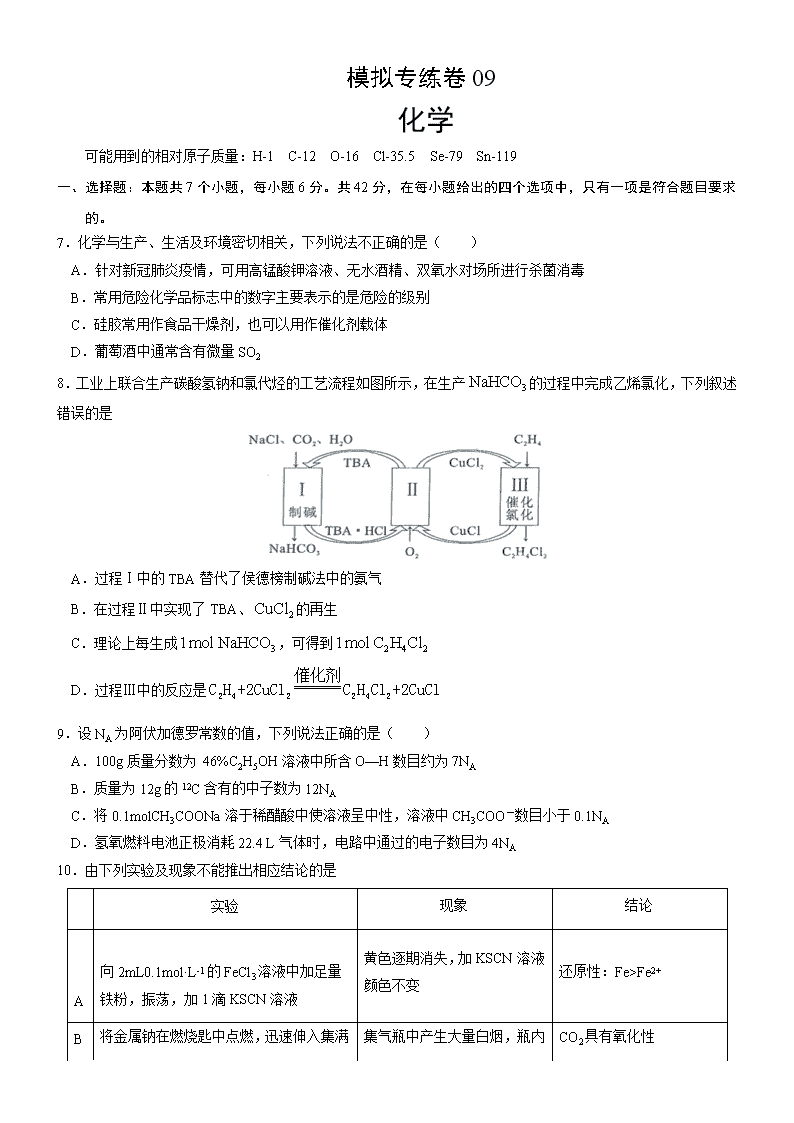
8.工业上联合生产碳酸氢钠和氯代烃的工艺流程如图所示,在生产 3NaHCO 的过程中完成乙烯氯化,下列叙述
错误..的是
A.过程Ⅰ中的 TBA 替代了侯德榜制碱法中的氨气
B.在过程Ⅱ中实现了 TBA、 2CuCl 的再生
C.理论上每生成 31mol NaHCO ,可得到 2 4 21mol C H Cl
D.过程Ⅲ中的反应是 2 4 2 2 4 2
催化剂
C H +2CuCl C H Cl +2CuCl
9.设 NA 为阿伏加德罗常数的值,下列说法正确的是( )
A.100g 质量分数为 46%C2H5OH 溶液中所含 O—H 数目约为 7NA
B.质量为 12g 的 12C 含有的中子数为 12NA
C.将 0.1molCH3COONa 溶于稀醋酸中使溶液呈中性,溶液中 CH3COO-数目小于 0.1NA
D.氢氧燃料电池正极消耗 22.4 L 气体时,电路中通过的电子数目为 4NA
10.由下列实验及现象不能推出相应结论的是
实验 现象 结论
A
向 2mL0.1mol·L-1 的 FeCl3 溶液中加足量
铁粉,振荡,加 1 滴 KSCN 溶液
黄色逐期消失,加 KSCN 溶液
颜色不变
还原性:Fe>Fe2+
B 将金属钠在燃烧匙中点燃,迅速伸入集满 集气瓶中产生大量白烟,瓶内 CO2 具有氧化性
CO2 的集气瓶 有黑色颗粒产生
C
加热盛有少 NH4HCO3 固体的试管,并在
试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝 NH4HCO3 显碱性
D
向 2 支盛有 2mL 相同浓度银氨溶液的试
管中分别加入2滴相同浓度的NaCl和NaI
溶液
一只试管中产生黄色沉淀,另
一支中无明显现象 Ksp(AgI)
X
C.简单阳离子氧化性:W>Y
D.W 和 Y 形成的化合物与水反应能生成一种还原性气体
12.丙烯酸羟乙酯(Ⅲ)可用作电子显微镜的脱水剂,可用下列方法制备:
下列说法不正确的是
A.化合物Ⅰ能与 NaHCO3 溶液反应生成 CO2
B.可用 Br2 的 CCl4 溶液检验化合物Ⅲ中是否混有化合物 I
C.化合物Ⅱ与乙醛互为同分异构体
D.化合物Ⅲ水解可生成 2 种有机物
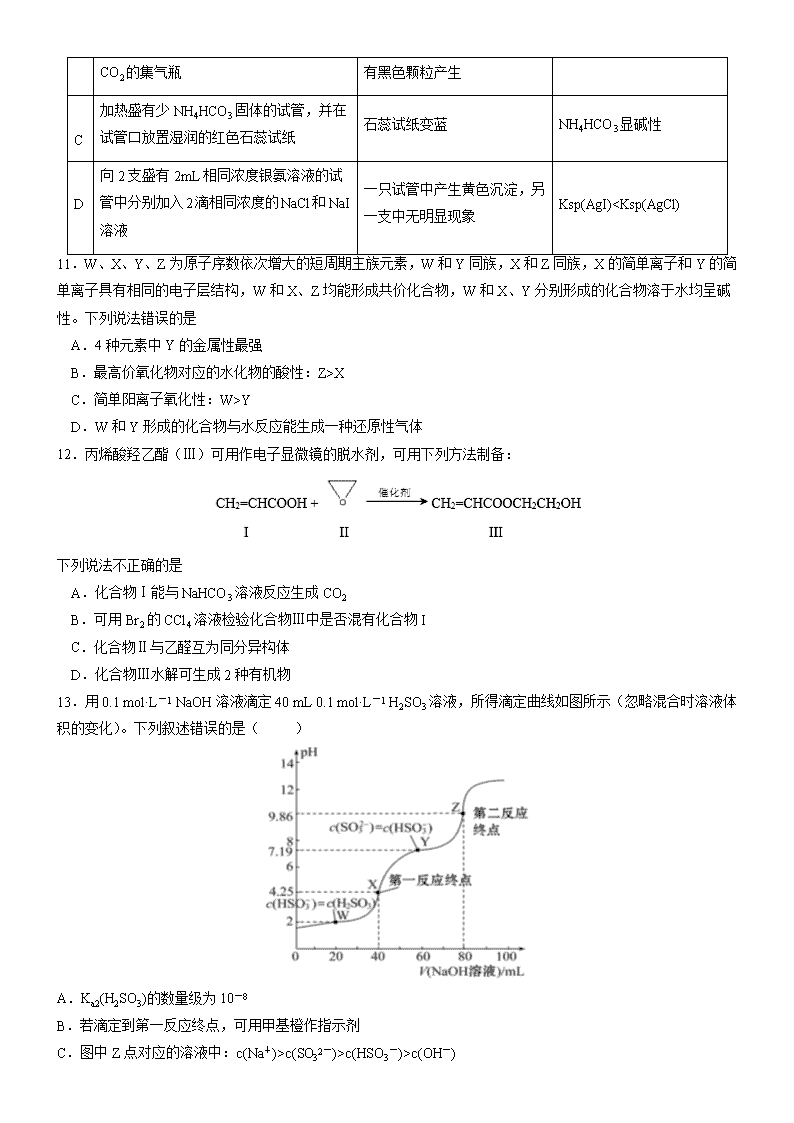
13.用 0.1 mol·L-1 NaOH 溶液滴定 40 mL 0.1 mol·L-1 H2SO3 溶液,所得滴定曲线如图所示(忽略混合时溶液体
积的变化)。下列叙述错误的是( )
A.Ka2(H2SO3)的数量级为 10-8
B.若滴定到第一反应终点,可用甲基橙作指示剂
C.图中 Z 点对应的溶液中:c(Na+)>c(SO32-)>c(HSO3
-)>c(OH-)
D.图中 Y 点对应的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH-)
二、非选择题:共 58 分,第 26~28 题为必考题,每个试题考生都必须作答。第 35~36 题为选考题,考生根据要
求作答。
(一)必考题:共 43 分。
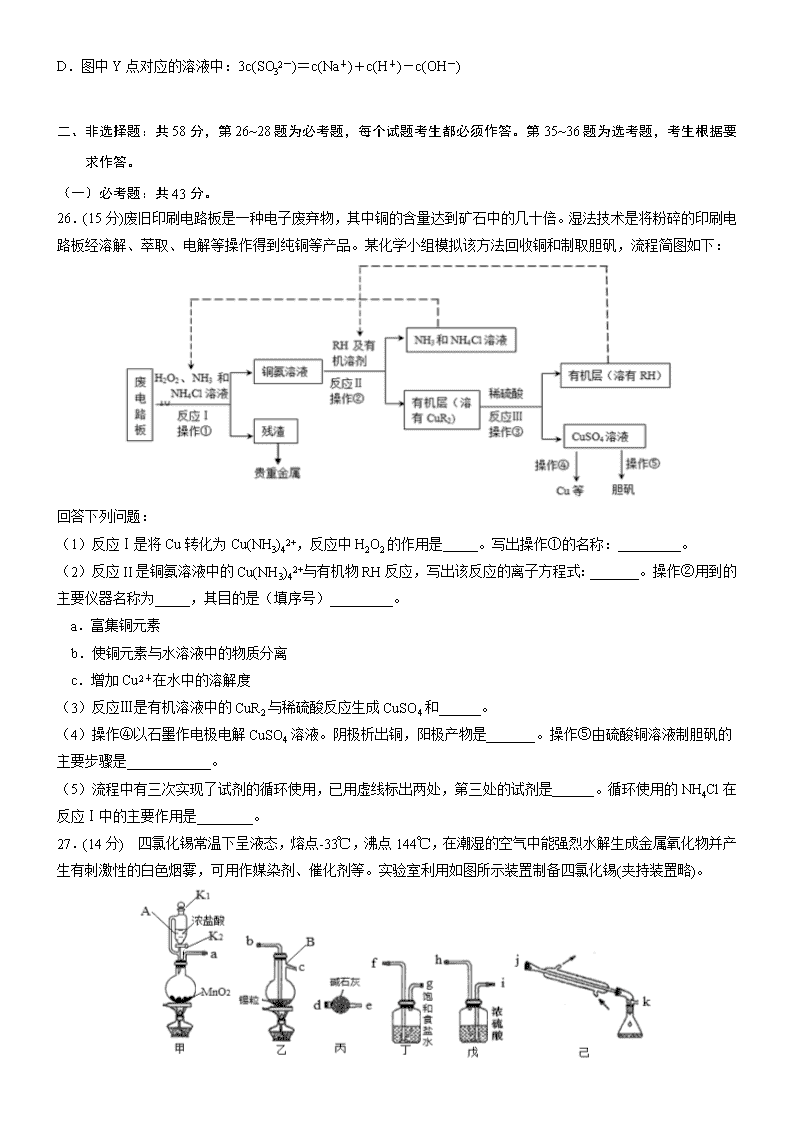
26.(15 分)废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电
路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:
回答下列问题:
(1)反应Ⅰ是将 Cu 转化为 Cu(NH3)42+,反应中 H2O2 的作用是_____。写出操作①的名称:_________。
(2)反应 II 是铜氨溶液中的 Cu(NH3)42+与有机物 RH 反应,写出该反应的离子方程式:_______。操作②用到的
主要仪器名称为_____,其目的是(填序号)_________。
a.富集铜元素
b.使铜元素与水溶液中的物质分离
c.增加 Cu2+在水中的溶解度
(3)反应Ⅲ是有机溶液中的 CuR2 与稀硫酸反应生成 CuSO4 和______。
(4)操作④以石墨作电极电解 CuSO4 溶液。阴极析出铜,阳极产物是_______。操作⑤由硫酸铜溶液制胆矾的
主要步骤是____________。
(5)流程中有三次实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是______。循环使用的 NH4Cl 在
反应Ⅰ中的主要作用是________。
27.(14 分) 四氯化锡常温下呈液态,熔点-33℃,沸点 144℃,在潮湿的空气中能强烈水解生成金属氧化物并产
生有刺激性的白色烟雾,可用作媒染剂、催化剂等。实验室利用如图所示装置制备四氯化锡(夹持装置略)。
回答下列问题:
(1)甲装置中发生反应的离子方程式为_________,仪器 B 的名称是_____。
(2)按照气流方向连接装置,接口顺序为_________。
(3)实验开始时需向圆底烧瓶中缓慢滴加浓盐酸,此时应打开仪器 A 的活塞_____(填“K1”、“K2”或“K1 和 K2”)。
排尽装置中的空气后才能点燃乙处的酒精灯,判断装置中空气已排尽的现象是______。
(4)丙装置的作用是_____,若没有丙装置,可能发生的化学反应方程式为____。
(5)实验制得 30g 溶有氯气的 SnCl4,其中氯气质量分数为 13.0%,则至少需向乙中通入标准状况的氯气_______L
(保留 2 位小数) 。提纯该 SnCl4 的方法是______(填序号)。
a.用 NaOH 溶液洗涤再蒸馏 b.升华 c.重结晶 d.蒸馏 e.过滤
28.(14 分)非金属及其化合物在工农业生产、生活中有着重要应用,减少非金属的氧化物在大气中的排放是环境
保护的重要内容之一。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
若某反应的平衡常数表达式为:K=
2
2 2
2 2
c(N ) c (CO )
c (NO) c (CO)
,请写出此反应的热化学方程式___。
(2)N2O5 在一定条件下可发生分解:2N2O5(g) 4NO2(g)+O2(g) △H>0。向恒容密闭容器加入 N2O5。某温
度下测得恒容密闭容器中 N2O5 浓度随时间的变化如下表:
t/min 0.00 1.00 2.00 3.00 4.00 5.00
c(N2O5)/(mo·L-1) 1.00 0.71 0.50 0.35 0.35 0.35
反应开始时体系压强为 P0,第 3.00min 时体系压强为 p1,则 p1:p0=__;1.00min~3.00min 内,O2 的平均反应速率
为__。从表中可知化学反应速率变化规律是__。
①该温度下反应的平衡常数 Kp=__(用平衡分压代替平衡浓度计算,分压=总压×物质的量的分数,请列出用 P0 表
示平衡常数表达式,不用计算)。
②一定温度下,在恒容密闭容器中充入一定量 N2O5 进行该反应,能判断反应已达到化学平衡状态的是__。
a.容器中压强不再变化 b.NO2 和 O2 的体积比保持不变
c.2v 正(NO2)=v 逆(N2O5) d.混合气体的密度保持不变
(3)“长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,
既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分)。某校外研究性学习小组
拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析 B 极发生的电极反应式为__。
(二)选考题:共 15 分。请考生从 2 道化学题中任选一题作答。如果多做,则按所做的第一题计分。
35.[化选修 3:物质结构与性质](15 分)
氮、硒形成的单质及其化合物有重要的科学研究价值,请回答下列问题:
(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。基态氮原子的价电子
轨道表示式为______________;其核外电子共占据____个能级;邻氨基吡啶的铜配合物中 Cu2+的配位数是
_______。
(2)高聚氮晶体结构如图所示,每个氮原子与另外三个氮原子结合形成空间网状结构。固态高聚氮是_______
晶体;该晶体中 n(N)与 n(N—N)之比为_______;这种高聚氮 N—N 键的键能为 160 kJ·mol-1,而 N2 的键能为 942
kJ·mol-1,其可能潜在的应用是__________。
(3)NO3
-的空间构型是________;HNO3 的酸性比 HNO2 强,试从结构的角度解释其原因__________。
(4)硒有三种晶体(α单斜体、β单斜体和灰色三角晶),灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,
分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图和晶胞俯
视图如图所示:
已知正六棱柱的边长为 a cm,高为 b cm,阿伏加德罗常数的值为 NA,则该晶体的密度为_____g·cm-3(用含 NA、
a、b 的式子表示)。
36.[化选修 5:有机化学基础](15 分)
海南粗榧新碱具有抗肿瘤、抗炎等作用,其中间体 G 的合成线路如图:
已知:
①R-COOH+R′-NH2 2SOCl
O H
|| |
R-C- N R′
+H2O;
②R-CN 2
4
NiCl
NaBH
回答下列问题:
(1)X 为醛类物质,其名称为________,C 中含氧官能团的名称为________。
(2)C→D 的反应类型为________。
(3)化合物 F 的结构简式为________。
(4)B 与新制的氢氧化铜悬浊液反应的化学方程式为________。
(5)有机物 Y 是 A 的同分异构体,满足条件:①能与 3FeCl 溶液发生显色反应,②1mol Y 与足量金属 Na 反
应生成 21mol H ,③结构中含“ ”,Y 共有________种,其中核磁共振氢谱显示为 4 组峰,且峰面积比为
2: 2:1:1的物质为________(写出其中一种结构简式)。
(6)设计以 为起始原料制备 的合成线路(无机试剂任选) ________。